液相色谱-质谱-质谱联用仪测定花生油中黄曲霉毒素B1
周 琴,刘新月,李绍仙,张晓花,谭文涵
(普洱市质量技术监督综合检测中心,云南普洱 665000)
花生油含有丰富的不饱和脂肪酸,其中油酸能降低低密度脂蛋白胆固醇水平,而不会破坏高密度脂蛋白,有助于维持血脂平衡,预防心血管疾病[1]。此外,油酸还具有抗炎、预防肥胖、预防衰老、预防动脉硬化和增强自身免疫力的功能[2-3]。然而,在对人体有益的同时,花生油也存在安全隐患。黄曲霉毒素(Aflatoxin,AFT)是造成花生油污染的主要原因之一[4],在自然界中其主要以黄曲霉毒素B1、B2、G1和G2存在,具有强毒性、致癌性、致畸性和致突变性,而黄曲霉毒素B1(AFB1)含量最高[5-6]。何景等[7]2019年在抽检北京小包装花生油时,黄曲霉毒素检出率为26.67%。胡振等[8]在对2016—2017年广西14个地级市抽检食用植物油样品时发现,花生油中黄曲霉毒素B1检出率达到8.85%,花生油合格率仅为87.83%。真菌毒素是对人和动物有严重慢性毒性的物质[9],如果大量摄入或长期少量摄入黄曲霉毒素,可能会导致慢性中毒、增加致癌风险。因此,研究花生油中黄曲霉毒素B1的检测方法具有重要意义。
黄曲霉毒素检测方法有酶联免疫法(Enzyme-Linked Immunosorbent Assay,ELISA)[10]、高效液相色谱法(High Performance Liquid Chromatography,HPLC)[11]等,酶联免疫吸附法简单、快速、特异性高,但假阳性较多;高效液相色谱法具有良好的准确性和高灵敏度,但需要衍生,检测周期长,且较浪费溶剂。液相色谱-质谱-质谱联用仪(LC-MS/MS)特异性强,定性定量准确,检出限低,从而被广泛应用于农残、兽残以及真菌毒素类的痕量检测领域[12-15]。黄曲霉毒素的离子化状态可利用电喷雾离子源实现,电喷雾离子源有正、负离子两种模式,在正离子模式下效果最好[16],因此,黄曲霉毒素离子化模式为ESI+。黄曲霉毒素净化小柱包括两个类型:多功能净化柱与免疫亲和柱。其中,多功能净化柱采用复合材料,可以吸附蛋白质、色素等[16]。尽管这种方法的净化速度相对较快,但不能全面有效地消除干扰物质。因此,在实际实验中,多使用免疫亲和柱来净化样品。本研究利用液相色谱-质谱-质谱联用仪对花生油中黄曲霉毒素B1进行定量分析,并对实验条件进行了探讨。
1 材料与方法
1.1 仪器与试剂
液相色谱-质谱-质谱联用仪(3200QTRAP,美国AB Scies);色谱柱(phenomenex Kinetex 2.6 μm Biphenyl 100A,100 mm×3.0 mm);3K15台式高速冷冻离心机(德国Sigma公司);涡旋搅拌混匀器(英国Grant公司);AL204电子天平(瑞士梅特勒);IKA HS501振荡器(德国IKA仪器设备有限公司);N-EVAP-24氮吹仪(美国Organomation公司);微量可调移液枪(0.1~1.0 mL,德国Eppendorf公司)。
花生油,购于沃尔玛超市。黄曲霉毒素B1(100 μg·mL-1,天津阿尔塔科技有限公司);黄曲霉毒素B1内标液(0.5 μg·mL-1,天津阿尔塔科技有限公司);乙腈(色谱纯,德国 Merck 公司);黄曲霉毒素B1免疫亲和柱(普瑞邦公司);质控样[MRM-AO,质控值范围为(12.44±1.38)μg·kg-1,普瑞邦];甲酸(分析纯,阿拉丁公司)。
1.2 实验方法
1.2.1 标准使用液配制
准确移取1 mL浓度为100 μg·mL-1的标准储备液,用甲醇定容至10 mL,配制浓度为10 μg·mL-1的标准储备液,再准确移取1 mL浓度为 10 μg·mL-1的标准储备液用甲醇定容至10 mL,配制浓度为1 μg·mL-1的标准中间液,分别吸取1 μL、2 μL、4 μL、6 μL、8 μL、10 μL和20 μL标准中间液于1 mL进样瓶中,并同时加入40 μL浓度为0.05 μg·mL-1的黄曲霉毒素B1内标液,用初始流动相定容至1 mL配制系列标准工作液浓度为1.0 ng·mL-1、2.0 ng·mL-1、4.0 ng·mL-1、6.0 ng·mL-1、8.0 ng·mL-1、10.0 ng·mL-1和20.0 ng·mL-1。
1.2.2 样品前处理
准确称取5 g试样于50 mL离心管中,加入20 μL浓度为1 μg·mL-1的黄曲霉毒素B1标准品和200 μL浓度为0.05 μg·mL-1的黄曲霉毒素B1内标液,加入20 mL乙腈-水溶液(80+20),涡旋混匀,置于振荡器振荡20 min,离心,取上清液备用。准确移取4 mL上清液,加入46 mL 0.1%吐温-20 PBS溶液混匀,将待净化液转移至50 mL注射器筒内,以恒定流速流经已活化的免疫亲和柱,20 mL超纯水淋洗免疫亲和柱,真空泵抽干。2 mL甲醇洗脱黄曲霉毒素B1免疫亲和柱,真空泵抽干全部亲和柱,在水浴条件下将洗脱液浓缩至近干,初始流动相定容至1 mL,过0.22 μm滤膜,滤入样品瓶上机测定。
1.2.3 仪器条件
色谱条件:phenomenex Kinetex 2.6 μm Biphenyl-100A色谱柱(100 mm×3.0 mm,2.6 µm),进样量10.0 μL;流动相A为乙腈,B为0.1%甲酸水溶液;柱温35 ℃,梯度洗脱程序见表1。

表1 梯度洗脱程序
质谱条件:离子化模式ESI+,电子能量70 eV;离子源温度280 ℃;接口温度280 ℃;扫描方式多反应监测(Multiple Reaction Monitoring,MRM)。
2 结果与分析
2.1 仪器分析参数
将体积浓度为1 μg·mL-1的黄曲霉毒素B1和内标单标分别通过质谱仪所配的外置进样泵进样,分别寻找其母离子和子离子并优化碰撞电压和去簇电压。黄曲霉毒素B1及其内标在串联质谱上的检测参数见表2,黄曲霉毒素B1及其内标基质标准溶液的总离子流色谱图见图1。
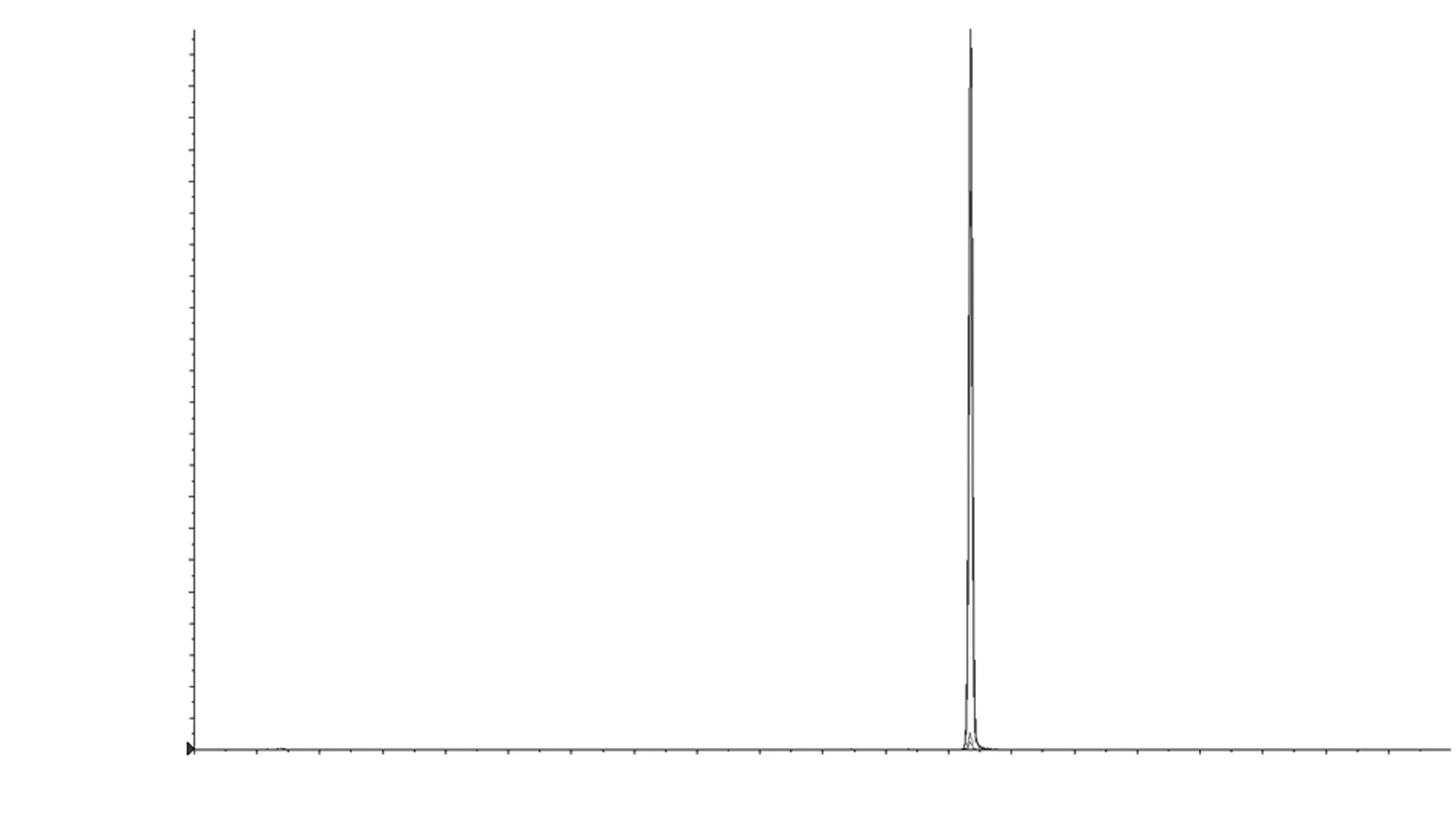
图1 黄曲霉毒素B1及其内标基质标准溶液的总离子流色谱图

表2 黄曲霉毒素B1及其内标的LC-MS/MS检测参数
2.2 方法线性范围和检出限
在1.2.3仪器条件下,根据1.2.1配制的系列标准工作液:1 ng·mL-1、2 ng·mL-1、4 ng·mL-1、6 ng·mL-1、8 ng·mL-1、10 ng·mL-1和20.0 ng·mL-1进样分析;工作曲线横坐标为目标物质量浓度C(ng·mL-1);工作曲线纵坐标为黄曲霉毒素B1峰面积与内标峰面积之比。图2为黄曲霉毒素B1标准曲线所拟合的线性方程。由图2可知该检测方法在1~20 ng·mL-1的质量浓度内线性关系良好,相关系数R2为0.999 3。
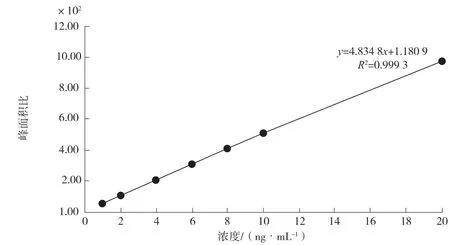
图2 黄曲霉毒素B1标准曲线
2.3 方法的准确度和精密度
在花生油空白基质中分别加入3个水平的黄曲霉毒素B1标准品,混匀1 min,使花生油空白基质与所加入的标准品充分接触后,加入200 μL浓度为0.05 μg·mL-1的黄曲霉毒素B1内标液,按1.2.2中的方法充分提取和净化后检测。每个进行6次平行实验,计算其平均回收率和相对标准偏差(Relative Standard Deviation,RSD),以考察方法的准确度和精确度,结果见表3。
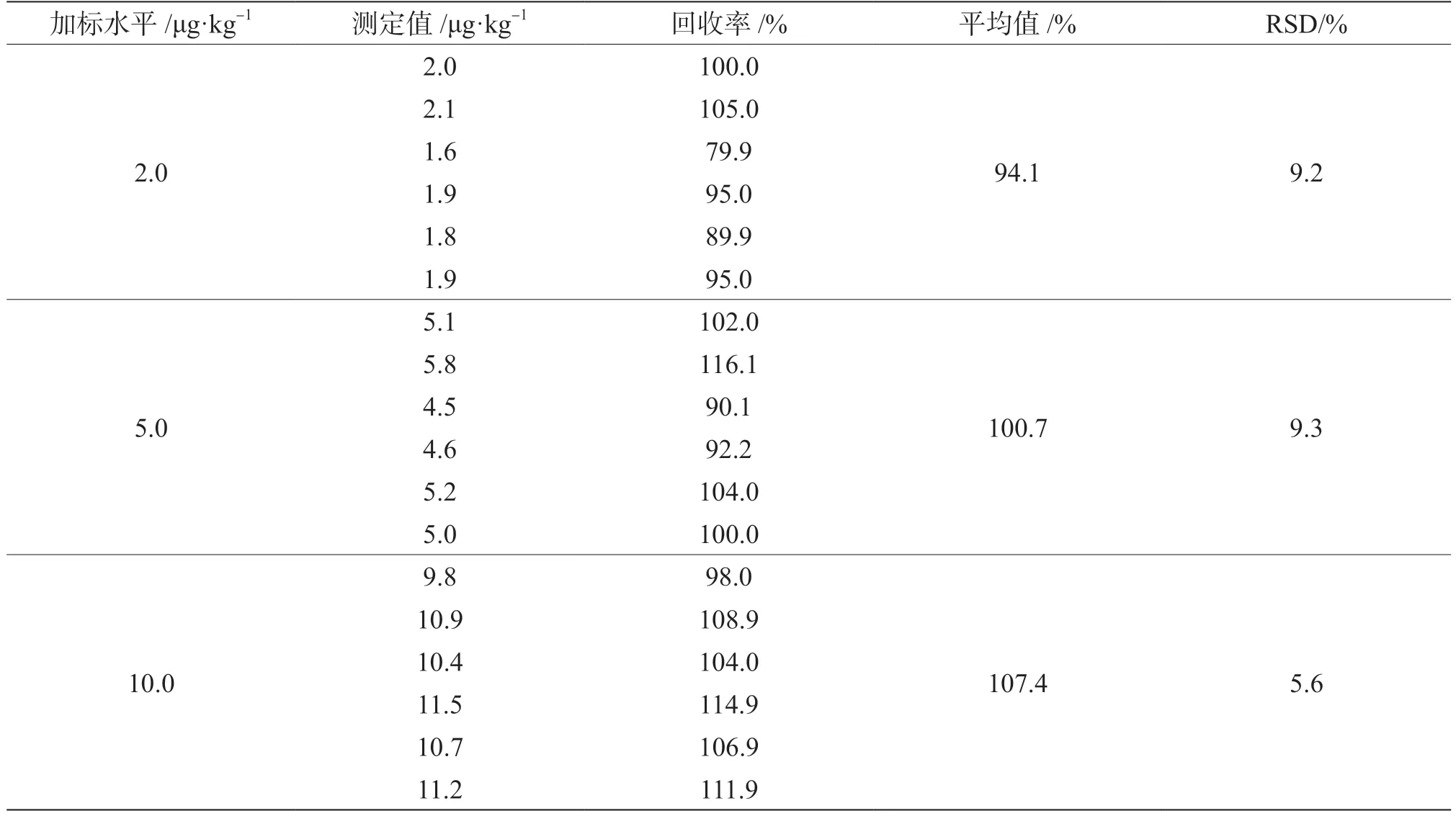
表3 花生油中黄曲霉毒素B1的加标回收率及其相对标准偏差(n=6)
由表3可知,在不同加标水平下,黄曲霉毒素B1的回收率在94.1%~107.4%,相对偏差(RSD)为5.6%~9.3%,回收率满足《实验室质量控制规范食品理化检测》(GB/T 27404—2008)食品理化检验中回收率要求即加标量小于0.1 mg·kg-1时回收率为60%~120%,相对标准偏差小于15%。表明该方法的回收率和精密度满足花生油中黄曲霉毒素B1残留检测的要求。
2.4 质控样测定
将所购质控样采用该方法进行测定,测定结果为13.12 μg·kg-1,质控样质控值为(12.44±1.38)μg·kg-1,测定值在质控值范围内,表明该方法对花生油中黄曲霉毒素B1阳性样品的测定具有较高的准确性,适用于实验室中花生油中黄曲霉毒素B1的准确定量分析。
3 结论
本研究建立了花生油中黄曲霉毒素B1的LCMS/MS测定方法,样品前处理采用免疫亲和柱技术,该方法无需进行衍生,简便快捷、灵敏度高,特异性强、准确度和精密度均满足定量分析的要求。在1~20 ng·mL-1线性内呈良好线性关系(R2为0.999 3),在2.0 μg·kg-1、5.0 μg·kg-1、10.0 μg·kg-1的加标水平下,回收率在94.1%~107.4%,相对标准偏差(n=6)为5.6%~9.3%,采用该方法测定花生油中黄曲霉毒素质控样,检测结果在质控样质控值范围内。因此,该方法可用于花生油中黄曲霉毒素B1的快速检测。

