重组腺相关病毒基因药物临床前评价方法的回顾与展望
李佳莘 黎玲 黄艺峰 刁勇
摘要:
重组腺相关病毒(rAAV)基因药物在临床应用过程中长期疗效不确定,甚至存在安全性风险,是制约其广泛应用的主要障碍.对现有rAAV基因药物临床前评价方法进行分析和梳理.结果表明:仅进行药效学评价不能揭示rAAV转导的细胞和分子机制,而基于转导过程分析的物理转导与功能转导评价存在结果不一致,不能反映rAAV转导的细胞异质性和靶细胞的空间分布特征等问题,难以准确预测rAAV基因药物的临床疗效和安全性,需要从单分子、单细胞水平开展rAAV载体胞内命运评价的新方法,以切实保障新型rAAV基因药物的临床有效性和安全性.
关键词: 基因治疗; 临床前评价; 胞内命运; 重组腺相关病毒
中图分类号: R 394文献标志码: A 文章编号: 1000-5013(2023)04-0421-06
Assessment and Prospects of Preclinical Evaluation Methods of Recombinant Adeno-Associated Virus Gene Medicine
LI Jiashen1, LI Ling1, HUANG Yifeng2, DIAO Yong1
(1. School of Medicine, Huaqiao University, Quanzhou 362021, China;
2. Haixia Hospital Affiliated to Huaqiao University, Quanzhou 362000, China)
Abstract: Long-term efficacy uncertainty and safety risks of recombinant adeno-associated virus (rAAV) gene medicine in clinical application are the main obstacles restricting their wide applications. The current preclinical evaluation methods for rAAV gene medicine are analyzed and carded. The results show that pharmacodynamic evaluation alone cannot reveal the cellular and molecular mechanisms of rAAV transduction, while physical and functional transduction evaluations based on transduction process analysis have inconsistent results and cannot reveal the cellular heterogeneity and spatial distribution characteristics of target cell of rAAV transduction, making it difficult to accurately predict the clinical efficacy and safety of rAAV gene medicine. It is necessary to construct a new method for evaluating intracellular fate of rAAV vectors at single-molecule and single-cell level to effectively ensure the clinical efficacy and safety of novel rAAV gene medicine.
Keywords: gene therapy; preclinical evaluation; intracellular fate; recombinant adeno-associated virus
基因藥物是在基因水平进行疾病的预防或治疗的药物.基因药物需要采用适当的基因递送载体,将靶基因导入特定细胞内,以纠正因基因缺陷和异常引起的疾病[1],理论上具有“一次治疗、终身治愈”的优势,已经成为生物医药领域研发的热点[2-3].自欧盟和美国食品药品管理局(FDA)相继批准6种以重组腺相关病毒(rAAV)为载体的基因药物以来,rAAV基因药物在饱受挫折后,终于进入高速发展的新时代[4].特别是用于治疗脊髓性肌萎缩症的Zolgensma,单次应用就可将患儿的2岁存活率从8%提高到100%[5],标志着rAAV基因药物的疗效实现了革命性突破.FDA预测,自2025年起,每年将有10~20项基因药物被批准上市,基因药物的全球市场规模将从2017年的10亿美元增长到2024年的440亿美元.在如此乐观的市场预期刺激下,辉瑞、诺华、强生等世界制药巨头纷纷布局基因治疗.我国也加强了rAAV基因药物的研发,迄今已有21项rAAV基因药物申请临床研究,3项进入三期临床.
然而,维持rAAV基因药物的长期疗效,避免毒副反应,仍然是困扰该领域研究人员的最大难题[6].对治疗先天性黑朦病的Luxturna的长期随访发现,患者视觉功能在治疗后1~3年达到峰值,之后有所下降,一些受试者甚至回到了治疗前状态[7].在欧洲获得附条件上市批准的A型血友病基因药物Roctavian迟迟没有得到FDA批准,很大的原因在于其长期临床疗效仍存在不确定性[8].虽然rAAV被公认为是最安全的基因治疗载体,但近年来接连发生的由rAAV基因药物引起的患者死亡事件[9-10],再次敲响了用药安全的警钟.临床研究表明,目前应用于基因治疗的所有rAAV载体均存在不同程度的安全性和有效性缺陷.而现有的rAAV载体临床前评价体系尚不能准确预估其临床有效性和安全性.因此,迫切需要创建一种新型临床前评价体系,以精准评估rAAV载体的临床表现.因此,本文对现有rAAV临床前评价体系的优缺点进行评价,并就未来评价体系的建立提出建议和展望.
1 rAAV基因药物的结构及转导过程
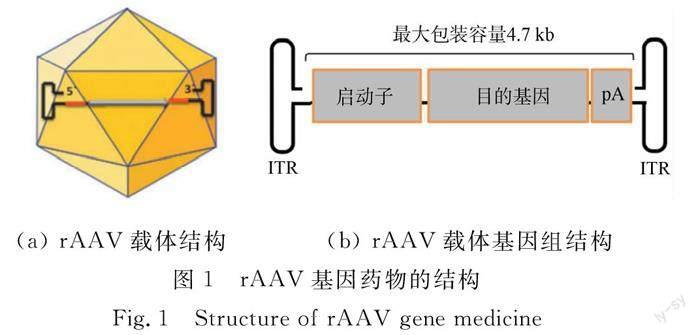
rAAV基因药物的结构(图1)非常简单,其外部为由60个腺相关病毒(AAV)衣壳蛋白形成的病毒衣壳,内部则是可表达目的基因的rAAV基因组.在rAAV基因组中,两端长度为145碱基的反向末端重复序列(ITR)是唯一来自野生AAV基因组的序列,其余部分都是与转基因表达相关的序列,如启动子和polyA(pA)尾,有时还含有基因表达调控序列等.
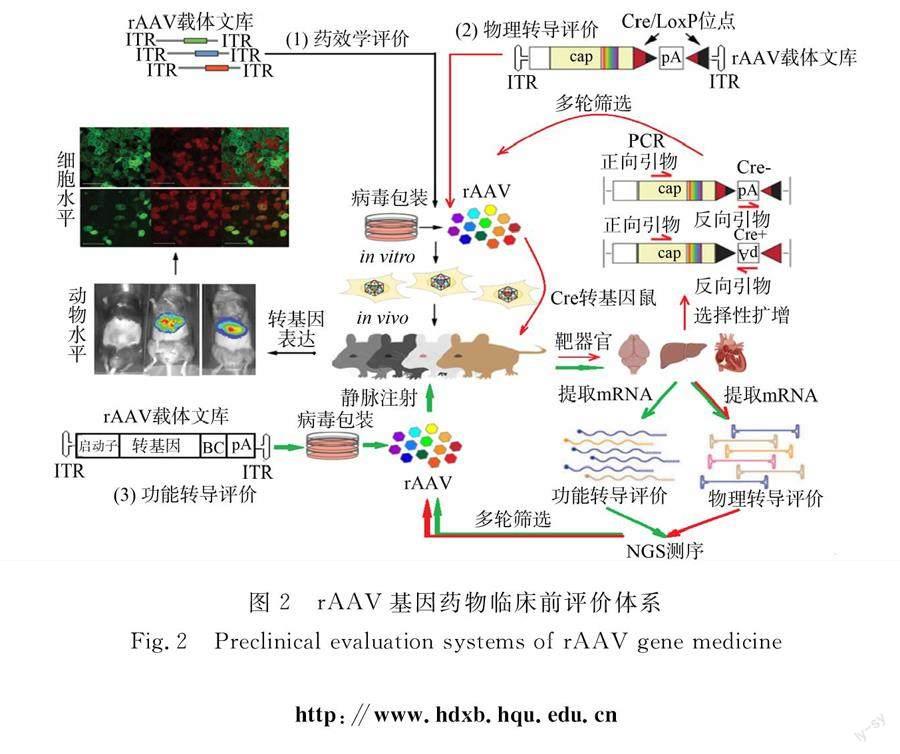
rAAV基因药物的结构元件,无论是衣壳还是基因组,都会影响其药效和毒性.在临床研究之前,一般是利用特定的细胞和动物模型,对候选载体进行临床前评价,即药效学评价.rAAV基因药物临床前评价体系,如图2所示.临床研究表明,在用药剂量相当的情况下,目前所有rAAV载体在人体内的转基因表达水平都远远低于临床前研究结果[11].然而,为增加疗效而提高用药剂量又会引起严重的免疫毒性反应[12].现有临床前评价体系尚不能准确评估rAAV载体的临床行为.
rAAV基因药物的药效依赖于载体的高效转导.rAAV载体的转导是一个多步骤共同参与的过程,除入胞外,还包括胞质转运、入核、DNA双链转化、转录、翻译等.Westhaus等[13]首先以“物理转导”的概念描述rAAV载体的入胞、胞质转运及入核等步骤,采用其携带的基因组DNA进行表征,而以“功能转导”描述其转录、翻译等过程,并采用其表达的mRNA和蛋白进行表征.
2 通过解析转导过程进行rAAV载体的临床前评价
rAAV载体转导的第一步是与靶细胞膜上特定受体结合后入胞.学界一直将rAAV载体的入胞作为限制其转导效率及细胞靶向的决定性因素,大量的研究集中在AAV衣壳结构的改造[6],以提高其转导效率或改变其转导的组织(细胞)专属性.
早在2007年,Wang等[14]就发现rAAV载体的入胞效率并不低,关键在于入胞后载体基因组的双链转化及双链DNA(dsDNA)的胞内稳定性.与野生型AAV一样,常规rAAV载体包装的基因组也是单链DNA(ssDNA),必须在细胞核内经历双链转化才具备转录活性.在细胞核内脱去AAV衣壳的游离ssDNA非常不稳定,必须迅速形成dsDNA.线性的dsDNA稳定性仍然较差,只可以作为转基因瞬时表达的模板.如果要持久表达转基因,还需要形成可抵御核酸酶降解的环状dsDNA结构.Lang等[15]研究发现,rAAV载体以很低的剂量静注给药后,就可以进入几乎所有小鼠肝脏细胞,传统的细胞和动物评价方法远远低估了rAAV载体的入胞效率.
2.1 基于物理转导的评价方法
基于物理转导的评价方法的指导思想如下:高效的物理转导是rAAV载体实现转基因表达的前提,在多种载体共同参与的竞争条件下,对特定细胞物理转导效率最高的为最佳靶向载体.Cre是一种位点特异性的DNA重组酶,能特异识别基因组中的LoxP位点,介导LoxP位点间的序列重组或删除.基于Cre重组的AAV靶向进化(CREATE)平台就是基于Cre-LoxP重组技术的rAAV载体评价体系[16](图2),采用Cre转基因小鼠直接进行体内评价.Cre仅在该模型动物的特定类型细胞中表达,可精准体内定位靶细胞.当基因组中含有Cre/LoxP位点的rAAV载体物理转导Cre阳性的细胞后,其相应基因组序列发生反转重组,通过聚合酶链式反应(PCR),就可以检出靶向转导特定细胞的rAAV载体.Hillestad等[17]采用CREATE平台对常用的rAAV1,rAAV8和rAAV9载体的体内转导行为进行评价,证实rAAV8和rAAV9载体的肝靶向转导能力优于rAAV1,与基于细胞和动物模型的评价体系结果一致.同时发现,随着给药剂量增加,rAAV8和rAAV9载体的脱靶转导现象越来越明显,说明CREATE平台的细胞分辨率显著提高,更适合细胞水平的筛选和评价.采用CREATE平台对基于rAAV9改造的候选载体进行评价,发现AAV-PHP.B载体转导中枢神经细胞的效率比原rAAV9提高了40倍,且主要局限于星状胶质细胞和神经元[16].在AAV-PHP.B基础上继续进行改造和筛选,又发现了靶向转导皮层神经元和纹状体神经元的AAV-PHP.eB载体,以及靶向转导外周背根神经节神经元的AAV-PHP.S载体[18],为今后中枢神经系统的精准基因治疗提供了优化载体.
2.2 基于功能转导的评价方法
物理转导效率高只能说明该载体基因组可以顺利完成胞质转运和入核等过程,不能说明转基因表达效率的高低.研究表明,蛋白酶体抑制剂可以有效促进rAAV载体的胞质转运[19],在蛋白酶体抑制剂的作用下,胞内rAAV2载体DNA的数量增加了4~7倍,但转基因表达效率却提高了36~105倍[20],说明物理转导与功能转导的效率差距甚大,物理转导不能准确反映转录与翻译等关键步骤的行为.也有研究发现,有些rAAV载体虽然物理转导效率类似,但转基因表达效率却迥异,甚至出现物理转导效率高但转基因表达水平低的现象[21],提示根据功能转导的评价体系可更为客观地表征其转导行为.
Tabebordbar等[22]设计的利用转基因 RNA 体内表达的 AAV 衣壳定向进化(DELIVER)策略,采用功能转导进行rAAV载体的评价(图2).在候选rAAV载体基因组中插入条码序列(BC)以便后期身份辨识,动物用药后,测定相关组织或细胞中各载体对应的mRNA的水平,就可以了解相应载体的功能转导效率,与流式分析技术结合,还可以分析载体的细胞靶向轉导特性.利用该策略筛选得到的MyoAAV载体,不仅对骨骼肌和心脏组织具有靶向转导特性,而且显著降低了对肝脏的转导能力.研究还发现,采用从人巨细胞病毒中发现的通用启动子CMV启动子时,rAAV载体的物理转导与功能转导之间并不存在线性相关性[22],进一步强调了仅基于物理转导进行载体评价的缺陷.
对rAAV载体的免疫毒性研究发现,除衣壳蛋白外,其基因组DNA构成也可以诱导宿主细胞天然免疫反应[23].血友病基因治疗临床研究已经证实,rAAV基因组中的CpG基序与免疫毒性存在相关性[24].因此,在保证功能转导效率的前提下,尽量降低物理转导与转导效率的比率应当作为rAAV载体的优化条件之一.
2.3 物理和功能转导相结合的评价体系
近期研究发现,不同组织/细胞中表达的tRNA种类和水平也存在显著差异,意味着同一DNA模板在不同组织/细胞中存在转录效率的差异,基因组DNA与所表達的mRNA之间未必存在相关性[22].这一发现引起研究人员对rAAV载体评价策略的反思,无论是物理转导还是功能转导,都难以单独作为最佳载体的判断依据[25].
在rAAV载体的转导过程中,物理转导和功能转导既相互区分,又前后连贯.基因组DNA对免疫毒性的诱导作用,提醒着不能忽视其物理转导效率的评价[26].为了全面评估rAAV载体的转导效率与毒性风险,Westhaus等[13]提出同时评价物理转导和功能转导的新方法(图2).Cabanes-Creus等[27]采用该方法,利用人肝嵌合小鼠,从rAAV候选文库中成功优选出对人肝细胞具有靶向转导作用的新型载体AAV-SYD,并揭示了其衣壳蛋白序列对物理转导和功能转导性能的贡献.
通过物理转导与功能转导的综合评价,可从细胞水平揭示rAAV载体的胞内命运,有助于筛选转基因表达效率高且毒副反应风险小的载体.但该方法难以揭示靶细胞在体内的空间分布信息及rAAV转导过程的细胞异质性现象.
3 单细胞、单分子水平评价rAAV的转导特性
3.1 单分子水平考察rAAV载体的胞内转化
因rAAV载体发生染色体整合的概率很低,学界普遍认为,rAAV载体介导的转基因长期表达依赖于以附加体(episome)形式存在的环状dsDNA.基因组以dsDNA存在的自身互补型rAAV载体,在细胞内无需第二链合成即可表达转基因,但其要实现长期表达,也需要环状dsDNA的形成.因此,在单分子水平考察rAAV载体的胞内转化过程,并揭示制约二链合成、DNA环化的载体或细胞因素,是对现有载体进行优化改造的可行思路.基于扩增的单分子荧光原位杂交技术[28]为在单分子水平研究rAAV载体DNA的胞内转化提供了可能.
3.2 单细胞水平考察rAAV载体的空间转导特性
体内器官均具有鲜明的细胞空间异质性特征,如肝脏内肝细胞、肝窦内皮细胞(LSEC)等各类细胞的空间分布直接影响其功能[29].LSEC和肝细胞分别是第八、九因子的天然生产细胞,这两种因子表达异常会分别引起甲型或乙型血友病.动物实验发现,在肝细胞中异位表达第八因子虽然可以缓解甲型血友病症状,但也会诱导免疫应激[30].以LSEC为靶细胞开展的基因治疗动物研究,既可以实现第八因子的长期表达,又可避免免疫反应的发生[31].因此,采用空间原位单细胞测序技术[32],在细胞水平精准评价rAAV载体的体内空间转导特性,对于提高其细胞靶向转导、克服其免疫毒性具有重要意义.
4 结论
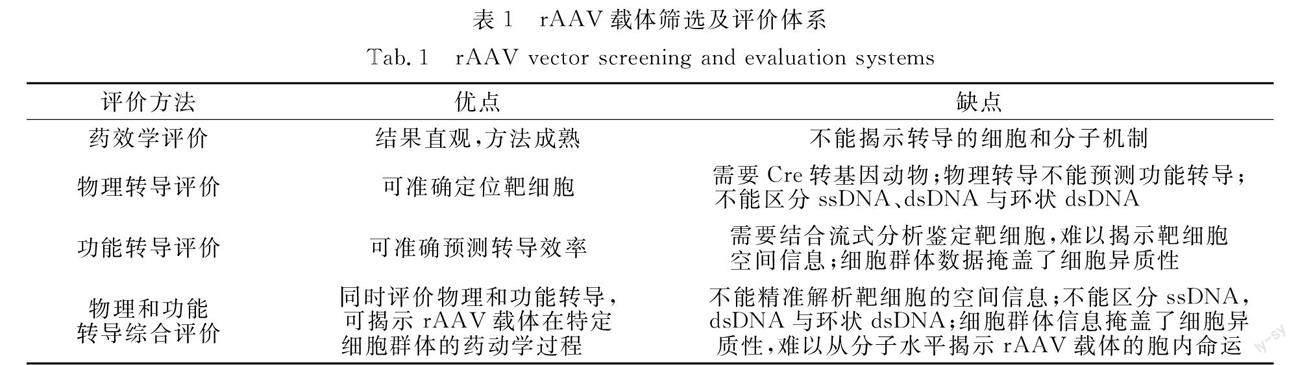
目前,已批准上市的6种rAAV基因药物使用的载体均来自天然AAV血清型,具体为AAV1,AAV2,AAV5和AAV9,其选择依据均基于传统的药效学评价.rAAV载体筛选及评价体系,如表1所示.因AAV本质上是病毒而非理想的基因递送载体,在治疗基因的靶向递送及安全性方面存在天生缺陷,因而需要从其转导的细胞和分子机制入手进行筛选和评价.通过物理转导和功能转导性能的评价,可以准确预测rAAV的靶细胞及转基因表达效率,将两种性能综合评估,还有利于进一步提升所筛选载体的有效性,降低安全性风险(表1).从单分子单细胞水平对rAAV的胞内命运进行解析,将克服现有技术存在难以揭示其体内转导细胞及空间异质性难题,为新一代rAAV载体的开发提供评价手段.
临床前评价是rAAV基因药物研发的关键步骤.既然rAAV被公认为是最安全有效且能够长期保持转基因表达的病毒载体[2-3],进入临床应用的理想rAAV载体,就应当具备在恰当的细胞以恰当的水平长期表达转基因的能力,具体应具备的特性如下:1) 时间特性,持续表达转基因,“一次治疗、终身治愈”;2) 空间特性,在恰当的靶细胞内表达转基因,既可以有效发挥活性,又没有安全隐患;3) 模式特性,rAAV载体的免疫毒性具有剂量依赖性特征,在保证功能转导的前提下尽量降低物理转导,是保持转基因表达水平适中,又不会诱导细胞应激及免疫反应的最佳模式.综合应用分子生物学、病毒学、药学等学科的最新技术,构建精准可靠的临床前评价体系,将为rAAV基因药物更有效、更安全、更广泛的临床应用奠定坚实的基础.
参考文献:
[1] HIGH K A,RONCAROLO M G.Gene therapy[J].The New England Journal of Medicine,2019,381(5):455-464.DOI:10.1056/NEJMra1706910.
[2] 王晓,黄晓平,黎玲,等.氧化应激促进重组腺相关病毒2型体外转导分析[J].华侨大学学报(自然科学版),2022,43(4):489-497.DOI:10.11830/ISSN.1000-5013.202201036.
[3] 王晓,黄晓平,黎玲,等.重组腺相关病毒基因药物三种滴度的比较与分析[J].华侨大学学报(自然科学版),2021,42(4):507-511.DOI:10.11830/ISSN.1000-5013.202010006.
[4] DUNBAR C E,HIGH K A,JOUNG J K,et al.Gene therapy comes of age[J].Science,2018,359(6372):eaan4672.DOI:10.1126/science.aan4672.
[5] MENDELL J R,AL-ZAIDY S,SHELL R,et al.Single-dose gene-replacement therapy for spinal muscular[J].The New England Journal of Medicine,2017,377(18):1713-1722.DOI:10.1056/NEJMoa1706198.
[6] LI Chengwen,SAMULSKI R J.Engineering adeno-associated virus vectors for gene therapy[J].Nature Reviews Genetics,2020,21(4):255-272.DOI:10.1002/0470025077.chap69.
[7] JACOBSON S G,CIDECIYAN A V,ROMAN A J,et al.Improvement and decline in vision with gene therapy in childhood blindness[J].The New England Journal of Medicine,2015,372(20):1920-1926.DOI:10.1056/NEJMoa1412965.
[8] VANDENDRIESSCHE T,PIPE S W,PIERCE G F,et al.First conditional marketing authorization approval in the European Union for hemophilia “A” gene therapy[J].Molecular Therapy: The Journal of the American Society of Gene Therapy,2022,30(11):3335-3336.DOI:10.1016/j.ymthe.2022.09.020.
[9] PHILIPPIDIS A.Novartis confirms deaths of two patients treated with gene therapy zolgensma[J].Human Gene Therapy,2022,33(17/18):842-844.DOI:10.1089/hum.2022.29216.bfs.
[10] PHILIPPIDIS A.Fourth boy dies in clinical trial of Astellas′ AT132[J].Human Gene Therapy,2021,32(19/20):1008-1010.DOI:10.1089/hum.2021.29182.bfs.
[11] BATTY P,LILLICRAP D.Hemophilia gene therapy: Approaching the first licensed product[J].Hemasphere,2021,5(3):e540.DOI:10.1097/HS9.0000000000000540.
[12] PIERCE G F.Uncertainty in an era of transformative therapy for haemophilia: Addressing the unknowns[J].Haemophilia,2021,27(S3):103-113.DOI:10.1111/hae.14023.
[13] WESTHAUS A,CABANES-CREUS M,RYBICKI A,et al.High-throughput in vitro, ex vivo, and in vivo screen of adeno-associated virus vectors based on physical and functional transduction[J].Human Gene Therapy,2020,31(9/10):575-589.DOI:10.1089/hum.2019.264.
[14] WANG Jinhui,XIE Jing,LU Hui,et al.Existence of transient functional double-stranded DNA intermediates during recombinant AAV transduction[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(32):13104-13109.DOI:10.1073/pnas.0702778104.
[15] LANG J F,TOULMIN S A,BRIDA K L,et al.Standard screening methods underreport AAV-mediated transduction and gene editing[J].Nature Communications,2019,10(1):3415.DOI:10.1038/s41467-019-11321-7.
[16] DEVERMAN B E,PRAVDO P L,SIMPSON B P,et al.Cre-dependent selection yields AAV variants for widespread gene transfer to the adult brain[J].Nature Biotechnology,2016,34(2):204-209.DOI:10.1038/nbt.3440.
[17] HILLESTAD M L,GUENZEL A J,NATH K A,et al.A vector-host system to fingerprint virus tropism[J].Human Gene Therapy,2012,23(10):1116-1126.DOI:10.1089/hum.2011.116.
[18] CHAN K Y,JANG M J,YOO B B,et al.Engineered AAVs for efficient noninvasive gene delivery to the central and peripheral nervous systems[J].Nature Neuroscience,2017,20(8):1172-1179.DOI:10.1038/nn.4593.
[19] 王启钊,吕颖慧,刁勇,等.重组腺相关病毒载体的泛素化机制及其应用[J].浙江大学学报(医学版),2012,41(5):586-591.DOI:10.3785/j.issn.1008-9292.2012.05.020.
[20] DOUAR A,POULARD K,STOCKHOLM D,et al.Intracellular trafficking of adeno-associated virus vectors: Routing to the late endosomal compartment and proteasome degradation[J].Journal of Virology,2001,75(4):1824-1833.DOI:10.1128/JVI.75.4.1824-1833.2001.
[21] LISOWSKI L,DANE A P,CHU K,et al.Selection and evaluation of clinically relevant AAV variants in a xenograft liver model[J].Nature,2014,506(7488):382-386.DOI:10.1038/nature12875.
[22] TABEBORDBAR M,LAGERBORG K A,STANTON A,et al.Directed evolution of a family of AAV capsid variants enabling potent muscle-directed gene delivery across species[J].Cell,2021,184(19):4919-4938.DOI:10.1016/j.cell.2021.08.028.
[23] 刁勇,许瑞安.重组腺相关病毒载体诱导的天然免疫反应及机制[J].微生物学报,2012,52(5):550-557.
[24] KONKLE B A,WALSH C E,ESCOBAR M A,et al.BAX 335 hemophilia B gene therapy clinical trial results: Potential impact of CpG sequences on gene expression[J].Blood,2021,137(6):763-774.DOI:10.1182/blood.2019004625.
[25] BROWN H C,ZAKAS P M,GEORGE S N,et al.Target-cell-directed bioengineering approaches for gene therapy of hemophilia A[J].Molecular Therapy: Methods and Clinical Development,2018,9:57-69.DOI:10.1016/j.omtm.2018.01.004.
[26] 刁勇,王启钊,肖卫东,等.重组腺相关病毒基因药物的细胞免疫毒性及对策[J].药学学报,2010,45(9):1071-1077.
[27] CABANES-CREUS M,NAVARRO R G,ZHU Erhua,et al.Novel human liver-tropic AAV variants definetransferable domains that markedly enhance the human tropism of AAV7 and AAV8[J].Molecular Therapy: Methods and Clinical Development,2022,24:88-101.DOI:10.1016/j.omtm.2021.11.011.
[28] LIN Chen,JIANG Meng,LIU Ling,et al.Imaging of individual transcripts by amplification-based single-molecule fluorescence in situ hybridization[J].New Biotechnology,2021,61:116-123.DOI:10.1016/j.nbt.2020.12.001.
[29] AIZARANI N,SAVIANO A,SAGAR,et al.A human liver cell atlas reveals heterogeneity and epithelial progenitors[J].Nature,2019,572(7768):199-204.DOI:10.1038/s41586-019-1373-2.
[30] ZOLOTUKHIN I,MARKUSIC D M,PALASCHAK B,et al.Potential for cellular stress response to hepatic factor Ⅷ expression from AAV vector[J].Molecular Therapy: Methods and Clinical Development,2016,3:16063.DOI:10.1038/mtm.2016.63.
[31] MERLIN S,FAM R,BORRONI E,et al.FⅧ expression by its native promoter sustains long-term correction avoiding immune response in hemophilic mice[J].Blood Advances,2019,3(5):825-838.DOI:10.1182/bloodadvances.2018027979.
[32] YU Yuan,ZENG Zhiwei,XIE Danlin,et al.Interneuron origin and molecular diversity in the human fetal brain[J].Nature Neuroscience,2021,24(12):1745-1756.DOI:10.1038/s41593-021-00940-3.
(責任编辑: 黄晓楠 英文审校: 刘源岗)
收稿日期: 2023-05-29
通信作者: 刁勇(1967-),男,教授,博士,博士生导师,主要从事基因药物的研究.E-mail:diaoyong@hqu.edu.cn.
基金项目: 国家自然科学基金资助项目(81371669, 81271691, 30973591); 福建省泉州市科技计划项目(2022C 006R)
http:∥www.hdxb.hqu.edu.cn

