木薯糖转运蛋白MeSWEET18的克隆与功能分析
薛晶晶 安飞飞 朱文丽 罗秀芹

关键词:木薯;糖转运蛋白;功能分析;糖转运能力;非生物胁迫
中图分类号:S533 文献标识码:A
蔗糖是大多数植物光合作用的主要碳水化合物,从叶片向各库器官长距离运输,促使根、花、果实和种子生长发育[1]。叶绿体通过光合作用合成蔗糖,蔗糖通过胞间连丝进入韧皮部薄壁细胞组织,由SWEET(sugar will eventually be exportedtransporter) 蛋白卸载至质外体, 再通过SUT(sucrose transporter)蛋白转运至伴胞细胞和筛管分子,然后由定位于筛分子细胞-伴胞复合体上的H+共转运蛋白通过质子动力势将同化物送进韧皮部进入长距离运输。
SWEET 蛋白属于MtN3/saliva 基因家族,也称为MtN3/saliva/SWEET,可以转运己糖和蔗糖,并介导糖外流到质外体,是糖转运蛋白中的一员,含有2 个MtN3/saliva 跨膜螺旋结构域。已测序的植物基因组中均有发现SWEET 家族成员。绿色荧光蛋白融合研究发现,大部分植物SWEETs 家族基因位于细胞质膜上[2-3]。根据SWEETs 蛋白转运糖的类型不同,所有SWEETs 蛋白都可以分成4 个分支,第一分支和第二分支SWEET 蛋白主要选择转运己糖,尤其是葡萄糖;第三分支SWEET蛋白优先跨膜转运蔗糖;第四分支的SWEET 蛋白主要介导果糖的转运[4]。同SUT 一样,SWEET可以自身互作形成同聚物,也能相互之间形成异聚体,进而形成更大的通道提高转运效率[5]。SWEETs 家族基因在植物运输糖类、生殖和发育、植物逆境、与病原体互作等方面发挥着重要作用[6]。
木薯(Manihot esculenta Crantz)是热带亚热带地区重要的粮食作物[7]。木薯SWEET 家族共有28 个同源基因,COHN 等[8]发现地毯黄单胞菌的毒力可以通过转录激活因子TAL20Xam668 特异性诱导木薯MeSWEET10a 的表达,并最终导致木薯细菌性枯萎病的蔓延。胡梅珍[9]、薛蓓蓓等[10]对木薯SWEET 家族基因进行生物信息学分析,明确其对己糖的转运能力以及不同木薯种质的表达情况。刘秦等[11]克隆了木薯MeSWEET1 基因,并将其定位于细胞膜上,组织特异性分析发现,成熟叶片中相对表达量最高。朱柏光等[12]分析木薯MeSWEET3b 的糖转运能力,发现其转运半乳糖,且受木薯黄单胞菌(Xam)的诱导。未发现木薯其他SWEET 蛋白的功能研究。木薯MeSWEET18 在不同组织器官中均具有较高的表达水平[13],可能在木薯的生长发育及逆境胁迫中起着重要作用。因此,本研究以木薯MeSWEET18(Manes. 15G011300)为研究对象,通过克隆、体外验证以及非生物胁迫等方法,研究该基因在木薯中的功能,为木薯SWEET 基因家族相关成员的功能研究提供理论依据。
1 材料与方法
1.1 材料
采用生长于中国热带农业科学院热带作物品种资源研究所国家木薯种质资源圃华南9 号(SC9)品种作为研究材料。
1.2 方法
1.2.1 总RNA 提取与cDNA合成 总RNA提取参照RNAprep Pure 多糖多酚植物总RNA 提取试剂盒(Tiangen)的操作说明进行,用Dnase I 柱上消化RNA 样品中残留的微量DNA。用1 μgRNA 逆转录合成第一链cDNA。cDNA 第一链合成参照RevertAid RT 逆转录试剂盒(Thermo)的操作说明进行。
1.2.2 MeSWEET18 基因全长cDNA 扩增 以Phytozome12.0 中Manihot esculenta v7.1(cassava)數据库的MeSWEET18 序列设计引物(5'-TTGAAGAAGTTGTTCATTTC-3'和5'-TCAACTCCCTGGCCCTTACT-3'),采用PrimeSTAR Max DNA Polymerase进行cDNA 序列的克隆。全长cDNA 的扩增体系含PrimeSTAR Max Premix(2×)25 μL、MeSWEET18-F(10 μmol/L)2.5 μL、MeSWEET18-R(10 μmol/L)2.5 μL、cDNA 模板0.5 μL、无菌水补足至50 μL。扩增程序为:95 ℃预变性5 min;95 ℃ 30 s、56 ℃ 30 s、72 ℃ 1 min,共34 个循环;72 ℃延伸10 min。0.8%的琼脂糖凝胶电泳分离PCR 扩增产物,回收纯化目的条带,克隆至pEASY-Blunt Simple Cloning Vector 载体(TransGen)上测序。
1.2.3 生物信息学分析 利用NCBI 网站ORFFinder 软件对获得的SC9 cDNA 序列进行开放阅读框(ORF)预测,同时翻译成蛋白序列。利用ProtParam(https://web.expasy.org/protparam/)软件分析该蛋白的分子量与等电点;采用NCBI 在线软件CDD 分析蛋白的保守结构域; 采用TMHMM Server v.2.0 ( http://www.cbs.dtu.dk/services/TMHMM)在线软件进行跨膜结构域分析;运用PSORT 在线软件对该蛋白进行亚细胞定位预测;运用ProtScale(https://web.expasy.org/protscale/)在线软件预测该氨基酸序列的疏水性/亲水性;利用SOPMA SECONDARYSTRUCTUREPREDICTIONMETHOD(https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopm.pl)在线软件预测蛋白的二级结构。从NCBI 和Phytozome12.0 数据库下载木薯和拟南芥SWEET 蛋白家族基因,利用MEGA6 软件,选择neighbour-joining(NJ)模型,并进行1000 次bootstrap 统计学检验,构建包括MeSWEET18 蛋白序列在内的木薯和拟南芥SWEET蛋白的系统进化树。
1.2.4 不同生育期的实时荧光定量PCR 分析分别取SC9 形成期(植后4 个月)、膨大期(植后7 个月)及成熟期(植后10 个月)叶片、叶柄、茎杆和块根作为研究材料。每个材料每个生育期随机选取3 株,混合保存于–80 ℃冰箱中,3 次重复。利用RNAprep Pure 多糖多酚植物总RNA 提取试剂盒(Tiangen)提取RNA。然后取1 μg RNA,逆转录合成第一链cDNA,稀释10 倍后作为实时荧光定量PCR 分析的模板。
采用Thermo 公司的CFX 实时荧光定量PCR系统,实验操作按仪器使用说明书进行。10 μL反应体系中,包含1 μL 模板、5 μL 2×SYBRPremix、10 μmol/L qPCR-MeSWEET18-F 和qPCRMeSWEET18-R 引物(5'-GGAGTTTGAGAGTCTTCCTTATGTG-3'和5'-GAGTTACATAGACGATTTCCACCAG-3')各0.4 μL、无菌水补足至10 μL。PCR 反应程序为:95 ℃预变性30 s,95 ℃ 10 s、60 ℃ 20 s,共40 个循环,循环完成后进行产物溶解曲线分析。以MeActin 作为内参基因(5'-TGATGAGTCTGGTCCATCCA-3'和5'-CCTCCTACGACCCAATCTCA-3'),以2-△△CT 算法进行基因的相对定量表达。采用Dunnetts 法对同一部位不同发育期的相对表达结果进行统计分析。
1.2.5 MeSWEET18 的糖转运特性分析EBY.VW4000 酵母是一种己糖转运功能缺陷型酵母突变体,此菌株无法在己糖为唯一碳源的尿嘧啶(ura)缺陷型选择培养基SD-ura 平板上生长,可以在麦芽糖为唯一碳源的选择培养基SD-ura平板上恢复生长[14]。运用包含pDR196 表达载体序列的引物( 5-ATATACCCCAGCCTCGATGGAAATCTTGAGTTTG-3 和5-CGATAAGCTTGATATCTTATTCCGATGA-TGGAGAT-3 ) 扩增MeSWEET18 的CDS 序列,采用DNA 无缝克隆技术将MeSWEET18 的CDS 序列与酵母表达载体pDR196 进行重组,获得MeSWEET18-pDR196 表达载体,使用聚乙二醇/醋酸锂高效酵母转化法将重组后的MeSWEET18-pDR196 质粒转化到EBY.VW4000 酵母菌中。利用含有2%麦芽糖的SD-ura 培养基过夜培养至OD600 约1.0,然后连续稀释至OD600 分别约0.1、0.01、0.001,分别涂布于含有2%麦芽糖、2%葡萄糖、2%果糖等不同糖源的缺陷型选择培养基SD-ura 平板上,30 ℃,倒置培养3~5 d,观察生长情况。
1.2.6 MeSWEET18 在不同糖处理下的表达分析将生长20 d 左右的SC9 水培苗,于黑暗条件下进行不同糖源的暗处理。以未进行处理的SC9 水培苗作为对照,分别添加水、2%蔗糖、2%葡萄糖、2%果糖的溶液中分别培养2 d 和5 d,每个时间点不同处理随机选取3 株,混合保存于–80 ℃冰箱中,3 次重复,进行实时荧光定量PCR 分析。
1.2.7 MeSWEET18 在SC9 非生物胁迫下的表达分析 将SC9 茎杆水培20 d 后,分别进行盐胁迫(8 g/L NaCl)、干旱胁迫(100 mmol/L 甘露醇)、氧化脅迫(10% H2O2)处理,各处理时间分别为0(CK)、12、24、36 h。低温处理采用15 ℃ 24h,后降至4 ℃ 24 h。分别取叶片、叶柄、茎杆和根4 个部位的样品,保存于–80 ℃冰箱中,3次重复,进行实时荧光定量PCR 分析。
1.3 数据处理
采用GraphPad Prifm 5.0 软件进行数据分析、作图以及Dunnetts 检验(P<0.05)。
2 结果与分析
2.1 MeSWEET18 基因全长CDS克隆及蛋白质结构特性分析
通过RT-PCR 扩增及测序,获得MeSWEET18基因编码框序列714 bp,编码237 个氨基酸(图1),蛋白分子质量为25.94 kDa,理论等电点为6.57,不稳定系数为37.50,属于稳定类蛋白。通过NCBI 在线软件CDD 分析发现,该蛋白含有2个保守结构域,在N 端含有植物SWEET 家族基因共有的保守结构域MtN3_slv,C 端含有PQ-loopsuper family 保守结构域。TMHMM Server v.2.0在线软件预测显示,该蛋白含有7 个跨膜结构域,是典型的膜蛋白;PSORT 分析显示,MeSWEET18定位于液泡的可能性为85.71%;ProtScale 预测表明,MeSWEET18 蛋白属于亲水性蛋白;SOPMA分析显示,MeSWEET18 蛋白二级结构由44.30%α-螺旋、20.68%延伸链、3.38% β-转角和31.65%无规则卷曲组成。
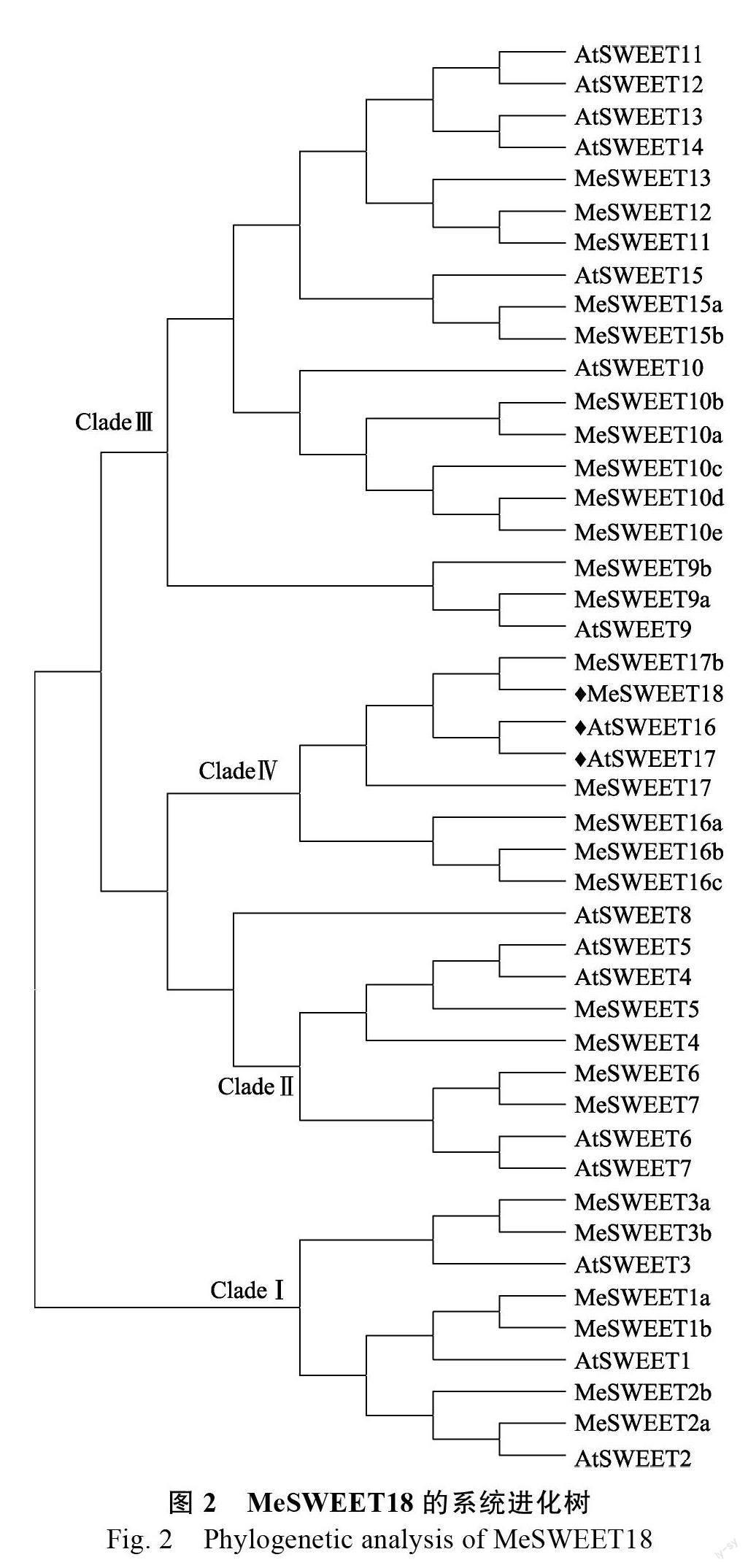
2.2 MeSWEET18 的系统进化树分析
已发表的拟南芥和葡萄树SWEET 蛋白进化树分析结果显示,SWEET 蛋白可以划分为4 个亚类[4, 15]。对木薯和拟南芥的SWEET 蛋白进行系统进化树分析,发现木薯MeSWEET18 与拟南芥的AtSWEET16 和AtSWEET17 位于同一进化枝上,属于CladeⅣ,该亚类共含有6 个木薯SWEET基因(图2)。采用DNAMAN软件对MeSWEET18、AtSWEET16 和AtSWEET17 氨基酸序列进行比对,结果显示:MeSWEET18 和AtSWEET16 的同源性达到53.23%,MeSWEET18 和AtSWEET17的同源性达到56.05%,含有2 个明显的PQ-loopsuperfamily 保守结构域。
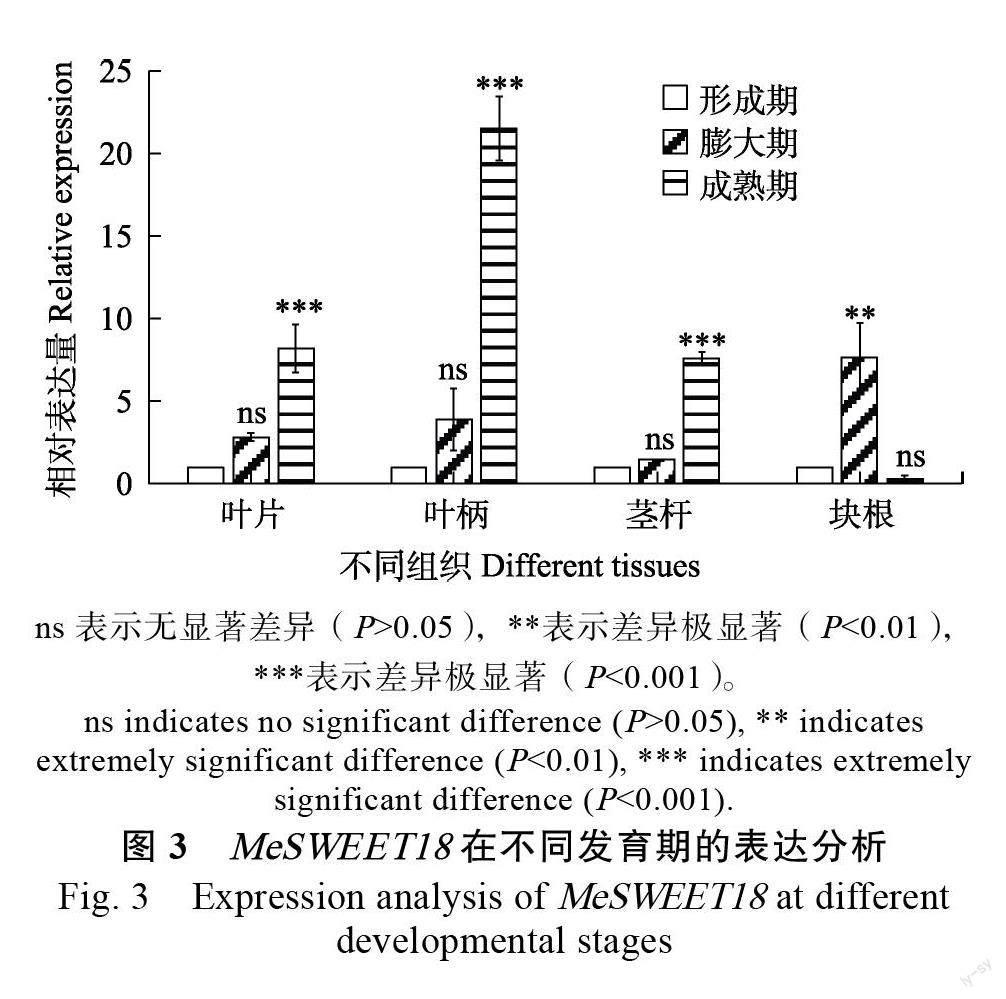
2.3 不同生育期MeSWEET18 的表达分析
分析MeSWEET18 在SC9 形成期、膨大期及成熟期叶片、叶柄、茎杆和块根的表达情况。结果显示:MeSWEET18 在叶片中的表达随着木薯的生长表现为先上升后下降;在叶柄中的表达随着木薯的生长持续上升,在成熟期达到最大;形成期和膨大期的茎杆表达无差异,成熟期呈上升趋势;MeSWEET18 在块根膨大期表达量最高,随着木薯生长,表达量低于木薯形成期(图3)。
2.4 MeSWEET18 的糖转运特性分析
为了验证MeSWEET18 的糖转运特性,将其转化至己糖转运缺陷型酵母EBY.VW4000 中,该酵母无法在己糖为唯一碳源的尿嘧啶缺陷型SD-ura 选择培养基上生长,但是可以在麦芽糖为唯一碳源的培养基上恢复生长(图4)。结果表明,MeSWEET18 可以转运果糖,但不能转运葡萄糖,脱氧-2-葡萄糖的添加对MeSWEET18 无影响。
2.5 MeSWEET18 在不同糖处理下的表达分析
以未进行黑暗处理的SC9 水培苗作为对照,黑暗下分别添加水、2%蔗糖、2%葡萄糖和2%果糖的溶液进行处理2 d 和5 d。黑暗条件下,MeSWEET18 在不同糖处理下的表达水平显示,黑暗处理2 d 时,水、2%蔗糖、2%葡萄糖和2%果糖处理对MeSWEET18 的表达均有影响;随着黑暗处理时间延长到5 d,MeSWEET18 的表达在不同糖处理下表达呈极显著下降趋势(图5)。
2.6 MeSWEET18 在非生物胁迫下的表达分析
将SC9 进行水培培养20 d 后,进行盐、干旱、氧化以及低温胁迫,各胁迫处理时间为0、12、24、36 h。采集每个时间点的叶片、叶柄、茎杆和根进行表达分析(图6)。结果发现,叶片在盐胁迫12 h 时表达水平提高了2.07 倍,随着时间延长至24 h,表达水平较0 h 急速下降至0.05 倍;与0 h 相比,茎杆和根的表达水平在24 h 出现下调,随着处理时间延长至36 h,表达水平呈极显著上调,分别是0 h 的3.69 倍和5.34 倍。干旱胁迫下,与0 h 相比,叶片和叶柄在处理36 h 时表达水平分别提高了9.89 倍和20.82 倍。氧化胁迫下,MeSWEET18 在SC9 的叶片、叶柄和茎杆的表达均呈显著下调,但是根的表达水平出现显著上调,24 h 的表达水平是0 h 的18.01 倍。低温(15 ℃)处理24 h,MeSWEET18 在叶片、叶柄、茎杆和根的表达呈显著下降,随着低温(4 ℃)处理24 h,MeSWEET18 在茎杆和根中的表达较0 h 呈现上升趋势。
3 讨论
SWEET 转运蛋白在植物中广泛存在,参与多种生理过程,如韧皮部装载、籽粒灌浆、花粉发育、叶片衰老以及响应生物和非生物胁迫等[16-17]。本研究从木薯SC9 中克隆获得MeSWEET18 基因序列,完整开放阅读框为714 bp,编码237 个氨基酸。系统进化树分析表明,MeSWEET18 位于CladeⅣ,与拟南芥AtSWEET16 和AtSWEET17属于同一进化分支。AtSWEET17 在叶片的果糖分配上发挥着重要作用,ATSWEET17 沉默株系表现为果糖积累功能紊亂、植株发育不良以及影响种子产量等[18]。对MeSWEET18 的糖转运能力进行检测,发现其主要转运果糖,与AtSWEET17主要影响果糖积累的研究结果一致。
拟南芥中过表达AtSWEET16 会促进植株发芽、生长发育以及提高植株对冻害的耐受性[19]。石竹DsSWEET17 的表达受外源果糖、葡萄糖、盐胁迫和渗透胁迫的影响,转化拟南芥后,能够促进根的生长[20]。萱草HfSWEET17 在低温胁迫下表达上调,过表达烟草能够提高其抗寒性[21]。茶树CsSWEET17 的交替剪接受低温胁迫的诱导,过表达植株显著降低了低温胁迫下电解质渗出水平[22]。麻风树JcSWEET16 基因能够响应叶片的干旱和盐胁迫,在拟南芥中过表达能够改良其开花时间和耐盐水平,但不影响其耐旱性[23]。对木薯SC9 水培苗进行盐、干旱、氧化和低温等非生物胁迫,结果发现MeSWEET18 在叶片、叶柄、茎杆和根等不同部位的表达变化差异显著,表明MeSWEET18 能够响应多种非生物胁迫。
外源施加20 mmol/L 蔗糖处理杭白菊,导致CmSWEET17 基因特异表达;过表达CmSWEET17可促进双节茎处理的腋芽生长。因此,CmSWEET17 基因可能通过生长素转运途径参与了蔗糖诱导的腋芽生长过程[3]。对木薯SC9 的水培苗进行蔗糖、果糖和葡萄糖的黑暗处理,发现随着黑暗处理时间的增加,MeSWEET18 的表达呈现显著下调,说明MeSWEET18 不仅对果糖胁迫敏感,对其他糖的胁迫也能产生响应。杨官显等[24]对苹果MdSWEET17 的研究发现,其在根和叶片中大量表达。在果实发育期,MdSWEET17的表达水平与果糖含量呈显著负相关[18, 24]。研究MeSWEET18 在木薯SC9 形成期、膨大期和成熟期的叶片、叶柄、茎杆和块根的表达,结果发现,其在成熟期的叶片、叶柄和茎杆大量表达,而在块根中的表达随着木薯的生长呈现先上升后下降的趋势。
在后续研究中,将测定SC9 不同非生物胁迫下蔗糖、果糖和葡萄糖等可溶性糖的变化,分析MeSWEET18 启动子序列中与非生物胁迫、糖信号等相关的顺式作用元件。构建过表达载体通过农杆菌介导法遗传转化木薯,对获得的过表达株系进行不同的非生物胁迫,分析MeSWEET18 以及糖代谢相关基因的表达趋势,为研究木薯糖代谢的分子通路提供依据。

