肥厚型梗阻性心肌病患者并发二尖瓣关闭不全的机制及其治疗策略研究进展
王秋雨, 张帅朋, 徐熙若, 李 馨, 商丽华
(1.清华大学临床医学院,北京 100084;2.安徽医科大学第一附属医院心脏大血管外科,安徽 合肥 230032;3.清华大学第一附属医院心脏中心,北京 100016)
肥厚型心肌病(hypertrophic cardiomyopathy,HCM)是一种以左心室壁不对称性肥厚为解剖特征的遗传性心脏病,发病率约为0.2%,其中有家族史者约占50%,男女患者比例为2∶1,平均发病年龄为(38±15)岁,病死率约为1%~2%[1]。约70% 的HCM 患者会发生左心室流出道梗阻(left ventricular outflow tract obstruction,LVOTO),进展成肥厚型梗阻性心肌病(hypertrophic obstructive cardiomyopathy,HOCM),这也是临床上导致青少年和运动员心源性猝死的最常见疾病之一[2-4]。大部分HOCM 患者伴有二尖瓣关闭不全(mitral insufficiency,MI),其成因既可能是因其先天发育异常,也可能是其自身病变进展所致。二尖瓣收缩期前向运动(systolic anterior motion,SAM)使二尖瓣前叶与室间隔接触,被认为是HOCM 患者发生LVOTO和导致患者出现不同程度MI 的重要原因[5]。有关HOCM 并发MI 相关治疗进展的报道较少,本文作者对HOCM 患者发生SAM 的机制和处理策略进行综述,为患者的精准治疗提供新的思路。
1 MI 在HOCM 中发生的机制
HOCM 中LVOTO、SAM 和MI 是互相作用的[6]。从物理学角度分析,文丘里效应可以解释HOCM 中的SAM 现象,由于间隔肌肥厚导致左室流出道(left ventricular outflow tract,LVOT)相对狭窄和梗阻,血液流经LVOT 时血流速度加快,进而产生负压,使二尖瓣前叶向LVOT 方向移位,产生SAM。SAM 进一步加重LVOT 的梗阻,进而导致MI[7]。但文丘里效应无法解释全部的SAM 现象,部分患者在进行肥厚间隔肌充分切除和LVOT血液流速降低至正常值后仍无法消除SAM[8]。因此,尽管文丘里效应很早就被提出,但SAM 的产生机制一直是研究者争论的焦点。RO 等[9]采用矢量流成像超声技术发现:在HOCM 患者中血流撞击二尖瓣前叶的夹角>60°时均产生SAM,并可见左心室收缩早期喷射流和等容涡流撞击突起的二尖瓣叶引发SAM,证实文丘里效应在SAM 的发生中仅起部分作用。SHERRID 等[10]研究显示:在SAM 发生起始阶段,左心室流出道的血流速度和正常血流速度比较并无明显差异,表明文丘里效应并非产生SAM 的决定性因素,血流对二尖瓣的推力才是SAM 的主要动力。血流对二尖瓣瓣叶推力见图1[10]。
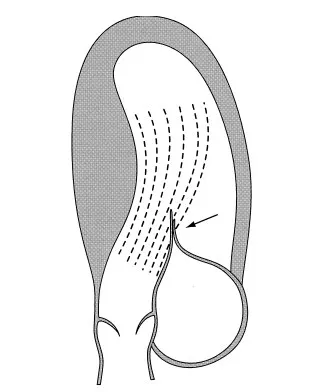
图1 血流对二尖瓣瓣叶推力示意图Fig.1 Schematic diagram of pushing force of blood flow on mitral valve leaflet
随着科技的不断进步,研究[11-13]发现:二尖瓣自身的结构因素对SAM 产生也起重要的作用。二尖瓣装置包括前后瓣叶、瓣下腱索和乳头肌。在腱索和乳头肌的牵拉下,二尖瓣前叶在收缩期可以保持在相对靠后的位置,不会造成SAM。但在HOCM 患者中,肥厚的间隔肌导致血流经过LVOT 时变为曲线血流撞击二尖瓣瓣叶,使二尖瓣前叶向LVOT 位移产生SAM,SAM 又进一步加重梗阻。此外,二尖瓣瓣叶对合点至室间隔距离过短、瓣叶自身器质性病变导致的瓣叶结构冗长、乳头肌位置前移对瓣叶的牵拉作用和腱索松弛也可以促进SAM 的形成[14]。因此,SAM 的诱因包括文丘里效应、二尖瓣自身结构因素、血流动力因素及瓣叶几何因素等,且各因素间存在复杂的相互作用,导致HOCM 患者出现SAM 和MI[12,15-16]。因此,HOCM 并发MI 是多种因素共同参与作用的综合表现,HOCM 并发MI 的治疗涉及肥厚间隔肌切除、二尖瓣瓣叶和瓣下装置处理等多个方面。
2 HOCM 并发MI 的治疗
HOCM 的患者应首选药物治疗,可供选择药物包括β 受体阻断药、非二氢吡啶类钙通道阻滞剂和丙吡胺等,目前也出现了以Mavecamten 为代表的精准生物学药物。对于药物治疗无效的HOCM患者,可选择外科手术切除或介入治疗,治疗的目的均为修复异常解剖结构和解除SAM 的危险因素[17]。目前经典的手术术式均是经“Morrow”手术演变而来,主要是对肥厚间隔肌进行切除以降低LVOT 压力[18]。而对于HOCM 并发MI 的患者外科治疗是否同期处理二尖瓣及如何处理二尖瓣,仍存在较大争议。
2.1 一般治疗对于已确诊HOCM 的患者,无论其年龄、性别、种族、是否接受过间隔肌切除治疗和是否置入心脏复律除颤器,均不应参加剧烈运动[19]。同时,建议患者禁酒,戒烟,不去增加血管扩张风险的场所。应避免使用动静脉扩张剂,防止回心血量减少,加重LVOT 梗阻。正性肌力药物如地高辛和多巴胺等也不应使用,避免病情加重。当患者出现心律失常时可加重因LVOT 梗阻而引起的症状,应尽快恢复窦性心律或控制心室率。
2.2 药物治疗药物治疗的目的是缓解劳力性呼吸困难、心悸和心绞痛等症状,提高患者的生活质量。但尚未有研究证实药物治疗能够有效预防疾病的进展[20]。
β 受体阻滞剂是临床一线用药[21]。HOCM 患者建议采用无血管扩张作用的β 受体阻滞剂,其剂量可升高至最大耐受剂量,以改善患者症状。其负性肌力作用可减少收缩力和梗阻,降低心率,提高舒张期充盈度,减少心肌需氧量和消耗量,进而改善患者症状。β 受体阻滞剂通常耐受性良好,在HOCM 患者中较少有禁忌证。但关于β 受体阻滞剂对患者死亡率和心源性猝死影响的长期研究较少,目前已知的药物无法降低室性心律失常或猝死的发生率[22]。
对于β 受体阻滞剂无效或不耐受的HOCM 和有LVOTO 症状的患者,建议改用非二氢吡啶类钙通道阻滞剂,如维拉帕米或地尔硫卓,也可以通过减少梗阻和降低心率改善患者症状。但对于症状较重的患者和年龄<6 周岁的儿童患者,维拉帕米具有一定潜在的危害性。
丙吡胺是一种抗心律失常药物,具有极强的负性肌力作用,可以使HOCM 患者的LVOT 梯度降低甚至消失,改善患者症状[23]。对于单独采用β 受体阻滞剂或维拉帕米无效的HOCM 患者,在心电监护下采用丙吡胺联合β 受体阻滞剂或维拉帕米也可改善患者症状。但对于并发房颤的HOCM 患者,应避免单独应用丙吡胺。
迄今,相关临床试验均未发现血管紧张素受体阻断剂对于HOCM 成年患者有明显的临床获益。研究[24]发现:对于具有肌节蛋白变异基因的早期青少年患者,缬沙坦可改善心脏重构的相关参数,如氨基末端脑利钠肽前体、左室舒张末容积和二尖瓣环处舒张早期心肌运动速度等,对于基线左室壁厚度较小的患者疗效更佳。但该试验随访时间短且受试者人数较少,平均年龄较小,研究结果可能存在偏倚。
Mavacamten 是一种新型口服选择性心肌肌球蛋白结构调节剂,通过减少肌动蛋白-肌球蛋白交叉桥的形成,降低心肌收缩性并改善心肌能量消耗。研究[16]显示:变构肌球蛋白抑制剂MYK-461即Mavacamten 可以有效削弱甚至逆转转基因小鼠模型中HCM 关键表型,开辟了心脏能量代谢选择性抑制剂的创新渠道。随后的Ⅱ期临床试验[25]证实:其可部分逆转基因突变导致的钙敏感性增加,改善心室收缩功能,消除SAM。近期Ⅲ期临床试验[26-27]也均证实其在减少LVOTO、改善运动能力和心脏功能及HOCM 患者健康状况方面的有效性和安全性。
2.3 介入治疗经导管室间隔酒精消融术(alcohol septal ablation,ASA)是一种有效的微创治疗策略,其原理是选择性地向靶间隔支内注入无水乙醇,使肥厚的室间隔心肌缺血和坏死,进而减轻LVOTO,适用于在接受最大剂量药物治疗后临床症状仍未缓解的HOCM 患者。ASA 的有效性和安全性已被多次证实,目前已成为治疗HOCM 的标准术式之一[28];其术后发生完全束支传导和室性心律失常的概率较低,且患者恢复较快。但不同患者可能存在解剖变异,需要制订个体化的治疗方案,避免可能产生的大面积心肌梗死和室间隔穿孔等并发症。ASA 主要局限性是其依赖于合适的冠状动脉解剖结构以提供靶向消融的途径,并非所有患者均适用ASA。
超声引导下经皮心肌内室间隔射频消融术(percutaneous intramyocardial septal radiofrequency ablation,PIMSRA)又称Liwen 术。该手术通过经皮心肌内途径在经胸心脏超声引导下将射频电极针通过经皮心肌内途径插入肥厚的室间隔,将尖端置于室间隔基底段区域,通过射频消融解除LVOT梗阻治疗HOCM,避免了胸骨切开和对冠状动脉解剖结构的依赖。PIMSRA 可精准识别导致阻塞的区域,避开右心内膜和左心内膜边界,以保护传导系统并防止心肌过度消融和纤维化,可能有助于改善患者远期预后。研究[29]显示:200 例接受PIMSRA 的HOCM 患者术后LVOT 峰值梯度持续降低,中期随访症状明显改善,且发病率和死亡率均较低。但目前该术式的临床研究仍是来自单中心的单臂观察性研究,且随访时间较短,仍需长期随访观察和多中心大型临床试验的验证。
经皮心内膜室间隔射频消融治疗(endocardial radiofrequency ablation of septal hypertrophy,ERASH)是一种新的治疗手段,可用于不适合行外科间隔肌切除术或ASA 的患者。ERASH 通过消融导管在室间隔梗阻区释放射频电流,使该区域心肌坏死挛缩,从而减弱LOVTO。2004 年,LAWRENZ 等[30]对1 例45 岁男性患者首次使用了ERASH 技术并取得较好效果。随着心脏三维电解剖标测和心腔内三维超声技术(intracardiac echocardiography,ICE)的发展,在其指导下的ERASH 能够清晰定位梗阻区和心脏传导系统,可精准消融室间隔区肥厚心肌,并可降低消融损伤传导系统发生率,减少无效消融范围,且不依赖于合适的冠状动脉解剖结构来提供靶向消融的途径。近期国内外研究[31-32]均证实:患者术后LOVTO 较术前明显减弱,心功能有所改善,且相关并发症发生较少。但ERASH 仍处于发展期,数据相对匮乏,其可行性和可靠性尚需更多研究证实。
经导管二尖瓣修复术(transcatheter mitral valve repair,TMVR)用于肥厚型心肌病左心室流出道梗阻的治疗,是另一种新型治疗方式[33],其原理是经胸超声心动图引导下或在放射线透视下通过经导管二尖瓣钳夹系统限制SAM,进而降低或解除LVOTO,同时改善MI。但TMVR 目前仅有少量回顾性研究及个案报道,仍缺乏大型的临床对照研究以探讨其确切疗效和长期安全性及可靠性。
2.4 外科手术治疗对药物治疗不耐受或症状持续无法缓解的患者,可以将肥厚室间隔切除术作为治疗方法。外科室间隔切除术由MORROW 等[34]创立,即经典Morrow 术。但经典Morrow 术仅切除部分瓣下心肌,无法完全解除梗阻,后经改良和扩大,形成了改良Morrow 术。该术式可有效扩大左心室容积,与经典的Morrow 手术比较,其切除范围更广泛[35-36],可消除SAM 的病理生理改变以解决梗阻,是临床上治疗HOCM 的标准术式[37]。目前肥厚室间隔切除入路包括经典的经主动脉切口入路、经左心房二尖瓣入路和经心尖入路[18]。经主动脉切口入路需于胸骨正中作切口,对于主动脉瓣环小、室间隔严重肥厚和二尖瓣前叶冗长的患者,经主动脉途径较为困难,可能会导致切除不充分或发生SAM,有时也易损伤主动脉瓣[38]。LILLEHEI 等[39]提出开胸经二尖瓣入路进行室间隔切除术,对于并发心房颤动、卵圆孔未闭或需继续干预二尖瓣时较为方便,后续操作在同一切口即可完成,避免了切开主动脉和主动脉瓣的创伤。尽管入路的选择有所优化,传统正中开胸心肌切除术仍存在学习曲线长、手术创伤大和切口不美观等缺点。随着科技的发展,在胸腔镜或机器人辅助下完成室间隔切除的技术也日渐成熟[40-41]。采用3D 重建和打印技术,术者在术前可确定肥大心肌的切除范围,术中结合胸腔镜放大视图功能和视野优势,辅以机器人精准切除肥厚室间隔区域,极大提高了手术的安全性和有效性[42]。与胸骨正中切开比较,机器人辅助经二尖瓣瓣口室间隔切除术治疗HOCM 的创伤更小,尤其适用于需同期行二尖瓣修复的患者。经心尖入路切除肥厚心肌适用于心室中部梗阻、梗阻长度>60 mm 和并发心尖室壁瘤的HCM 患者[43],但该术式在处理HOCM 患者中并不常见。因此,对药物治疗无效的HOCM 患者,尤其是LVOT 压力梯度极高的患者,外科手术具有良好效果[44]。在手术过程中切除肥厚室间隔是治疗的关键,需要根据临床患者的实际情况选择合适的手术入路进行室间隔切除,以降低左室流出道压力梯度。
二尖瓣由纤维环、前后瓣叶、交界瓣叶、腱索和乳头肌组成。纤维环形成胶原框架,使瓣膜组织附着于房室口。二尖瓣环呈马鞍状,前内侧面与主动脉瓣的左冠状尖和部分非冠状尖相连。二尖瓣前叶和后叶的表面积是二尖瓣环面积的2 倍,以实现最佳的瓣尖对合。若对合的长度短于环的大小,即会发生MI。二尖瓣前叶呈三角形,其长度约为后叶的2 倍,且后叶的活动度较前叶小。二尖瓣前瓣和后瓣通过一级和二级腱索的广泛分支网络连接至相应的乳头肌,乳头肌位于左心室顶端和中间三分之一交界处,并向腔内的瓣叶连接处投射。乳头肌对于瓣叶的对齐和防止反流较为关键。目前关于HOCM 并发MI 的患者二尖瓣治疗方面最权威的是以美国梅奥诊所为首的单纯切除心肌观点[45]和以美国克利夫兰诊所为首的可积极干预二尖瓣观点[46-47]。研究[45]显示:大部分HOCM 患者中,与SAM 相关的MI 可通过充分的肌切除术得到缓解。较少需同时进行二尖瓣的干预手术。当二尖瓣存在器质性病变时,与二尖瓣置换比较,行二尖瓣修复的患者生存率较高,故应作为首选。因此,梅奥诊所主张对非器质性二尖瓣异常的HOCM 患者,无论其反流程度轻重,均首选室间隔扩大切除术。研究[46-47]表明:HOCM 患者二尖瓣存在器质性病变时,在进行室间隔充分切除同时对二尖瓣干预治疗是一种有效的辅助手段。因此主张对二尖瓣自身器质性病变的患者积极进行二尖瓣干预,在切除肥厚室间隔的同时对器质性病变的二尖瓣进行修复,恢复其正常的几何结构,使前后瓣叶的对合后移,充分解除SAM 现象,降低LVOT 的压力梯度。欧洲ESC 指南[48]显示:约11%~20% 的HOCM 患者在接受心肌切除的同时可能需要同期处理二尖瓣,且在术前室间隔厚度较低(≤16 mm)的患者中该比例可能更高,室间隔切除同时二尖瓣干预患者的死亡率为3%~4%。国内研究[49]表明:对术前超声提示无二尖瓣器质性病理改变的患者,扩大心肌切除术可消除绝大部分患者的LVOT 梗阻和SAM相关二尖瓣反流。在未并发二尖瓣器质性病变时,HOCM 患者极少需要同期处理二尖瓣。
HOCM 并发MI 的患者存在二尖瓣器质性病变时,二尖瓣修复可采取多种方式。部分高龄和有酒精消融史的HOCM 患者,二尖瓣长期碰撞室间隔,导致前叶纤维化和面积缩小,当二尖瓣前叶面积<12 cm2时可采用二尖瓣前叶扩大术[50-51]。若二尖瓣前叶的高度小于其宽度,可以在瓣环下5 mm 横行切开,若宽度明显小于高度,可以做垂直切口(图2)[52]。二尖瓣前叶扩大术将一片自体心包补片缝合至二尖瓣前叶中央切口中。对于前叶面积缩小的患者,补片扩大弥补了面积不足和前后叶长度比例小的问题;而对于二尖瓣前叶面积较大的患者,补片扩大沿水平方向增大二尖瓣面积,二级腱索因此随之外移伸展。同时,补片将二尖瓣上的曲折点硬化,增强瓣叶的对合,加之流出道空间已扩大,可抵消SAM 所带来的负面影响。
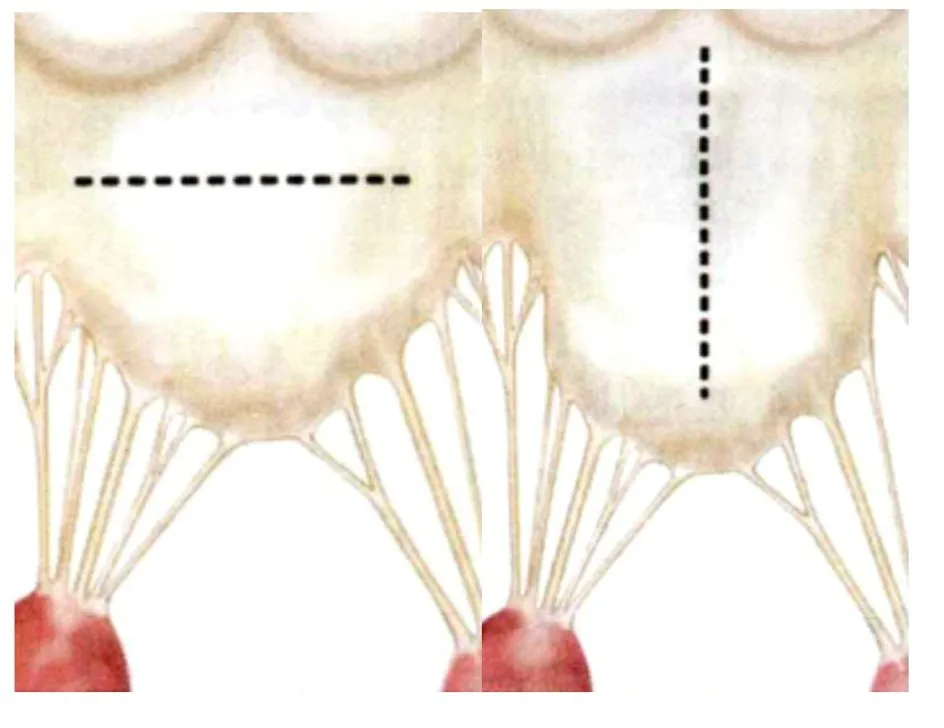
图2 二尖瓣前叶扩大术Fig.2 Expansion of anterior mitral valve leaflet
HOCM 并发MI 的患者二尖瓣瓣叶松弛和冗长时也可采用切除-折叠-松解术式[53]。该技术除基本的心肌切除外,还将增大和冗长的二尖瓣前叶在水平方向上折叠,瓣叶由此缩短,二尖瓣对合点随即向后位移,有利于SAM 的消除(图3)[54]。研究[55]显示:HOCM 患者平均随访时间为5.6 年,5 年和10 年生存率分别为98%和92%,尽管其术后效果良好,但仍需要在术前严格筛选患者,还需要大中心的随机临床研究进一步证实该术式的疗效。
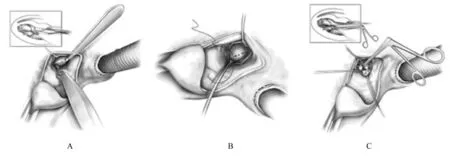
图3 切除-折叠-松解术Fig.3 Resection-Plication-Release repair
德国柏林心脏中心推荐采用前瓣叶保留成形术,在进行室间隔充分切除的同时,将最靠近三角区的二尖瓣前叶段缝合至两侧相应的后瓣环上(图4)[56]。当HOCM 并发MI 患者的二尖瓣前瓣叶冗长时,该术式使前瓣叶运动的根部后移,以达到消除SAM 的目的。术后87%的患者MI 消失,其他患者均为轻度MI,所有患者SAM 完全消除,20 年累积生存率分别为92.9%和91.2%。尽管术后效果较好,但在术中应注意缝合的区域不可过度,以免造成二尖瓣的狭窄。
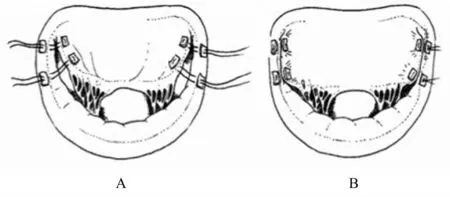
图4 前瓣叶保留成形术Fig.4 Anterior mitral leaflet retention plasty
名古屋大学心脏中心采用了漂浮缝合技术,将缝线穿过A2 区的前瓣叶边缘,再将该缝线缝合至P2 区的瓣环[57]。漂浮缝合技术限制了前瓣叶向LVOT 的过度运动,消除HOCM 患者的SAM,降低左心室流出道梗阻,在降低前叶运动的同时又不影响后叶的运动功能,并保证了二尖瓣瓣口的面积(图5)[57]。但仍需要大型临床试验和长期随访来验证该技术的有效性及安全性。
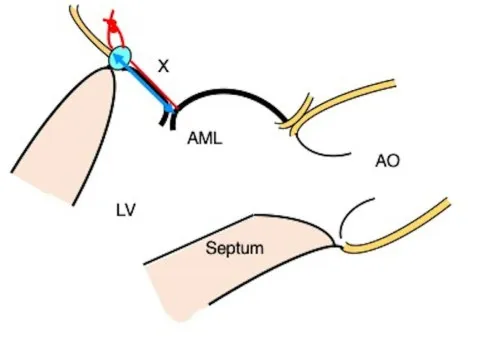
图5 漂浮缝合术Fig.5 Floating stitch technique
当HOCM 患者由SAM 单独引起的MI 未出现二尖瓣瓣膜结构异常或器质性病变时,可仅行室间隔切除术。而对于严重二尖瓣反流HOCM 患者的手术决策仍存在争议。即使是在大体量的心脏中心,SAM 患者同时行二尖瓣手术的百分率也仅为8%~25%[58]。对于LVOTO≥50 mmHg 且非由SAM 单独引起的中度至重度二尖瓣反流的HOCM患者,Ⅱa 级推荐二尖瓣修复或置换[59]。对于室间隔严重肥厚的HOCM 患者,修复二尖瓣较为困难,需要进行充分的术前评估和心脏团队的密切配合。HE 等[60]研究显示:HOCM 患者除进行室间隔切除术外,还分别进行了二尖瓣修复和置换,术后取得了相似的结果,即消除SAM、二尖瓣反流和LVOT 梗阻。研究[61]显示:由于二尖瓣修复术后总生存率和血栓栓塞事件发生率低,因此二尖瓣修复术应为HOCM 并发瓣膜疾病患者首选的手术方式。在退行性瓣膜疾病中,二尖瓣修复较为困难。KLUES 等[62]研究显示:二尖瓣修复后的残余SAM 主要在退行性疾病患者中存在。但肥厚室间隔切除和二尖瓣修复具有死亡率和并发症发生率低的特点,也可应用于HOCM 并发退行性瓣膜病需行二尖瓣修复术的患者[11]。
二尖瓣瓣下结构解剖异常也可导致HOCM 患者发生MI,在进行充分室间隔切除的同时也需要对异常的瓣下结构进行处理。克利夫兰诊所主张对瓣下结构异常的HOCM 患者行外科干预,包括拴扎、切除异常腱索、切除异常乳头肌和将肥大或前移的乳头肌头部与后乳头肌头部捆绑重新定位[47]。捆绑异常乳头肌限制了前乳头肌的活动,改善瓣叶松弛,对合点远离流出道,有利于消除SAM。正常心脏的腱索有利于保证心室收缩期正常的形态和二尖瓣的功能,但HOCM 患者的异常腱索可能使纤维组织增厚或松弛冗长,在乳头肌的牵拉下导致SAM 产生。因此,FERRAZZI 等[63]将类似患者的乳头肌和二尖瓣前叶间的二级腱索及增生纤维组织一并切除,可使二尖瓣前后叶的对合点向后移位,保证左心室流出道不受SAM 的影响。目前关于HOCM 并发MI 患者二尖瓣瓣环的处理尚存在争议。研究者[45-47]认为:存在二尖瓣器质性病变时需进行瓣环成形术,不存在器质性病变时则无需处理。CARPENTIER 等[52]认为:在进行二尖瓣前叶扩大术时患者应植入成形环以调整瓣环尺寸并适应重建后的前叶,可轻微扩大前后径的经典成形环较佳。最常用的成形环尺寸为32 mm 和34 mm。此特殊手术技术中成形环的作用是扩大二尖瓣瓣口面积,将二尖瓣后叶向后移位并对抗瓣环的过度收缩运动,同时也有利于将二尖瓣前后叶对合点向后位移,有利于消除残余SAM。
3 总 结
目前对于HOCM 并发MI 患者的治疗新进展较多,但ASA 和外科干预仍是较为重要的方式,其核心在于修复异常的解剖结构,解除SAM 产生的危险因素。目前关于SAM 产生的机制和原理尚存在较大争议,而手术策略的制订较大程度上取决于个体中诱发SAM 产生的危险因素,导致不同中心在治疗HOCM 并发MI 患者时采用不同的手术方式,但其本质均是为解除LVOT 梗阻的同时消除SAM 的危险因素。当HOCM 并发MI 患者的二尖瓣存在器质性病变时,恰当的二尖瓣外科干预手术可以作为室间隔切除术的辅助治疗方式,有利于消除残余SAM,提高疗效,而二尖瓣手术方式的选择需依据二尖瓣瓣叶形态和瓣下结构。SAM 产生机制涉及多个方面,文丘里现象不足以解释所有HOCM 患者中发生的SAM,LVOT 和SAM 与MI之间互相影响构成复杂的病理生理机制,需要进一步研究明确HOCM 患者中LVOT、SAM 和MI 发生的确切机制,针对不同个体选择合适的治疗措施,才能实现精准治疗。

