混合性肾细胞癌行腹腔镜下肾部分切除术1 例报告及文献复习
赵 群, 王寅春, 王 旭, 惠鹏祥, 汤高文, 孙梦鸽, 段思宇, 李然伟
(吉林大学第二医院泌尿外科,吉林 长春 130041)
肾细胞癌(renal cell carcinoma,RCC)简称为肾癌,是泌尿系统中最常见的肿瘤之一。据统计,RCC 的发病率占我国泌尿生殖系统肿瘤的第二位,仅次于膀胱肿瘤,患者中男性多于女性,且RCC 的发病率逐年升高[1]。根据2016 年世界卫生组织(World Health Organization,WHO)泌尿系统肿瘤分类[2],将RCC 分为肾透明细胞癌(clear cell renal cell carcinoma,CCRCC)、乳头状RCC(papillary RCC,PRCC)、遗传性平滑肌瘤病肾癌综合征相关性肾癌、嫌色细胞癌、集合管癌、髓质癌、MiT 家族易位性肾癌、SDH 缺陷相关性肾癌、黏液样小管状和梭形细胞癌、管状囊性肾癌、获得性囊性肾疾病相关性肾癌、肾透明细胞乳头状癌和未分类RCC 等多种亚型。其中CCRCC 是RCC 中最常见的类型,占70%~90%,其次为PRCC,占10%~15%,PRCC 又分为Ⅰ型和Ⅱ型[3]。2005 年LEFÈVRE 等[4]报道一种形态学上难以归入Ⅰ型或Ⅱ型乳头状癌的嗜酸细胞乳头状肿瘤,并将其命名为PRCC 的新亚型—嗜酸细胞性乳头状RCC(oncocytic papillary RCC,OPRCC),被认为是PRCC 的第3 种亚型[5]。但是WHO 暂未将其认定为一种独立的肿瘤类型,在2012 年温哥华共识会议[6]上有75% 的专家建议暂时将其归为Ⅱ型PRCC。但由于对其认识不足,该分类尚存在一定争议。目前,国内外报道的OPRCC 病例十分罕见,而OPRCC 和CCRCC 混合性RCC 的病例国内外尚未见报道。该病例无特异性临床表现,术前诊断主要依靠影像学检查,该病例的2 种不同肿瘤成分混合在一起,在影像学上呈现出不同表现和增强模式。OPRCC 和CCRCC 混合性RCC 确诊主要依靠病理组织学检查,手术切除是治疗该病的首选方法。OPRCC 与CCRCC 混合性RCC 为不同组织学类型的2 个肿瘤并存于单侧肾脏,患者2 个肿瘤紧邻,各自包膜完整,由于其特殊性,OPRCC 和CCRCC 的发病机制可能有某些内在联系。本文作者报道1 例OPRCC 和CCRCC 混合性RCC 患者,分析其临床及病理特点,并进行文献复习,旨在提高临床医生和病理医生对该病的认识。
1 临床资料
1.1 一般资料患者,男性,52 岁,因体检发现右肾肿物1 d,于2021 年11 月17 日收入本科,病程中无肉眼血尿、无腰背部疼痛和腹部肿块等典型RCC 的临床表现。患者自述既往体健,否认家族遗传病史及类似疾病史。入院查体:双腰曲线对称,双侧肾区无压痛及叩击痛,双肾脏均未扪及。沿双侧输尿管走向无压痛,未触及肿块。膀胱无隆起及压痛,阴茎及阴囊未见明显异常。超声检查显示:右肾内探及1 个3.5 cm×3.4 cm 的低回声光团,其内可见血流信号。双肾平扫+增强CT 显示:右肾实质见结节状稍高密度影,向肾外突出生长,大小约为3.5 cm×2.0 cm(图1A),增强扫描见肿瘤呈现出不同程度强化(图1B),右肾占位性病变,考虑恶性肿瘤的可能性大。实验室检查结果显示:血白细胞总数为12.1×109L-1,中性粒细胞计数为6.86×109L-1,单核细胞计数为0.7×109L-1,嗜碱性粒细胞计数为0.08×109L-1,血红蛋白水平为187 g·L-1,淋巴细胞计数为4.3×109L-1,红细胞计数为6.12×1012L-1,红细胞压积为55.5%,空腹血糖为11.81 mmol·L-1,餐后2 h 血糖为12.33 mmol·L-1,糖化血红蛋白为9.5%,其余检验结果未见明显异常。入院第2 天,复查血常规恢复正常。

图1 患者术前双肾CT 影像Fig.1 CT images of double kidneys of patient before operation
1.2 治疗经过入院后积极控制患者血糖,完善相关检查,因患者肾脏肿瘤直径<4 cm,且肿瘤位于肾中下极,局部突出肾脏外,符合肾部分切除术的手术适应证,充分术前准备,于2021 年10 月22 日在插管全麻下行腹腔镜下右肾部分切除术,术后切开病理标本见2 个肿瘤。术后病理显示:(右肾下极)混合性RCC,OPRCC(最大径约为2.5 cm)和CCRCC (最大径约为1.8 cm)2 级,肿瘤累及肾被膜,肾周围脂肪未见癌细胞,切缘未见癌细胞。
1.3 病理检查大体标本:灰红色组织1 块,体积大小约为4.5 cm×3.5 cm×3.5 cm,剖开组织,可见2 个紧邻灰黄灰红肿瘤,其中较大的肿瘤直径约为2.5 cm,肿瘤切面颜色可变,无坏死;较小的肿瘤直径约为1.5 cm,伴有坏死,肿瘤呈结节状,与周围肾组织界限清晰。见图2。显微镜下显示:肿瘤界限清晰,周围有纤维包膜包绕,较大的肿瘤细胞呈椭圆形或圆形,细胞质丰富、呈强嗜酸性,似嗜酸细胞,排列成乳头状,乳头中可见泡沫细胞聚集;较小的肿瘤细胞呈圆形或多边形,细胞质丰富、透明,细胞核小且居中,核周围为泡沫状包浆,排列成条索状,间质血管丰富。见图3。免疫组织化学染色结果:CK(AE/AE3)(部分+)、Vimentin (部分+)、EMA (部分+)、CK7(+)、CD10(+)、CAIX(局部+)、P504s(+)、PAX-8 (弱+)、TFE3 (-)、HMB45(-)、MelanA(-)、SDHB(+)和Ki-67(阳性率为2%)。见图4。
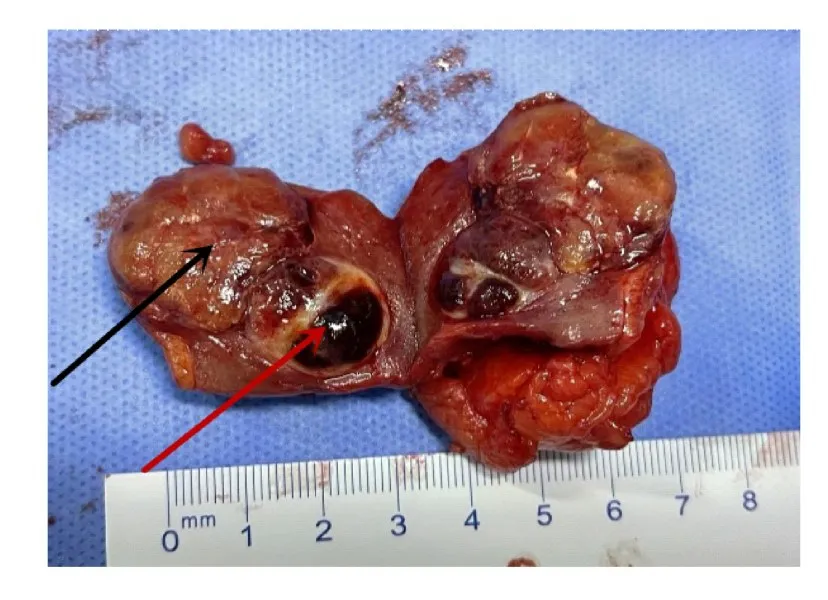
图2 右侧肾脏混合性RCCFig.2 Mixed RCC of right kidney
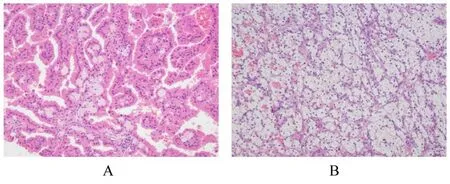
图3 混合性RCC 患者肿瘤组织病理形态表现(HE,×100)Fig.3 Histopathology of tumor tissue of patient with mixed RCC(HE, ×100)
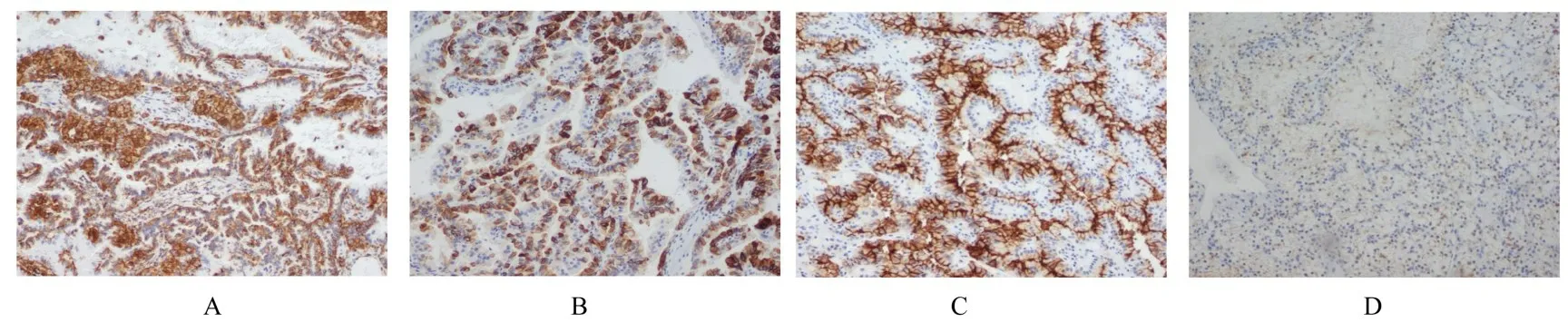
图4 混合性RCC 患者肿瘤组织形态表现(免疫组织化学,×100)Fig.4 Morphology of tumor tissue of patient with mixed RCC(Immunohistochemistry,×100)
1.4 随访资料2022 年3 月2 日患者于本院门诊复查,行双肾平扫和增强检查未见肿瘤局部复发及转移,术后6个月电话随访,患者一般状态良好,无不适症状。目前对于患者的随访工作仍在密切进行中。见图5。
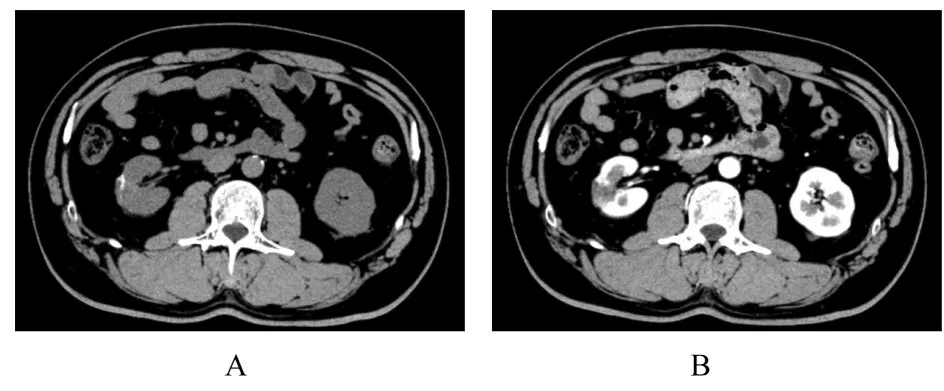
图5 患者术后双肾CT 影像Fig.5 CT images of double kidneys of patient after operation
2 讨 论
RCC 根据组织学类型主要分为CCRCC、PRCC、嫌色细胞癌、肾集合管癌和未分类RCC 等亚型。RCC 通常起源于肾小管上皮细胞或集合管上皮细胞,多为单侧肾脏单发病灶。BRATSLAVSKY 等[7]报道:多发RCC 发病率为4.3%~25.0%,其中单侧多发RCC 占多发RCC 仅约10%,而单侧肾脏并存2 种不同组织亚型的RCC 更为罕见。RCC 组织学类型一般以1 种细胞类型的单个肿瘤存在,不同组织学类型的多个肿瘤并存于单侧肾脏的病例临床罕见。恶性复合肿瘤可以是不同组织类型的RCC,其中最常见的复合肿瘤为PRCC 和CCRCC 合并为1 个肿块[8]。国内外有关OPRCC 病例的报道十分罕见,而OPRCC 和CCRCC 结合的混合性RCC 病例目前尚未见报道。CCRCC 是RCC 最常见的病理类型,占70%~90%,主要起源于肾小管上皮细胞。CCRCC 的遗传学改变主要以染色体3p 缺失为特征,目前认为VHL 基因突变是CCRCC 的主要遗传学改变,VHL 蛋白失活导致缺氧诱导因子异常聚集是诱导疾病发生的重要途径[9]。PRCC 是仅次于CCRCC的第二大类常见RCC,占RCC 的10%~15%,主要起源于肾远曲小管或近曲小管[3]。PRCC 根据组织学类型和预后差异分为Ⅰ型和Ⅱ型[10]。Ⅰ型PRCC 细胞体积较小,胞质较少,呈嗜碱性,乳头被覆单层立方状小细胞,细胞一般呈单层排列,核异型性较小;Ⅱ型PRCC 细胞体积较大,胞质丰富,呈强嗜酸性,乳头被覆假复层柱状细胞,细胞一般呈假复层排列,核异型性明显[11]。而OPRCC作为PRCC 的新亚型,由LEFEVRE 等[4]最先报道。OPRCC 国内外罕见,目前对于该病的发病率尚无可靠的流行病学报道,但在可检索到的国内外70 余例病例中,OPRCC 的发病具有明显的性别差异,其男女比例约为2∶1[4,12-24]。OPRCC 的遗传学改变主要是7、16 和17 号染色体三体性及男性患者的Y 染色体丢失[22]。研究[14]表明:PRCC 患者的预后相对较好,平均转移和癌症相关死亡率分别为12%和14%,而OPRCC 生物学行为则显得更为惰性,临床上较少发生复发及转移。在收集的70 余例OPRCC 患者中,仅有2 例患者出现复发及肿瘤转移,其中1 例为术后2 年复发,而在随之的2 年后死于脑转移;另外1 例为术后8 个月死于肿瘤骨转移[12-13]。
肾癌的常见临床表现为肉眼血尿、腰痛和腹部肿块,被称为肾癌的“三联症”[25]。但临床上绝大多数患者均无明显不适症状,主要是定期体检或其他疾病检查时发现肾脏占位而就诊。
肾癌的术前诊断主要依靠影像学检查,影像学检查能提供最直接的诊断依据,而该患者为2 种不同肿瘤成分混合在一起,在影像学上有不同的表现和增强模式,对于混合性RCC 的CT 表现,在CCRCC 成分中的强化程度较高,而在OPRCC 成分中的强化程度较低[8]。其中,CCRCC 的平扫CT 多表现为肾实质内肿块,常为类圆形,肿瘤在肾轮廓局部向外突出,肾实质可见稍高密度影,多期增强CT 多表现为不均匀“快进快出”强化。而OPRCC 的平扫CT 多表现为均匀低密度影,内部可见低密度坏死区,多期增强扫描时强化CT 值较低,仅有20~30 HU[26]。MRI 检查中CCRCC 在T1WI 呈等或低信号,在T2WI 呈不均匀高信号,约15% 伴囊性变,10%~15% 可见钙化[27]。而OPRCC 在T1WI 和T2WI 均呈等或低信号,且OPRCC 多为大小不一,形态规则,呈圆形或类圆形的单发囊实性肿块,大部分肿瘤位于肾皮质呈外生性生长,突出肾轮廓之外,少部分肿瘤局限于肾皮髓质内,呈内生性生长[28]。
免疫表型方面,CCRCC 通常表现为Vimentin、CK (AE1/AE3)、CD10 和碳酸酐酶Ⅸ(G250)阳性。而CD117、肾特异性钙黏蛋白和parvalbumin 通常呈阴性[29]。研究[13]表明:Ⅰ型和Ⅱ型PRCC 的免疫表型不同。Ⅰ型PRCC 的免疫染色多呈AMACR、Vimentin、CK7 和EMA 弥漫性阳性,Ⅱ型PRCC 的免疫染色多呈AMACR、Vimentin和CD10阳性。大部分OPRCC对AMACR、Vimentin、CD10、CK7 和EMA 的免疫染色部分呈阳性,其中CD10 表达率较高,CK7 和EMA 表达率较低。由此可见,OPRCC与Ⅱ型PRCC 具有更多的免疫表型相似性。LEFÈVRE 等[4]认为:OPRCC 的免疫特征为AMACR、Vimentin 和CD10 呈强表达,但OPRCC 的最终分类还需要大量的临床研究进行深入探讨。
ZORN 等[30]认为:根治性肾切除术是目前RCC 的主要治疗手段,但对于肿瘤直径<4 cm 时,保留肾单位的肾部分切除术的疗效与根治性肾切除术相似,甚至优于根治性肾切除术。因此,对于体积较小或恶性程度较低的肿瘤,保留肾单位手术已成为外科手术治疗的重点,可以保护肾功能,提高患者生活质量[31]。OPRCC 和CCRCC 对放疗和化疗均不敏感,目前认为此类混合性RCC 术后无需放化疗。而且局限性RCC 手术后尚无标准的辅助治疗方案[5]。术后应用免疫抑制剂和靶向药物治疗均有一定疗效,但疗效可能因种族差异而不同[32]。
综上所述,OPRCC 与CCRCC 并存的混合性RCC 为不同组织学类型2 个肿瘤并存于单侧肾脏,该患者2 个肿瘤紧邻,但每个肿瘤之间各自存在包膜,且2 种不同组织学的肿瘤于单侧肾脏同时发病,提示OPRCC 和CCRCC 可能在发病机制上存在某些内在联系,但要明确OPRCC 与CCRCC 并存的混合性RCC 的发病机制,还需要进一步研究证实。OPRCC 与CCRCC 并存的混合性RCC 确诊主要依靠病理组织学检查,肿瘤恶性程度较低,预后较好,但仍需长期密切随访。

