基于转录组学探讨气阴两虚型2 型糖尿病病证结合大鼠模型证候表现与差异表达基因的关系
黄晓巍, 张思琪,, 张译心, 刘 博, 王 鑫, 纪凤兰, 杨润泽,, 徐惠波, 丁 涛
(1.长春中医药大学药学院中药药理学实验室,吉林 长春 130117;2.吉林省中医药科学院药效毒理评价中心,吉林 长春 130012;3.吉林大学中日联谊医院药物临床试验机构,吉林 长春 130033)
病证结合动物模型是连接中医药临床研究和基础研究的纽带,是基于疾病模型对动物宏观体征进行动态观察,并结合微观指标判别建立的符合临床证候特点的动物模型。目前在探索建立病证结合动物模型的评价标准时通常结合经典生化指标进行综合评价,但部分证候模型的发生机制尚不明确。转录组学技术能够从分子水平上筛选证候相关基因,并结合生物信息学方法探索基因相互调控规律,为证候发生和演变的物质基础提供新思路,如常见的阴虚证必然存在与细胞生长、凋亡和糖脂代谢有关基因的变化[1-4]。消渴灵片主要由黄芪、黄连和麦冬等11 味中药组成,具有滋补肾阴、生津止渴和益气降糖的功效,可以改善2 型糖尿病患者气阴两虚证候表现。本课题组前期研究[5]依据《中药新药临床研究指导原则》[6]中患者临床表现,初步建立气阴两虚型2 型糖尿病病证结合动物模型[6],以消渴灵片作为该模型的佐证药,初步证实该病证结合动物模型基本符合气阴两虚型2 型糖尿病的临床证候特点。本研究在此基础上采用高通量测序技术,对气阴两虚型2 型糖尿病相关证候基因进行研究,从mRNA 表达水平筛选差异基因,结合宏观表征和生化指标探讨气阴两虚型2 型糖尿病证候特征与差异表达基因的关联性。
1 材料与方法
1.1 实验动物、药物、主要试剂和仪器SPF 级雄性SD 大鼠49 只,体质量150~170 g,购自辽宁长生生物技术股份有限公司,动物生产许可证号:SCXK(辽)-2015-0001。消渴灵片(云南白药集团股份有限公司),链脲佐菌素(streptozocin,STZ)(美国Sigma 公司)。普通饲料(北京科澳协力饲料有限公司),高糖高脂饲料(KK 鼠料,北京华阜康生物科技股份有限公司),柠檬酸钠和柠檬酸(北京化工厂),环磷酸腺苷(cyclic adenosine monophosphate,cAMP)、环磷酸鸟苷(cyclic guanosine monophosphate,cGMP)、CD4 和CD8试剂盒(美国RD 公司),RNA 超快速文库制备试剂盒、Poly(A)mRNA 磁性分离试剂盒、多重寡核苷酸(引物1)和多重寡核苷酸(引物2)(美国新英格兰生物实验室有限公司),RNA 6000 Pico 芯片、DNA 试剂盒和RNA 6000 Nano 芯片(美国安捷伦科技有限公司),QubitTMRNA 宽范围(BR)、QubitTMDNA 宽范围(BR)和QubitTMDNA 高灵敏度试剂盒(美国赛默飞世尔科技公司),KAPA SYBR FAST qPCR 预混液、DNA 定量标准品和引物预混试剂盒(美国KAPA Biosystem 公司)。pH 计[赛多利斯科学仪器(北京)有限公司,型号PB-10],血糖仪(中国深圳家康科技有限公司,型号BGM506),大鼠抓力测定仪(山东省医学科学院济南益延科技发展有限公司,型号YLS-13A),多导生物记录仪(澳大利亚ADInstruments 公司,型号PowerLab/8S),低速台式离心机(北京时代北利离心机有限公司,型号DT5-3),数码相机(日本富士公司,型号HS11),酶标仪(美国Bio Tek 公司,型号ELx800),全自动生化分析仪(长春迪瑞实业有限公司,型号CS-600B),欧姆龙红外额式体温计[欧姆龙健康医疗(中国)有限公司,型号MC-872],96 孔热循环器(上海伯乐生命医学产品有限公司,型号B01-02),生物分析仪2100(美国安捷伦科技有限公司,型号J06-02),QUBIT 2.0 荧光计(美国赛默飞世尔科技公司,型号Q32871),高通量PCR 仪(上海伯乐生命医学产品有限公司,型号B01-01)。
1.2 实验动物分组、造模和给药随机选取18 只雄性SD 大鼠作为空白组(喂食普通饲料),其余大鼠高糖高脂喂养联合腹腔注射35 mg·kg-1STZ 建立2 型糖尿病大鼠模型。于实验第6 周根据血糖和体质量均衡原则将造模成功的31 只大鼠分为模型组(n=14)和药物佐证组(n=17),模型组大鼠继续高糖高脂饲料喂养,药物佐证组大鼠灌胃消渴灵2.2 g·kg-1·d-1,实验进行至第21 周。
1.3 大鼠一般状态的采集方法和评分参照《中药新药临床研究指导原则》[6]中气阴两虚型2 型糖尿患者临床研究证候表现,分别采用体质量、进食量、饮水量、精神状态评分、运动评分、足温、抓力、脉搏幅度、呼吸频率和舌象积分指标评价模型大鼠口渴喜饮、多食易饥、倦怠乏力、气短懒言、五心烦热和舌红脉细的证候表现,运动和精神状态评分具体方法见参考文献[5]。
1.4 各组大鼠体质量、进食量、饮水量、足温、抓力、脉搏幅度、呼吸频率和舌象积分检测每4 周称量1 次大鼠体质量,每3 周记录1 次大鼠24 h 进食量和饮水量。分别于第0 周和第21 周检测各组大鼠抓力、呼吸频率、脉搏幅度和足温,于第21 周检测各组大鼠舌体颜色,具体测定方法见参考文献[5]。
1.5 各组大鼠空腹血糖(fasting blood glucose,FBG)水平检测于实验第0 周和第21 周进行尾静脉采血,采用血糖仪直接检测各组大鼠FBG 水平。
1.6 各组大鼠血清中血脂指标水平检测于第21 周大鼠腹主动脉采血,静置30 min后,3 000 r·min-1离心15 min,取上层血清,采用氧化酶法检测各组大鼠血清中甘油三酯(triglyceride,TG)和总胆固醇(total cholesterol ,TC)水平,直接法检测各组大鼠血清中低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-c)和高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-c)水平。
1.7 酶 联 免 疫 吸 附 测 定(enzyme-linked immunosorbent assay,ELISA)法检测各组大鼠血清中CD4、CD8、cAMP 和cGMP 水平各组选取8 只大鼠,于第21 周大鼠腹主动脉采血,静置30 min 后,3 000 r·min-1离心15 min,取上层血清,根据试剂盒操作方法检测血清中CD4、CD8、cAMP 和cGMP 水平。检测步骤如下:在预先包被CD4、CD8、cAMP 和cGMP 抗体的包被锁孔中,依次加入标本、标准品和辣根过氧化物酶标记的检测抗体,经过温育并彻底洗涤。采用底物TMB 显色,TMB 在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的CD4、CD8、cAMP 和cGMP 水平呈正相关关系。采用酶标仪于波长450 nm 处检测吸光度(A)值。以A 值代表各组大鼠血清中CD4、CD8、cAMP 和cGMP 水平。
1.8 转录组学检测大鼠差异表达基因组织样品制备:取3 组大鼠肝组织样品放入离心管中,用液氮速冻,-80 ℃冰箱冻存。采用Quibt RNA 试剂盒对肝组织中总RNA (Total RNA)定量,依据RIN≥7,28S 和18S 的RNA 比值≥1.5∶1,采用Agilent 2100 检测RNA 完整性,选取质控合格的RNA 用于后续分析。建库:经mRNA 纯化和片段化、一链合成、二链合成、末端修复和加dA 尾、Adaptor 连接、PCR 扩增及PCR 产物质控后混合文库。测序:采用illumina 测序平台检测获取原始基因序列,再经过滤和统计后得到用于后续分析的基因序列,将得到的基因序列与参考基因序列比对、分类、组装和定量。采用DESeq 软件计算模型组与空白组和模型组与药物佐证组组间差异表达情况,将差异倍数|log2FC|≥1 且显著性水平P≤0.05的基因判定为差异表达基因,组间的差异基因分布情况以火山图表示。
1.9 统计学分析采用SPSS 22.0 统计软件进行统计学分析。各组大鼠精神状态评分、运动评分、体质量、进食量、饮水量、足温、抓力、脉搏幅度、呼吸频率、舌象积分、FBG 和血清中TC、TG、LDL-c、HDL-c、CD4、CD8、cAMP 及cGMP 水平均符合正态分布,以±s 表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用两独立样本LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠一般状态指标在第21 周时,与空白组比较,模型组大鼠体质量明显降低(P<0.01),进食量、饮水量和足温明显升高(P<0.01),精神状态评分、运动评分和舌象积分明显升高(P<0.05 或P<0.01),抓力和脉搏幅度明显减小(P<0.01),呼吸频率差异无统计学意义(P>0.05)。与模型组比较,药物佐证组大鼠体质量、进食量和饮水量差异无统计学意义(P>0.05),精神状态评分、运动评分和舌象积分明显降低(P<0.05 或P<0.01),足温明显降低 (P<0.01),抓力和脉搏幅度明显增大(P<0.01),呼吸频率有升高趋势,但差异无统计学意义(P>0.05)。见表1~4。
表1 各组大鼠体质量Tab.1 Body masses of rats in various groups( ±s,m/g)

表1 各组大鼠体质量Tab.1 Body masses of rats in various groups( ±s,m/g)
*P<0.05,**P<0.01 vs blank group.
Group n Body mass 21 612.71±62.93 462.57±73.30**486.79±67.55(week) 1 254.09±9.32 255.14±14.65 246.83±9.56 5 9 Blank Model Drug evidence 18 14 17 463.67±40.55 424.60±39.23*435.32±28.63 519.73±48.51 436.36±53.88**440.85±46.28 13 555.86±65.17 447.32±63.67**467.01±56.26 17 599.91±62.44 460.39±72.43**471.45±61.51
表2 各组大鼠日进食量和饮水量Tab.2 Daily food intakes and water intakes of rats in various groups(±s)
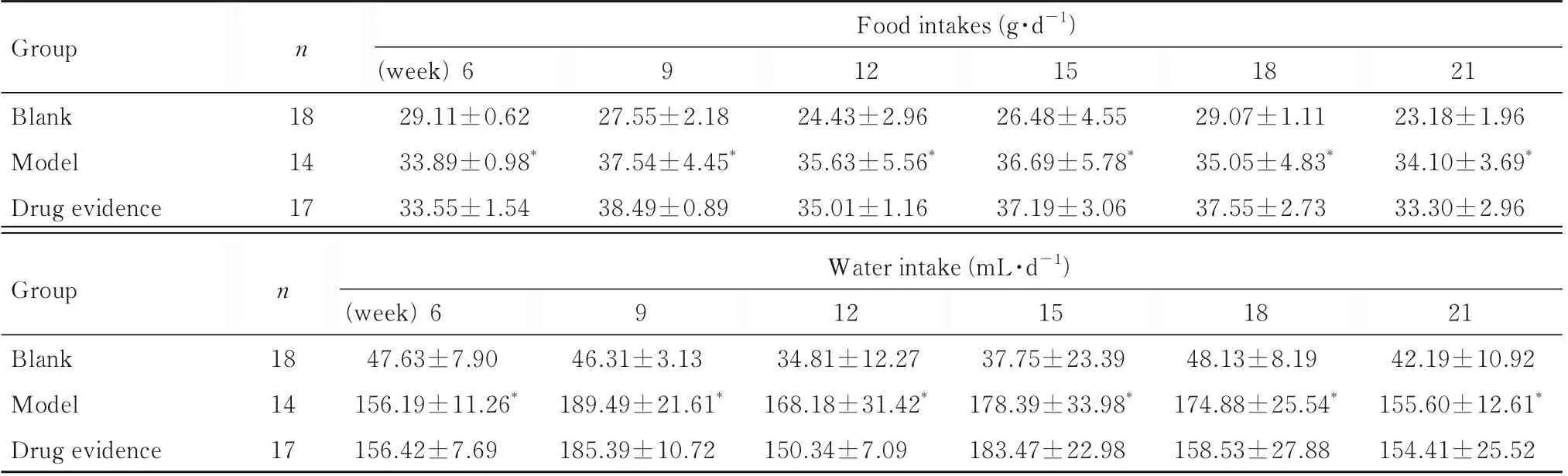
表2 各组大鼠日进食量和饮水量Tab.2 Daily food intakes and water intakes of rats in various groups(±s)
*P<0.01 vs blank group.
Group n Food intakes (g·d-1)9 Blank Model Drug evidence 18 14 17(week) 6 29.11±0.62 33.89±0.98*33.55±1.54 27.55±2.18 37.54±4.45*38.49±0.89 12 24.43±2.96 35.63±5.56*35.01±1.16 15 26.48±4.55 36.69±5.78*37.19±3.06 18 29.07±1.11 35.05±4.83*37.55±2.73 21 23.18±1.96 34.10±3.69*33.30±2.96 Group n Water intake (mL·d-1)21 42.19±10.92 155.60±12.61*154.41±25.52 18 14 17 9 Blank Model Drug evidence(week) 6 47.63±7.90 156.19±11.26*156.42±7.69 46.31±3.13 189.49±21.61*185.39±10.72 12 34.81±12.27 168.18±31.42*150.34±7.09 15 37.75±23.39 178.39±33.98*183.47±22.98 18 48.13±8.19 174.88±25.54*158.53±27.88
表3 各组大鼠精神状态评分、运动评分、足温、抓力、呼吸频率和脉搏幅度Tab.3 Mental state scores, sport scores, foot temperatures, griping force, respiratory rates,and pulse amplitudes of rats in various groups(±s)

表3 各组大鼠精神状态评分、运动评分、足温、抓力、呼吸频率和脉搏幅度Tab.3 Mental state scores, sport scores, foot temperatures, griping force, respiratory rates,and pulse amplitudes of rats in various groups(±s)
*P<0.01 vs blank group;△P<0.05,△△P<0.01 vs model group.
Group n Mental state score(week) 21 0.11±0.32 1.86±0.36*1.41±0.51△Griping force(m·g-1)Sport score 21 0.11±0.32 1.93±0.27*1.35±0.49△△Foot temperature(θ/℃)0 32.47±3.27 30.76±1.36 31.10±1.51 0 Blank Model Drug evidence 18 14 17 21 29.92±1.36 31.88±1.94*29.53±1.51△△21 1 994.56±1.39 1 590.20±78.57*1 722.35±101.37△△Group n Blank Model Drug evidence Respiratory rate (times·min-1)(week) 0 96.04±12.90 94.49±17.82 102.19±18.84 21 0.018±0.006 0.008±0.003*0.017±0.011△△18 14 17 21 97.23±19.29 95.54±20.96 108.65±20.34 1 136.96±118.12 1 123.04±106.44 1 117.39±122.89 Pulse amplitude(U·V-1)0 0.013±0.005 0.014±0.005 0.021±0.017
表4 各组大鼠舌象积分Tab.4 Tongue image integral of rats in various groups(±s)

表4 各组大鼠舌象积分Tab.4 Tongue image integral of rats in various groups(±s)
*P<0.05,**P<0.01 vs blank group;△P<0.01 vs model group.
Group Blank Model Drug evidence Blue 27.00±2.41 38.15±5.97**21.71±6.15△n 18 14 17 Red 88.90±5.19 98.86±9.47*82.67±4.51△Green 22.38±6.76 30.53±6.93*13.87±6.02△
2.2 各组大鼠FBG水平和血清中TC、TG、LDL-c及HDL-c 水平与空白组比较,模型组大鼠FBG 水平和血清中TC、TG 及LDL-c 水平明显升高(P<0.01),HDL-c 水平差异无统计学意义(P>0.05);与模型组比较,药物佐证组大鼠FBG 水平和血清中TC、TG、LDL-c 及HDL-c 水平差异均无统计学意义(P>0.05)。见表5 和6。
表5 各组大鼠FBG 水平Tab.5 FBG levels of rats in various groups[±s,сB/(mmol·L-1)]

表5 各组大鼠FBG 水平Tab.5 FBG levels of rats in various groups[±s,сB/(mmol·L-1)]
*P<0.01 vs blank group.
Group n Blank Model Drug evidence Fasting blood glucose(week) 0 4.12±0.48 4.16±0.44 4.10±0.42 21 5.46±0.44 20.09±5.36*17.61±3.77 18 14 17
表6 各组大鼠血清中TC、TG、LDL-c 和HDL-c 水平Tab.6 Levels of TC, TG, LDL-c, and HDL-c in serum of rats in various groups [±s,сB/(mmol·L-1)]
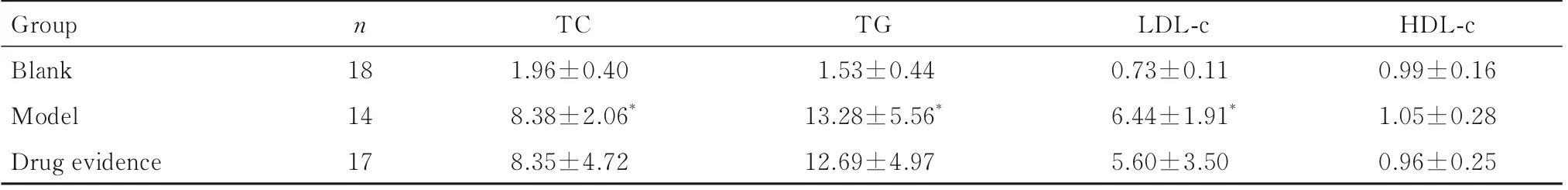
表6 各组大鼠血清中TC、TG、LDL-c 和HDL-c 水平Tab.6 Levels of TC, TG, LDL-c, and HDL-c in serum of rats in various groups [±s,сB/(mmol·L-1)]
*P<0.01 vs blank group.
Group Blank Model Drug evidence HDL-c 0.99±0.16 1.05±0.28 0.96±0.25 n 18 14 17 TC 1.96±0.40 8.38±2.06*8.35±4.72 TG 1.53±0.44 13.28±5.56*12.69±4.97 LDL-c 0.73±0.11 6.44±1.91*5.60±3.50
2.3 各组大鼠血清中CD4、CD8、cAMP 和cGMP水平与空白组比较,模型组大鼠血清中CD4 水平和CD4/CD8 比值均明显降低(P<0.01),CD8水平差异无统计学意义(P>0.05),cAMP 水平及cAMP/cGMP 比值均明显升高(P<0.01),cGMP水平明显降低(P<0.01);与模型组比较,药物佐证组大鼠血清中CD4 水平及CD4/CD8 比值均明显升高(P<0.01),CD8 和cAMP 水平差异无统计学意义(P>0.05),cGMP 水平明显升高(P<0.01),cAMP/cGMP 比值明显降低(P<0.01)。见表7。
表7 各组大鼠血清中CD4、CD8、cAMP 和cGMP 水平及CD4/CD8 和cAMP/cGMP 比值Tab.7 Levels of CD4,CD8,cAMP,cGMP, and CD4/CD8 and cAMP/cGMP in serum of rats in various groups(n=8,±s)

表7 各组大鼠血清中CD4、CD8、cAMP 和cGMP 水平及CD4/CD8 和cAMP/cGMP 比值Tab.7 Levels of CD4,CD8,cAMP,cGMP, and CD4/CD8 and cAMP/cGMP in serum of rats in various groups(n=8,±s)
*P<0.01 vs blank group;△P<0.01 vs model group.
Group CD4/CD8 cAMP/cGMP Blank Model Drug evidence CD4[ρB/(μg·L-1)]85.88±11.78 66.25±10.15*84.34±10.25△CD8[ρB/(μg·L-1)]47.05±6.82 42.03±3.51 41.40±4.78 0.13±0.01 0.22±0.03*0.15±0.01△1.83±0.17 1.57±0.18*2.04±0.20△cAMP[сB/nmol·L-1)]12.18±1.85 14.67±0.83*13.96±1.33 cGMP[сB/nmol·L-1)]92.35±17.15 68.98±9.14*91.18±8.78△
2.4 各组大鼠差异表达基因与空白组比较,模型组大鼠差异表达基因共922 个,上调基因520 个(红色),下调基因402 个(绿色)。见图1A。与模型组比较,药物佐证组大鼠差异表达基因共136 个,上调基因68 个(红色),下调基因68 个(绿色)。见图1B。
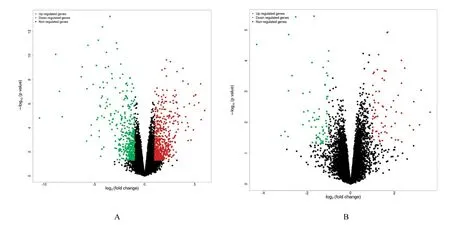
图1 各组大鼠差异表达基因Fig.1 Differential expressed genes of rats in various groups
与空白组比较,模型组大鼠有520 个上调差异表达基因,其中涉及代谢的基因为早期生长应答因子2(early growth response factor 2,Egr2),参与细胞增殖和免疫调节的基因有Ppp2r2b、胰岛素样生长因子结合蛋白1 (insulin-like growth factor binding protein 1,Igfbp1)、血小板反应蛋白解整合素金属肽酶4 (a disintegrin and metallopeptidase with thrombospondin motfis 4,Adamts4)、Rgs16、Gadd45b、Rasgef1b、Egr2、Fosb、Slc25a22、Bcl6 和Wfdc6a,目前生物学过程不明确的基因有AABR07065768.3、AABR07027447.1、AABR07051548.2、AABR07061134.1、RF00100、AABR07065782.1、LOC100911994、Serhl2、AABR07065750.3、RF00560、AABR07051716.2、RF00405、RF00026、AABR07029863.2 和RF00398,药物佐证组有27 个下调基因。见表8。与空白组比较,模型组大鼠有402 个下调表达基因,其中涉及代谢的基因有G0/G1开关2(G0/G1swich 2,G0s2)、中线1 相互作用蛋白 1 (midline 1 interaction protein 1,Mid1ip1)、Angptl8 和Fgf21,参与细胞增殖和免疫调节的基因有螺旋-环-螺旋家族成员e40 (basic helix-1oop-helix familye 40,Bhlhe40)、Irx5、Ier5、Mdk、Hyls1、Spata2L 和Rpp3,目前生物过程不明确的基因有RF00420、Mir3554、RF00425、RF00601、RF00019 和RF00026,药物佐证组有17 个上调基因。见表9。
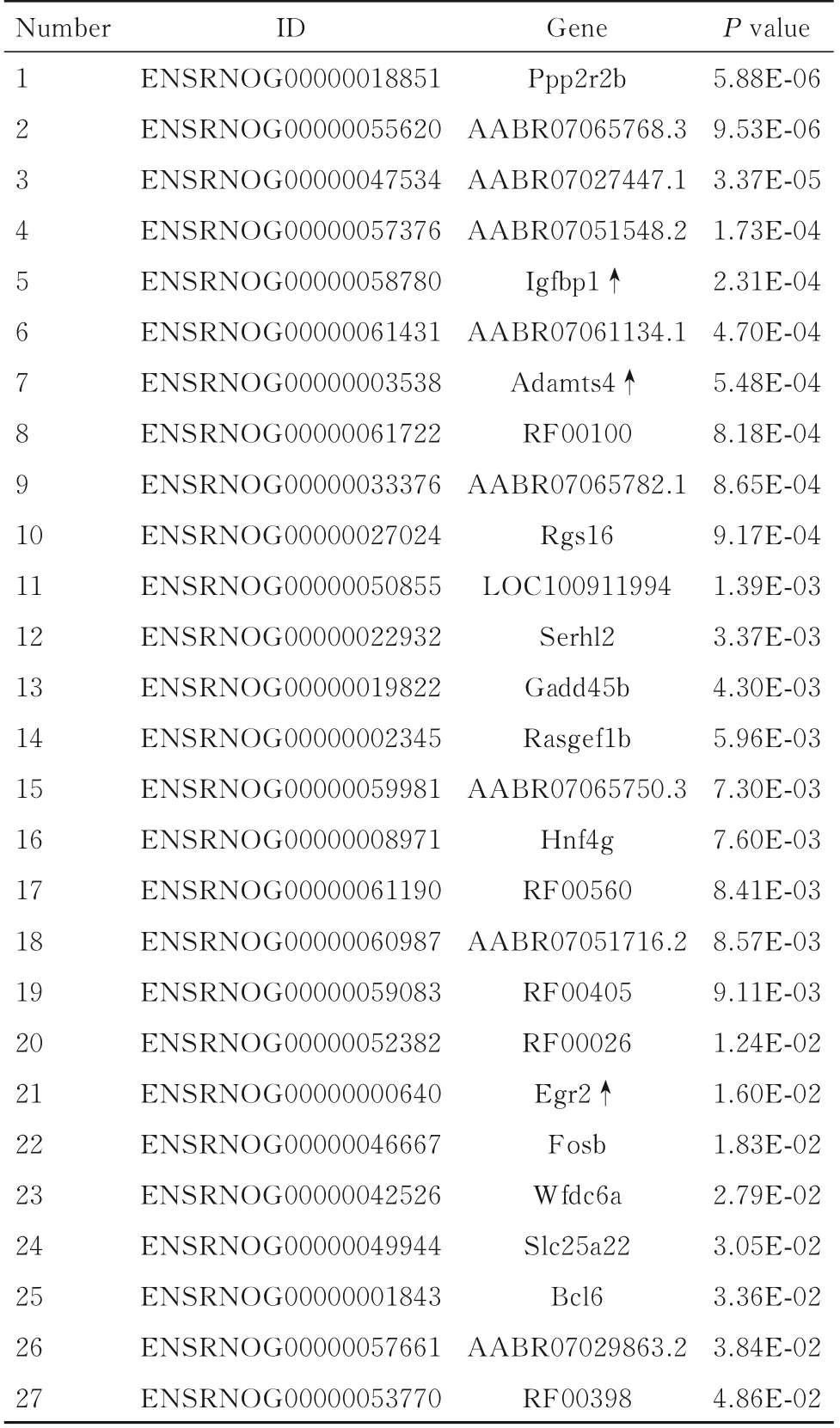
表8 模型组大鼠差异表达基因Tab.8 Differential expressed genes in model group
3 讨 论
病证结合是传统医学诊疗疾病常采用的模式,也是证候本质研究的重要方法。病证结合动物模型是探索中医理论的载体,对于探讨疾病病理变化和中医证候特征具有较大优势。因此,建立符合临床特点的病证结合动物模型和评价标准并结合现代技术探寻证候机制,能够为丰富中医证候的现代化研究提供更多的理论依据。
传统医学将糖尿病归类于“消渴病”,糖尿病患者多见气阴两虚,基本病机为阴津亏损,燥热偏盛,阴虚日久,伤津耗气,而致气阴两虚[7-8]。消渴灵具有益气养阴、生津止渴和益气降糖的功效,可用于改善气阴两虚型2 型糖尿病患者的证候表现。本研究结果显示:与空白组比较,模型组大鼠出现精神萎靡、倦怠乏力、消瘦、渴而多饮、烦热、饥而欲食及舌质红脉虚弱的表现;药物佐证组大鼠灌胃21 周后,与模型组比较,其精神状态有所好转,倦怠乏力和舌质红脉虚弱症状明显改善,证实模型组从生理特征方面基本体现了气阴两虚型2 型糖尿患者的临床特点。
机体证候变化时,除生理指标外,生化指标也会出现变化。CD4 和CD8 水平是反映气虚证候的重要标志[9-10]。本研究结果显示:与空白组比较,模型组大鼠血清中CD4 水平降低,在佐证药消渴灵干预后模型组大鼠CD4 水平升高,表明模型组大鼠证候表现与免疫功能低下有关。环核苷酸cAMP 和cGMP 是相互拮抗的2 种物质,为生物体内的第二信使,共同调控机体能量代谢水平[11]。当机体出现阴虚表现时,cAMP 水平升高,cAMP/cGMP 比值升高,因此二者常作为反映阴虚的重要指标[12-14]。研究[15]表明:cAMP 通过蛋白激酶A(protein kinase A,PKA)信号促进糖异生相关蛋白磷酸化,促进糖异生。本研究结果显示:与空白组比较,模型组大鼠FBG 水平和血清中cAMP 水平及cAMP/cGMP 比值升高,cGMP 水平降低,TC、TG 和LDL-c 水平升高,表明模型组大鼠出现了糖脂代谢异常,结合上述消瘦及渴而多饮等生理表现,大鼠反映出糖尿病的状态;药物佐证组大鼠灌胃21 周后,与模型组比较,药物佐证组大鼠血清中cGMP 水平升高,cAMP/cGMP 比值降低,内分泌功能的失衡得以改善。进一步证实模型组动物状态基本体现了气阴两虚型2 型糖尿病的证候特点。
肝脏是机体物质代谢枢纽,是机体的主要代谢器官[16]。本研究结果显示:与空白组比较,模型组大鼠主要上调表达基因有Igfbp1、Adamts4 和Egr2 等,主要下调表达基因有Bhlhe40、Mid1ip1和G0s2 等。其中Igfbp1 在自身性免疫疾病中高表达,还可通过肿瘤坏死因子α (tumor necrosis factor-α,TNF-α)刺激Igfbp1 与胰岛素样生长因子1 (insulin-like growth factor-1,IGF-1)结合,导致B 淋巴细胞增殖分化受限,降低机体免疫力[17-18]。Adamts4 可增加肿瘤细胞的浸润程度进而使肿瘤发生迁移,而肿瘤的发生发展多伴随机体免疫功能异常,即免疫力下降[19-20]。研究[21]显示:Igfbp1 除参与免疫调节外,对机体葡萄糖稳态的调节也起重要作用,Igfbp1 过表达能够抑制IGF-1 的降糖作用使FBG 水平升高;Mid1ip1 是由碳水化合物反应元件结合蛋白调节葡萄糖反应的基因之一,并且通过负调控AMP 活化蛋白激酶(AMPactivated protein kinase,AMPK)减少脂质的沉积[22-23];G0s2 对脂质降解具有抑制作用[24];Egr2表达上调可促进脂质沉积[25-26]。本研究结果显示:模型组大鼠血糖和血脂水平升高,可能与上述基因水平的变化有关联,表明气阴两虚型2 型糖尿病大鼠模型的证候表现也体现在机体的代谢紊乱。本研究结果表明:佐证药消渴灵对气阴两虚型2 型糖尿病大鼠模型的证候生理体征表现及免疫功能的改善明显,对能量代谢指标cAMP 和cGMP 水平也有一定调控作用,但对血糖和血脂水平改变效果不明显。提示中药对疾病的治疗多体现在整体宏观的调节,增加机体对疾病的抵抗能力。
综上所述,气阴两虚型2 型糖尿病病证结合大鼠模型的证候表现可能与Egr2、Igfbp1 和Adamts4基因上调及G0s2、Mid1ip1 和Bhlhe40 基因下调有关联。

