依达拉奉右莰醇联合rt-PA静脉溶栓治疗超早期急性脑梗死的疗效及对预后的影响
聂亚蒙,张小强,冯鹏展,丁雅倩
急性脑梗死(acute cerebral infarction,ACI)致残率和病死率高,好发于中老年人群,近年来其发病率升高并有年轻化趋势,病理机制与动脉粥样硬化、血栓形成等所致脑供血、供氧不足而造成脑组织坏死有关[1]。研究显示,ACI 后约有65%患者伴有严重神经系统功能损伤,对患者生存质量造成严重影响,早期救治十分重要[2]。早期溶栓治疗是ACI的有效方案,利于患者脑组织血流灌注的恢复,对改善脑组织损伤有明显作用。重组组织型纤溶酶原激活剂(recombinant tissue plasminogen activator,rt-PA)为临床常用溶栓剂,但其会增加脑出血风险,临床应用有一定局限性[3]。依达拉奉右莰醇属于一种新型神经保护剂,其中右莰醇是一种从传统中药天然冰片中提取的小分子物质,有明显的抗炎和神经保护等功效[4]。邹娜等[5]研究显示在ACI治疗中,依达拉奉右莰醇有较好的远期疗效和安全性。本研究旨在进一步探究依达拉奉右莰醇联合rt-PA 静脉溶栓治疗超早期(发病至就诊时间≤4.5 h)ACI 的疗效及预后,为ACI患者有效救治提供更多参考。
1 对象与方法
1.1 研究对象
选取2020 年11 月—2021 年11 月蒙城县第一人民医院收治的163 例ACI 患者为研究对象。纳入标准:经头颅CT/MRI 检查符合《中国各类主要脑血管病诊断要点2019》中有关ACI 诊断标准;年龄≥18 岁;有溶栓治疗适应证,发病至就诊时间≤4.5 h;无非缺血性病因,脑CT/MRI检查示无脑出血;无溶栓禁忌证。排除标准:既往脑出血病史;入组前3个月有脑卒中或严重颅脑外伤、颅脑手术史;近期有活动性内脏出血;凝血功能异常;合并心、肝、肾等重要脏器功能损害;溶栓后曾行桥接治疗者;同时参与其他临床研究;服药依从性不高;研究期间出现药物不良反应而终止实验者;治疗期间死亡。采用随机投掷法分为联合用药组(依达拉奉右莰醇联合rt-PA静脉溶栓治疗)78例和对照组(rt-PA静脉溶栓治疗)85例。2 组性别、年龄、体质量指数(BMI)、发病至就诊时间和脑梗死部位比较差异无统计学意义(P>0.05),见表1。本研究通过本院医学伦理委员会批准(伦理批号:LL202010005)。

Tab.1 Comparison of general data between the two groups表1 2组一般资料比较
1.2 治疗方法
入组患者均给予他汀类药物治疗,同时对患者水电解质平衡、血压等进行纠正治疗,溶栓24 h 后头颅CT 示无出血,给予抗血小板聚集和活血化瘀药物治疗。对照组:静脉滴注rt-PA(国药准字SJ20160055,勃林格殷格翰药业有限公司,50 mg/支)0.9 mg/kg,最大剂量90 mg,1 min 内静脉注射10%阿替普酶,其余持续静脉滴注1 h。联合用药组:依达拉奉右莰醇联合rt-PA 静脉溶栓,rt-PA 静脉溶栓方法同对照组,溶栓治疗结束后给予依达拉奉右莰醇注射用浓溶液[国药准字H20200007,先声药业有限公司;5 mL/支;依达拉奉10 mg,右崁醇2.5 mg]30 mg 加入100 mL 生理盐水,静脉滴注,2 次/d,持续治疗2周。
1.3 观察指标
1.3.1 疗效评估
美国国立卫生院卒中量表(national institute of health stroke scale,NIHSS)评估患者神经功能缺损情况,计算疗效指数[6]。疗效指数=治疗前后NIHSS得分差值/治疗前NIHSS得分×100%。疗效指数90%~100%为痊愈,50%~89%为显效,15%~49%为有效,<15%为无效。总有效=痊愈+显效+有效。
1.3.2 氧化应激指标水平
治疗前1 d及治疗结束后次日早上8:00,抽取2 组患者外周静脉血5 mL,3 000 r/min 离心15 min,分离血清,比色法测定血清超氧化物歧化酶(superoxide dismutase,SOD)、活性氧(reactive oxygen species,ROS)水平,试剂盒购自武汉赛培生物科技有限公司;化学扩增法测定丙二醛(malondialdehyde,MDA)水平,试剂盒购自天津市灏洋生物制品科技有限责任公司。
1.3.3 神经损伤因子水平
采用双抗体夹心试剂盒(上海研域生物科技有限公司)检测血清神经元特异性烯醇化酶(neuron specific enolase,NSE)、基质金属蛋白酶(matrix metalloproteinase,MMP)-9、MMP-12、中枢神经特异性蛋白β(S100β)水平。
1.3.4 生化指标检测
治疗前后2组患者均进行常规检查,包含低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、总胆固醇(total cholesterol,TC)、肌酸激酶(creatine kinase,CK)、肌酸激酶同工酶(creatine kinase isoenzyme,CK-MB)、D-二聚体(Ddimer,D-D)、C反应蛋白(C-reactive protein,CRP)。
1.3.5 预后评估
于治疗前和治疗结束后采用NIHSS 评分评估患者神经功能缺损情况,得分0~42分,分数越高表示神经功能缺损越严重。采用改良Rankin 量表(modified rankin scale,mRS)[7]评估患者病情转归情况,得分0~6 分,分数越高表示病情越严重。采用日常生活活动能力(activities of daily living,ADL)评分[8]评估患者日常生活活动能力,包含10个项目,满分100分,分数越高表示患者生活能力越强。
1.3.6 病死率及不良反应
治疗结束后通过复诊或电话形式随访。统计2组治疗后3个月内死亡情况及皮肤瘙痒、胃肠不适、血小板减少、发热、皮疹等药物不良反应发生情况。
1.4 统计学方法
采用SPSS 24.0 软件进行数据分析。计数资料用例(%)表示,组间比较行χ2检验。组间疗效分级比较采用Wilcoxon秩和检验。符合正态分布的计量资料以±s表示,组间比较采用t检验,治疗前后比较用配对t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 2组疗效比较
联合用药组总有效率高于对照组(P<0.05),见表2。

Tab.2 Comparison of curative effect between the two groups表2 2组患者的疗效比较
2.2 2组治疗前后氧化应激指标水平变化
治疗后,2 组SOD 较治疗前升高且联合用药组高于对照组(P<0.01);2 组ROS、MDA 较治疗前降低且联合用药组低于对照组(P<0.01),见表3。
Tab.3 Changes of oxidative stress indicators before and after treatment in the two groups表3 2组治疗前后氧化应激指标水平变化(±s)

Tab.3 Changes of oxidative stress indicators before and after treatment in the two groups表3 2组治疗前后氧化应激指标水平变化(±s)
**P<0.01。
组别对照组联合用药组t n 85 78 SOD/(U/mL)治疗前35.45±3.65 34.23±4.85 1.799治疗后52.51±4.57 64.21±6.38 13.347**t 25.671**34.045**组别对照组联合用药组t ROS/(µmol/L)治疗前640.17±65.15 632.14±78.61 0.707治疗后518.47±53.68 432.72±45.27 10.974**t 13.364**18.359**组别对照组联合用药组t MDA/(µmol/L)治疗前4.08±0.97 4.07±1.04 0.029治疗后3.31±1.06 1.29±0.78 13.893**t 4.920**19.530**
2.3 2组治疗前后神经损伤因子指标变化
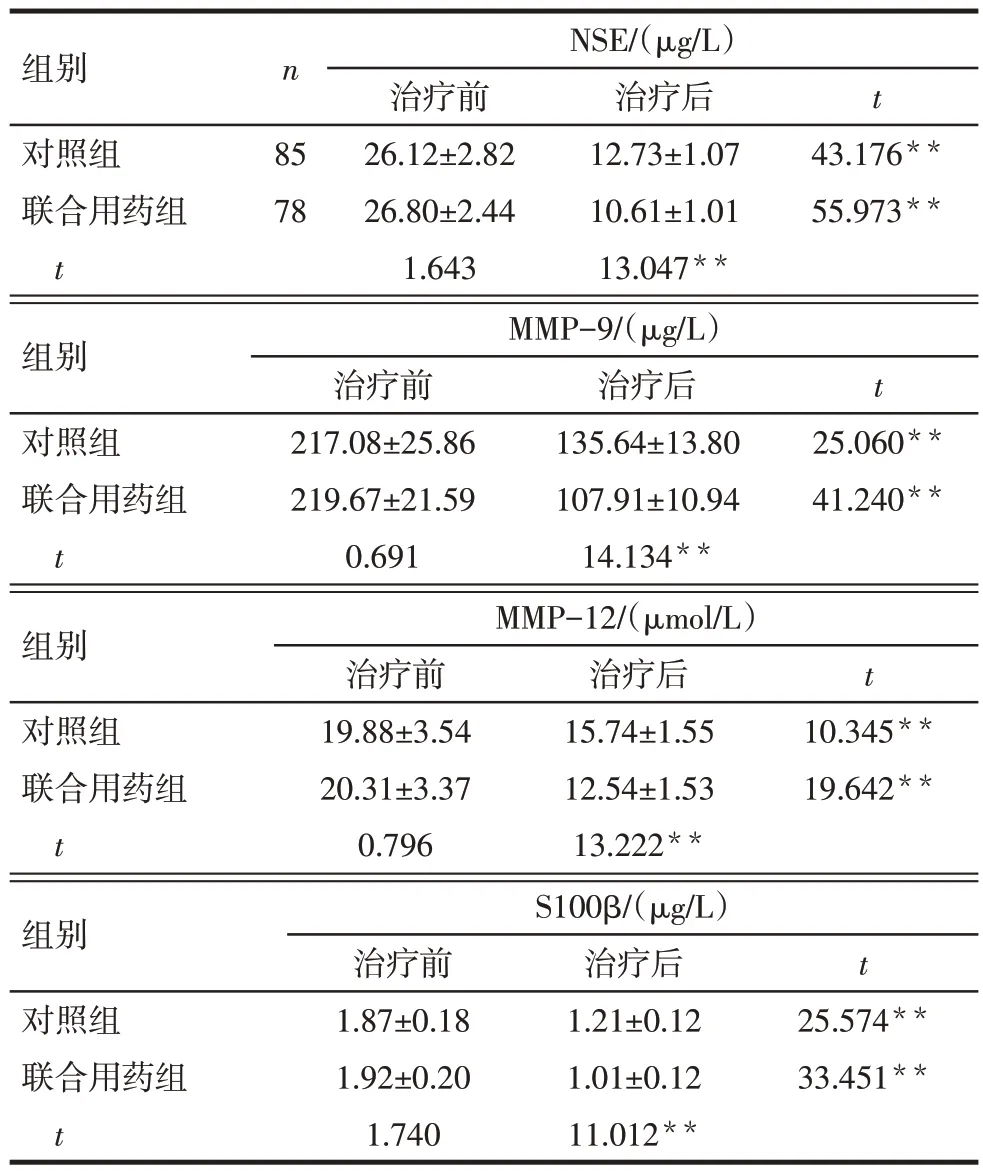
治疗后,2组NSE、MMP-9、MMP-12、S100β较治疗前降低,联合用药组低于对照组(P<0.01),见表4。
Tab.4 Changes of inflammatory factors before and after treatment in the two groups表4 2组治疗前后炎症因子指标变化(±s)
Tab.4 Changes of inflammatory factors before and after treatment in the two groups表4 2组治疗前后炎症因子指标变化(±s)
**P<0.01。
组别对照组联合用药组t n 85 78 NSE/(µg/L)治疗前26.12±2.82 26.80±2.44 1.643治疗后12.73±1.07 10.61±1.01 13.047**t 43.176**55.973**组别对照组联合用药组t MMP-12/(µmol/L)治疗前19.88±3.54 20.31±3.37 0.796治疗后15.74±1.55 12.54±1.53 13.222**t 10.345**19.642**组别对照组联合用药组t MMP-9/(µg/L)治疗前217.08±25.86 219.67±21.59 0.691治疗后135.64±13.80 107.91±10.94 14.134**t 25.060**41.240**组别对照组联合用药组t S100β/(µg/L)治疗前1.87±0.18 1.92±0.20 1.740治疗后1.21±0.12 1.01±0.12 11.012**t 25.574**33.451**
2.4 2组治疗前后生化指标变化
治疗后,2组LDL-C、TC、CK、CK-MB、D-D、CRP较治疗前降低,联合用药组各项指标低于对照组(P<0.01),见表5。
Tab.5 Changes of biochemical indicators before and after treatment in the two groups表5 2组治疗前后生化指标变化(±s)

Tab.5 Changes of biochemical indicators before and after treatment in the two groups表5 2组治疗前后生化指标变化(±s)
**P<0.01。
组别对照组联合用药组t n 85 78 LDL-C/(mmol/L)治疗前3.84±0.79 4.07±1.06 1.511治疗后2.35±0.59 1.84±0.50 5.901**t 13.235**16.819**TC/(mmol/L)治疗前4.25±0.54 4.33±0.47 0.964治疗后3.63±0.48 3.02±0.37 8.870**t 7.451**17.998**CK/(U/L)治疗前201.70±21.42 196.54±20.59 1.565治疗后183.77±19.57 164.56±18.76 6.389**t 5.485**10.105**组别对照组联合用药组t CK-MB/(U/L)治疗前15.78±2.04 16.23±1.67 1.551治疗后11.50±1.29 9.33±0.91 12.507**t 16.977**32.862**D-D/(mg/L)治疗前0.82±0.16 0.81±0.15 0.698治疗后0.61±0.12 0.42±0.09 11.010**t 10.485**18.187**CRP/(mg/L)治疗前10.47±1.44 10.43±1.35 0.178治疗后6.01±1.04 4.35±1.04 10.163**t 21.548**33.844**
2.5 2组治疗前后NIHSS、mRS、ADL评分比较
治疗后,2组NIHSS、mRS评分较治疗前降低,联合用药组低于对照组(P<0.01),2 组ADL 评分较治疗前升高,联合用药组高于对照组(P<0.01),见表6。
Tab.6 Comparison of NIHSS scores,mRS scores and ADL scores before and after treatment between the two groups表6 2组治疗前后NIHSS、mRS、ADL评分比较(分,±s)

Tab.6 Comparison of NIHSS scores,mRS scores and ADL scores before and after treatment between the two groups表6 2组治疗前后NIHSS、mRS、ADL评分比较(分,±s)
**P<0.01。
组别对照组联合用药组t n 85 78 NIHSS治疗前13.08±1.21 12.77±1.14 1.700治疗后9.31±1.11 6.59±0.96 16.619**t 20.397**36.151**mRS治疗前3.68±1.31 3.71±0.87 0.132治疗后2.98±0.74 2.18±0.62 7.425**t 4.286**12.791**ADL治疗前35.89±4.01 35.78±3.67 0.186治疗后47.69±4.56 53.46±5.15 7.584**t 16.797**25.019**
2.6 2组病死率和不良反应比较
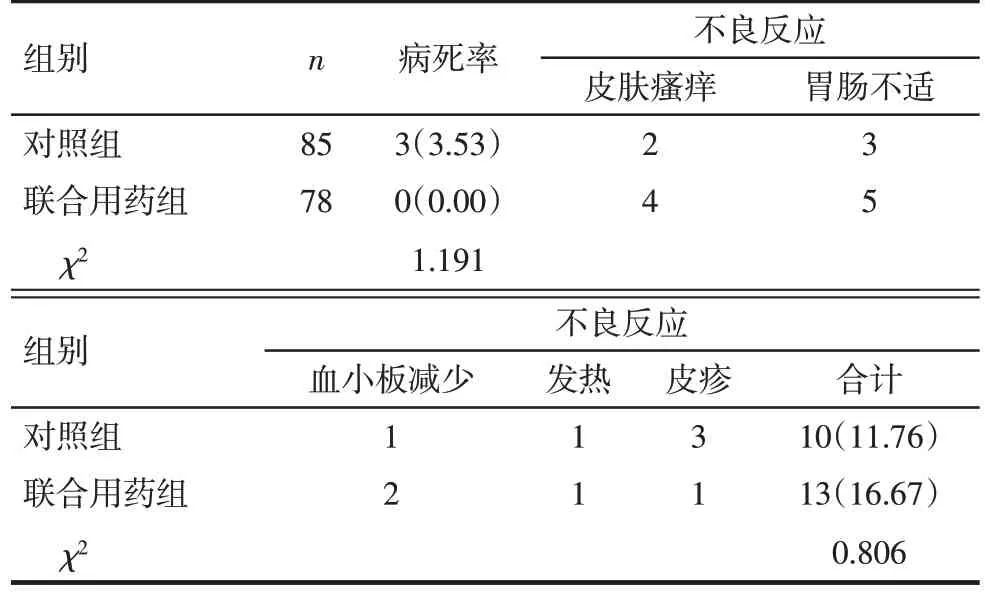
治疗后3个月内,2组病死率和不良反应反生率差异均无统计学意义(P>0.05),见表7。
Tab.7 Comparison of case fatality rate and adverse reactions between the two groups表7 2组病死率和不良反应比较
3 讨论
ACI 发病机制与脑缺血再灌注损伤、氧自由基损伤、炎性因子损害、血脑屏障功能通透性增加等有关[9]。研究表明,静脉溶栓治疗是ACI 患者的有效治疗方式,可取得良好的临床效果[10]。常用溶栓药物rt-PA已被证实可明显改善ACI患者临床疗效,但其在改善机体氧自由基损伤及炎性因子损害方面的效果并不明显[11]。王倩倩等[12]研究证实,依达拉奉右莰醇治疗ACI 的疗效明显,有较高安全性。姜飞等[13]研究显示,相较于单纯尿激酶溶栓治疗,依达拉奉右莰醇联合尿激酶静脉溶栓治疗ACI(发病至就诊时间<6 h)可明显改善患者机体氧化应激反应和脑部血流及颈动脉超声指标。本研究结果显示,治疗后联合用药组总有效率较对照组明显升高,提示依达拉奉右莰醇联合rt-PA 静脉溶栓可明显提高超早期ACI 患者的临床疗效。Qureshi 等[14]也证实了此点。考虑原因为,依达拉奉右莰醇作为一种脑保护剂,有脂溶性与水溶性,可透过血脑屏障,清除脑部组织的氧自由基,与rt-PA 静脉溶栓联合应用于超早期ACI 患者可发挥良好的协同作用,有效提高患者的临床治疗效果。
ACI 发病后,局部脑组织缺血损伤将引发一系列炎症反应及细胞凋亡反应,机体释放大量氧自由基、促炎因子等,导致脑组织损伤,影响患者预后[15-16]。本研究发现,治疗后联合用药组SOD 高于对照组,而MDA、ROS、NSE、MMP-9、MMP-12、S100β 蛋白低于对照组,证实联合用药可有效抑制超早期ACI 患者机体氧化应激反应,并发挥明显的脑神经保护作用。与姜飞等[13]报道不同的是,本研究对象为超早期(发病至就诊时间≤4.5 h)ACI患者,同时本研究还证实依达拉奉右莰醇联合rt-PA 提高超早期ACI患者治疗疗效的另一机制是抑制炎性细胞损害。依达拉奉作为一种强效羟自由基清除剂及抗氧化剂,被证实可抑制细胞膜脂质过氧化,保护血脑屏障的完整性,利于患者脑神经功能的修复[17-18]。近期报道发现,依达拉奉右莰醇可有效抑制脑缺血再灌注所致的炎症反应,其优势在于可快速高效到达靶组织,血脑屏障穿透率高,可更有效地抑制炎性细胞因子表达,阻止氧自由基与炎性细胞因子的相互作用,从而达到保护脑细胞的作用[19]。
研究表明,依达拉奉右莰醇在脑缺血损伤的多个阶段均发挥明显的脑神经保护作用[20]。动物模型实验证实,右莰醇可抑制炎性因子白细胞介素(IL)-1β、环加氧酶-2 等相关蛋白表达,预防脑组织损伤[21]。本研究亦发现,治疗后联合用药组LDL-C、TC、CK、CK-MB、D-D、CRP、NIHSS 评分、mRS 评分较对照组降低,ADL评分升高,初步证实两药联合还可有效调节患者血脂水平、减轻心肌损害和降低炎性因子水平,利于患者病情恢复。依达拉奉右莰醇联合rt-PA 静脉溶栓治疗超早期ACI 患者改善预后与其明显降低氧化应激损伤、炎症反应和脑神经保护作用密不可分。本研究结果显示,2 组不良反应发生率比较差异无统计学意义,表明依达拉奉右莰醇联合rt-PA 静脉溶栓治疗超早期ACI 患者安全性较好,考虑原因为通常超早期ACI 患者的病死率不会太高,而由于本研究的样本量有限,因而2组的病死率也无明显差异。
综上所述,本研究初步证实依达拉奉右莰醇联合rt-PA 静脉溶栓治疗超早期ACI 患者临床疗效明确,可抑制机体氧化应激损伤和炎症反应,利于患者脑神经功能的恢复和预后的改善,安全性高,值得临床应用推广,但本研究尚未明确该方案对患者远期预后的影响,后期还需进一步完善研究。

