肌萎缩侧索硬化患者临床特征分析
刘宇飞,朱炬,刘娜,任艳苹,孙晓慧,田丽,张哲成
肌萎缩侧索硬化(amyotrophic lateral sclerosis,ALS)是一种选择性侵犯上下运动神经元的神经系统变性疾病,临床表现为进行性发展的骨骼肌无力、萎缩、肌束颤动、延髓麻痹和锥体束征[1],累及呼吸肌可直接影响呼吸功能,呼吸衰竭是导致死亡的直接原因。目前对于其病因及发病机制尚不清楚,也无特效治疗办法。受ALS的异质性及不同表型的影响,5%~10%的ALS患者生存可超过10年,但大多仅为3~5 年。由于该病早期识别困难,诊断主要依据临床症状、体征、电生理检查及排除诊断,故容易出现误诊、误治[2]。本研究通过分析110例ALS患者的临床特点,以期提高临床医师对ALS 的认识和积极治疗。
1 对象与方法
1.1 研究对象
收集2019年1月—2022年10月于天津市第三中心医院神经内科门诊及住院的ALS患者资料,选取具有完整病历记录的110 例作为研究对象。依据修正后EI Escorial 标准诊断[3],诊断级别分别为确诊、拟诊及可能的ALS。110例患者中,男62 例,女48 例,男女比例1.3∶1,起病年龄24~80 岁,中位起病年龄60岁。本研究经医院伦理委员会审核通过,所有患者均签署知情同意书。
1.2 研究方案
所有纳入研究的ALS患者均完成ALS临床信息登记,包括基本信息、起病部位、诊断过程、修订版ALS 功能评分(ALS functional rating scale revised,ALSFRS-R)、电生理及肺功能检查结果。利用ΔFS 来评估疾病进展速率,ΔFS=(48-ALSFRS-R得分)/诊断延迟时间(月)。本研究依据ALS患者首次就诊时的疾病进展特点分成快速进展型(ΔFS≥1.0 分/月)、中速进展型(0.5 分/月≤ΔFS<1.0 分/月)和慢速进展型(ΔFS<0.5 分/月)[4]。诊断延迟时间指发病至首次确诊ALS时间。
1.3 随访
每3~6 个月由我科ALS 专病医生对患者进行电话或门诊随访,记录患者病情变化、无创正压通气(non invasive positive pressure ventilation,NIPPV)、胃管、经皮胃造瘘术(percutaneous endoscopic gastrostomy,PEG)的应用及利鲁唑治疗情况等。随访至2023年3月1日,患者死亡或有创呼吸机辅助呼吸视为终点事件。如果患者失访、非自然病程死亡和超过观察时间仍存活,视为截尾数据。
1.4 统计学方法
采用SPSS 27.0进行数据分析。计数资料以例(%)表示,组间比较采用χ2检验。符合正态分布的计量资料以均数±标准差(±s)表示,2 组间比较采用独立样本t检验。非正态分布的计量资料以中位数和四分位数[M(P25,P75)]表示,组间比较采用秩和检验。用Kaplan-Meier 法绘制生存曲线。以P<0.05为差异有统计学意义。
2 结果
2.1 起病部位
ALS 患者中,肢体起病者90 例(81.8%),球部起病者20 例(18.2%)。肢体起病者中,单上肢起病者50 例(45.5%),单下肢起病者26 例(23.6%),双上肢起病者5 例(4.5%),双下肢起病者9 例(8.2%)。球部起病患者的中位年龄大于肢体起病患者[63岁vs.60岁,Z=2.030,P<0.05]。
2.2 诊断情况
110 例患者确诊58 例(52.7%),拟诊35 例(31.8%),可能17例(15.5%)。患者总体诊断延迟时间12(7,20)个月,女性中位诊断延迟时间长于男性(15 个月vs.12 个月,Z=2.030,P<0.05)。球部与肢体的诊断延迟时间比较差异无统计学意义(11.5 个月vs.12个月,Z=0.206,P=0.830)。球部起病者的确诊及拟诊的比例[90%(18/20)]高于肢体起病者[83%(75/90),χ2=2.098,P<0.05]。男性的确诊及拟诊比例[87%(52/62)]与女性[85%(41/48)]比较差异无统计学意义(χ2=0.011,P>0.05)。
2.3 误诊情况
本组共74 例(81.3%)存在院前误诊,误诊间期为11(7,17)个月。其中男35例,女39例,误诊较多的为颈椎病24 例(32.4%)和腰椎病17 例(23.0%),其次为脑血管病11例(14.8%)。
2.4 不同疾病进展速度的ALS患者的临床特点
110 例患者ALSFRS-R 评分为39(36,45)分,ΔFS 为0.6(0.3,1.0)分/月。不同进展速度的ALS 患者起病年龄差异有统计学意义,快速进展型患者起病年龄大于中速及慢速进展型(P<0.01)。慢速进展型诊断延迟时间长于快速及中速进展型(P<0.01),不同疾病进展速度患者的性别、起病部位及诊断级别分布差异无统计学意义,见表1。
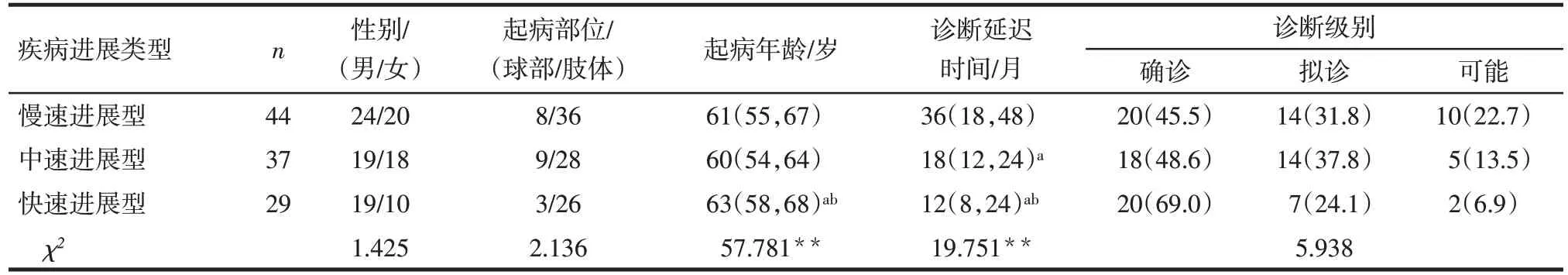
Tab.1 Comparison of clinical parameters between ALS patients with different rates of disease progression表1 不同进展速度的ALS患者临床参数比较
2.5 肌电图及肺功能检查结果
所有患者均在颅段、颈段、胸段及腰骶段4个不同节段进行肌电图检测。结果发现,66 例(60.0%)肌电图提示下运动神经元损害节段大于临床受累节段,24 例(21.8%)肌电图提示下运动神经元损害节段与临床受累节段完全相符,8 例(7.3%)患者部分相符,余12 例(10.9%)肌电图提示节段数小于临床受累节段。与临床诊断相比,行肌电图检查后共9例(8.2%)患者诊断级别有所提升(2 例由拟诊变为确诊,2例由可能变为确诊,5例由可能变为拟诊)。
在所有患者中,5 例患者因病情无法配合肺功能检查,15例患者检查结果缺失。余90例患者首次行肺功能检查结果发现,29例肺通气功能正常或小气道通气功能障碍,45 例为限制性功能障碍(轻度31.1%,中度17.8%,中重度24.4%,重度26.7%),9例为阻塞性通气功能障碍,7 例为混合性通气功能障碍。其中FVC<70%者16例(17.8%)。
2.6 随访情况
截至随访结束,110 例患者中死亡50 例(45.5%),失访13 例,存活47 例,中位生存时间44.0个月。47例存活患者中6例行NIPPV,4例鼻饲流质饮食,未见行PEG 的患者。94 例(85.6%)患者出院后口服利鲁唑治疗。Kaplan-Meier 分析结果显示,起病年龄≥60岁者的中位生存时间短于60岁以下者(36 个月vs.50 个月,Log-rankχ2=6.481,P<0.05),快速进展型患者的生存时间短于中速及慢速进展型(27个月vs.32个月vs.65个月,Log-rankχ2=21.820,P<0.01),见图1、2。
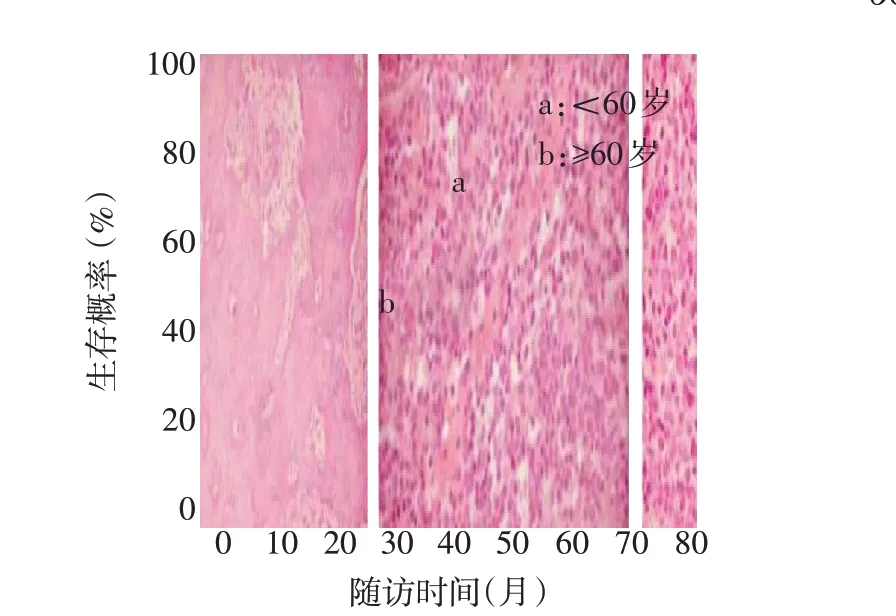
Fig.1 Survival curves of ALS patients at different ages图1 不同年龄ALS患者的生存曲线
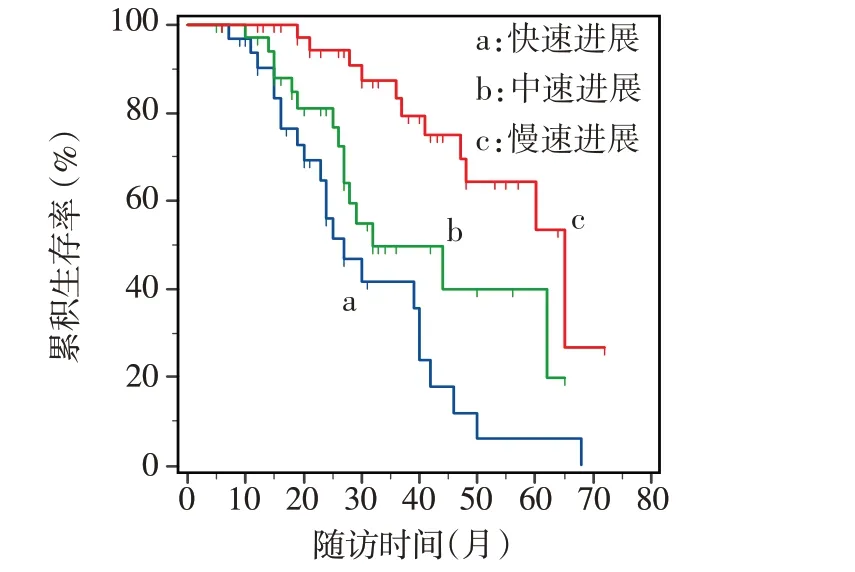
Fig.2 Survival curves of ALS patients with different rates of disease progression图2 不同进展速度ALS患者的生存曲线
3 讨论
本研究110 例ALS 患者中男女比例为1.3∶1,低于美国2022年的数据(1.73∶1)及我国樊东升团队的研究结果(1.7∶1)[6]。欧洲近年来研究数据显示患者男女比例下降为1.2∶1[7]。男性由于重体力劳作、吸烟等不良生活方式,以及与女性性激素水平的差异使得男女发病率存在明显不同;但近年来这种差异逐渐缩小,一方面可能与女性职业暴露机会的增多,使得生活及工作环境与男性无异;再者反映女性对于其自身健康状况的重视使得就诊率较前提高,且绝经后的女性发生ALS 的风险与男性无明显差异[8]。本研究中的ALS患者平均起病年龄较我国先前多中心调查研究[9]的52.4 岁大,更接近韩国2021年的研究[10]报告。对于起病年龄的增长,推测与生活水平、医疗条件等社会因素的提高及地域差异相关。也有研究发现糖尿病及高脂血症为ALS的保护因素[11]。近年来ALS的高发病率也可能在一定程度上推迟了其发病年龄[12],但80岁以后其发病率随着年龄增长而呈下降趋势[13]。
球部起病的ALS 一直都被认为与起病年龄晚,女性占比高及预后差相关[10],较肢体起病ALS 患者生存期可缩短约24 个月[14]。诊断延迟时间的延长与高龄、合并其他神经系统疾病、首诊非神经科、肢体起病型等因素相关[15]。国外流行病学显示,ALS平均诊断延迟时间从20 世纪90 年代的12~24 个月[16]缩短至21 世纪初的10~16 个月[17]。本研究中位诊断延迟时间为12 个月,与美国ALS 患者(11.5个月)[18]及我国西北地区的报道(11 个月)接近[19]。不同起病部位的诊断延迟时间并无差异,与国外研究结论相符[20],但也有结果发现球部起病者可明显缩短诊断延迟时间[17]。此外,本研究还发现女性患者的诊断延迟时间长于男性,与韩国先前报道相符[10],但较欧洲的统计结果存在差异[20],推测这种差异与入组患者的疾病进展速度、误诊情况、对疾病的重视程度、种族及地域等多因素相关。对于诊断级别为拟诊及可能的患者,往往预示着其较长的生存期。本研究结果提示球部起病的患者在诊断级别上高于肢体起病者,更加印证其进展迅速、不良预后的特点。
ALS 由于发病率低,临床表现存在明显的异质性,早期症状不典型等特点,造成了其较高的误诊率,既往国内外研究数据显示其误诊率为13%~72%[21-22]。超过50%的患者首诊是骨科,一定程度上造成了诊断的延迟及误诊的发生[17]。ALS院前误诊与起病部位关系密切,以单上肢及双侧上肢起病者,最常见的误诊疾病是颈椎病,以球部合并上肢、上下肢或四肢同时起病者最常误诊为脑血管病,以单一球部起病者则易被诊断为咽喉部疾病。5.8%~16.9%的患者因为误诊而接受了不必要的手术治疗[21,23-24];而手术又会造成其疾病进展速度的短期加快[22]。因此提高对该病的深刻认识,避免诊疗措施失当,以达到对患者早期诊断及早期治疗的目的。
在缺乏可靠的生物标志物的情况下,ALS 的诊断仍然依靠电生理检查,这一方面可以证实临床受累节段的下运动神经元损害,同时还可发现临床未累及区域的下运动神经元损害的证据,Awaji标准的提出提升了对于ALS诊断的敏感性[25]。上单位受累的节段数目对于生存期的预测没有帮助,而通过临床查体及电生理证实的不少于三段的下单位受累预示着更短的生存期[26]。笔者发现81.8%的患者电生理检查确认的下单位受累节段数大于等于临床评估的结果,8.2%的患者经电诊断评估后,诊断级别较前提升。Shayya等[27]同样发现,通过Awaji标准使得16.4%的患者在疾病早期诊断级别较前提升。因此正确评估下运动神经元的损伤,可以帮助早期诊断、临床分型、判断预后,对临床及科研均存在重大意义。
ALS 累及呼吸肌可直接影响呼吸功能,由呼吸道感染、吸入性肺炎或支气管阻塞引起的低通气伴随低氧血症和高碳酸血症是ALS患者最常见的死亡原因[28]。通气功能检测具有便捷、无创的特点,是反映ALS 患者生存和疾病进展的指标,被广泛用于临床决策中。本研究结果同样证实了ALS患者主要以限制性通气功能障碍为主。有学者认为ALS患者出现阻塞性肺通气功能障碍是由于随着病情进展反复出现的肺部感染以及呛咳、误吸和咳嗽无力引起分泌物清除困难所致[29]。随着疾病的进展,ALS 患者也会出现混合性通气功能障碍。球麻痹会使得面部肌肉无力、呼吸肌无力程度更重而无法配合完成肺功能检测,所以球部受累明显的患者反而无法纳入研究,进而推断ALS患者呼吸肌受累,呼吸功能实际的异常发生率应该更高。虽然NIPPV对于延长ALS患者存活时间,减慢呼吸功能恶化速度具有积极作用,但目前我国ALS 患者对于NIPPV 的使用率仅10%,远低于欧洲、美国及日本[6,30]。本研究随访的现存患者中也仅有12.7%应用NIPPV,而单就肺功能提示符合无创通气指征者近18%,足以证明NIPPV应用率的不足。PEG作为一种公认的营养不良的矫正方法,可有效延长ALS患者生存时间,但近30%患者拒绝接受[31],而在我国这项技术尚未普及,造成患者接受能力差,因此对该项技术的进一步研究及推广势在必行。而目前延缓ALS进展的主要药物利鲁唑由于费用高昂、购买不便等原因使患者的使用率偏低,我国不同地区应用利鲁唑的治疗率波动在13.8%~22.3%[18,32]。 Chen 等[12]研究发现2015—2018 年利鲁唑的使用率是2005—2009 年间的2.5倍。我院纳入研究患者中服药率为85.6%,这与人们对疾病不断提升的接受度与认知度,医务人员对于疾病的健康宣教力度密不可分。
ALS 的预后受多种因素的影响,欧洲多中心研究通过起病部位、起病年龄、诊断级别、诊断延迟时间、疾病进展率、额颞叶痴呆、肺功能等变量建模而评估预后[33]。本研究结果示起病年龄<60 岁ALS患者死亡风险低于起病年龄≥60 岁者,起病年龄为ALS预后的独立危险因素,发病年龄越大,生存时间越短,在国内外诸多研究中均得到相同结论[34]。通常认为球部起病患者预后较差,但除外孤立性球部表型的ALS[6,35]。也有研究发现肢体起病伴有吞咽障碍的患者同样预后不佳[36],推测球部受累影响患者营养状况而非起病部位的差异直接影响预后。笔者将在日后研究中进一步扩大样本量,延长随访时间的同时,也将是否存在球部受累而非球部起病纳入分析。本研究还发现疾病进展速率影响生存时间,诊断延迟时间和首诊时ALSFRS-R 评分均影响生存时间,两者计算得到的ΔFS 能更好地评估疾病发展和预后,进展快的患者往往预后更差[4]。笔者在对ΔFS 值进行分组,发现快速进展型的起病年龄更高,诊断延迟时间更短,出现不良结局的概率更高,反映了这些因素之间的交互关联。Westeneng等[33]研究结果显示诊断延迟时间越短,预后越差,可能与诊断延迟时间反映疾病进展率相关。
综上所述,本研究患者中以男性、肢体起病者占比较大,起病中位年龄60岁。球部起病者比肢体起病者的起病年龄要大,确诊及拟诊比例也要高。快速进展型患者以起病年龄大,诊断延迟时间短为特点。ALS由于诊断难度大,误诊率较高,最容易被误诊为颈椎病、腰椎病而延误诊疗。因此强化及提升临床医生对ALS 的认识是非常必要的,有利于实现ALS患者早期诊断及合理治疗。

