滇水金凤花距发育相关基因ABP的克隆及表达分析
魏春梅 孟丹晨 李凡 向南星 杨建园 黄美娟 黄海泉


摘 要: 為探究滇水金凤(Impatiens uliginosa)ABP基因的结构和表达特征,该研究以滇水金凤为材料,采用RT-PCR 技术对滇水金凤ABP基因进行克隆,运用DNAMAN和MEGA对其所编码的蛋白序列进行同源性分析和系统进化分析,并利用qRT-PCR分析ABP基因的时空表达模式。结果表明:(1)滇水金凤ABP基因的cDNA 全长为627 bp,编码208 aa,命名为IuABP基因,其蛋白具有Cupin超家族蛋白的典型结构。(2)同源性分析表明滇水金凤ABP基因的氨基酸序列与喜马拉雅凤仙花(I. glandulifera)、月季(Rose chinensis)、木薯(Manihot esculenta)等物种的同源性均达71%;系统进化分析表明IuABP与喜马拉雅凤仙花(Impatiens glandulifera)聚为一支,亲缘关系最近。(3)qRT-PCR分析表明IuABP基因在滇水金凤花距发育的3个时期及2个部位均有表达。随着花距的发育,IuABP基因在滇水金凤花距檐部的表达量呈先下降后上升的趋势,在盛花期时达最高,而在花距距部的表达量逐渐下降。以上结果为进一步研究滇水金凤ABP基因在花距发育中的功能及其表达调控机制提供了一定的理论参考。
关键词: 滇水金凤, 花距发育, ABP基因, 基因克隆, 表达分析
中图分类号: Q943 文献标识码: A 文章编号: 1000-3142(2023)06-1051-08
Cloning and expression analysis of ABP gene related to spur development in Impatiens uliginosa
WEI Chunmei, MENG Danchen, LI Fan, XIANG Nanxing, YANG Jianyuan, HUANG Meijuan, HUANG Haiquan*
( College of Landscape Architecture and Horticulture Sciences, Southwest Research Center for Engineering Technology of Landscape Architecture
(State Forestry and Grassland Administration), Yunnan Engineering Research Center for Functional Flower Resources and Industrialization,
Research and Development Center of Landscape Plants and Horticulture Flowers, Southwest Forestry University, Kunming 650224, China )
Abstract: The purpose of this study was to explore the structural and expression characteristics of ABP gene from Impatiens uliginosa. ABP gene related to spur development of I. uliginosa was cloned by using RT-PCR method, whose homology and phylogenetic analyses of protein sequence were analyzed by using DNAMAN and MEGA softwares. In addition, the spatiotemporal expression patterns of ABP gene were investigated by qRT-PCR method. The results were as follows: (1) ABP gene of I. uliginosa was successfully cloned, whose full-length cDNA sequences was 627 bp, encoding 208 aa, and named IuABP. The protein encoded by ABP gene had the typical structure of Cupin superfamily proteins. (2) According to the result of its homology analysis, it showed that the homology of ABP gene of I. uliginosa reached 71% with those of I. glandulifera, Rose chinensis and Manihot esculenta. Based on phylogenetic analysis, it was found that IuABP and Impatiens glandulifera clustered into a branch, with the most close genetic relationship. (3) qRT-PCR analysis showed that the IuABP were expressed in both three stages and two different parts of spur development of I. uliginosa. With the development of spur, the expression level of IuABP in the blade had a tendency of declining at the beginning and rising up later, and reached the highest in the blooming stage, while the expression level decreased gradually in the spur cup. These results provide a theoretical reference for further studies on the function and the expression regulation mechanism of IuABP gene in spur development.
Key words: Impatiens uliginosa, spur development, ABP gene, gene cloning, expression analysis
花距是植物进化的结果,它不仅能提高植物的传粉效率和繁殖成功率(童祯开等,2022),还造成某些植物发育谱系的迅速多样化(Hodges & Arnold, 1995),成为调节生物入侵的重要性状(Vervoort et al., 2011)。开展植物花距的研究,不仅能够判断物种形成和进化的机制,还能更加了解植物与传粉者个体之间的相互作用(Hodges et al., 2003;Fernández-Mazuecos & Glover, 2017)。Puzey等(2011)对耧斗菜花距组织和细胞水平进行观测,结果表明耧斗菜花距的伸长生长主要依赖于细胞的各向异性扩张。Mack和Davis(2015)对红排草(Centranthus ruber)的研究也发现其花距的伸长主要是通过表皮细胞的各向异性生长。然而,Tsai等(2018)对两种天竺葵属植物(Pelargonium ionidiflorum和P. odoratissimum)的花距研究发现,花托生长速度的加快和发育时间的延长是花距形成的主要原因;Cullen等(2018)认为细胞分裂是柳穿鱼属(Linaria)花距长度变化的主要原因,这与植物花距的伸长主要是通过细胞各向异性实现的观点形成鲜明对比。此外,研究还发现某些调控细胞分裂和伸长的基因也参与了花距发育的调控,如在耧斗菜花距杯中表达量较高的TCP、ARF6/8和BEH基因,通过VIGS病毒对其进行沉默后,花距杯内的细胞分裂与细胞扩张的平衡被扰乱,最终导致花距变短并且向内弯曲生长(Yant et al., 2015;Zhang et al., 2020;Stephanie et al., 2021)。綜上表明,植物花距的伸长生长不仅依赖于细胞分裂与细胞各向异性的扩张,而且花距发育相关基因ABP、TCP、ARF及BEH对花距的细胞分裂与伸长也起重要作用。
ABP(auxin binding protein)是一种生长素受体,包括ABPⅠ、ABPⅡ、ABPⅢ,以及生长素运输抑制剂NPA的结合蛋白4类,在植物体内广泛分布。ABP基因参与质膜上生长素的响应过程,还参与调控细胞扩增、细胞扩张以及细胞周期等快速反应(乔麟轶等,2012)。研究发现,ABP1基因在苎麻的幼茎和芽中大量表达;ABP1基因在玉米幼苗中表达较高,而在根内的表达较低;在烟草植物细胞生长比较活跃的时期,ABP1基因的表达量极高,而在细胞快结束分化时的表达较低,并且ABP基因在细胞中不同位置的分布存在较大的差异(高启祥等,2001;黄妤等,2008)。ABP基因不仅具有在植物生长较快的组织器官中表达量较高的特点,还能介导生长素诱导的细胞扩张,进而调控植株大小。在烟草中,诱导拟南芥ABP1基因过表达能够促进叶表皮细胞的扩张,组成型ABP1基因在玉米或烟草的悬浮细胞中,过表达ABP1基因能够正向调节细胞尺寸(Jones et al., 1998)。此外,对拟南芥组织叶片中的ABP1进行下调,能导致细胞的体积缩小(Braun et al., 2008);而当拟南芥胚中的ABP1基因缺失后,胚内细胞不能正常扩张且细胞直径均等(Chen et al., 2001)。由此发现ABP1基因在植物细胞分裂、细胞体积增大及分生组织伸长方面具有重要意义。
滇水金凤(Impatiens uliginosa)是凤仙花科(Balsaminaceae)凤仙花属(Impatiens)的一年或多年生植物,具有分布广、生长快、生物量大、周年开花、抗逆性强等特点,全草可入药,也可用于染指甲,是具有观赏、生态、药用以及经济价值的重要花卉材料(Luo et al., 2019)。滇水金凤作为观赏植物不仅具有花色多样、花形奇特的特点,其花距的长短、数量及颜色各异还具有很好的研究价值。迄今为止,国内外尚未见有关滇水金凤ABP基因的相关报道。因此,在滇水金凤中克隆ABP基因并分析其分子机制及表达特征,对深入研究其在花距发育中的调控机制具有重要意义。本研究在课题组前期滇水金凤转录组测序的基础上,对滇水金凤花距发育相关基因ABP进行克隆,借助在线软件与qRT-PCR分析,利用生物信息学方法,通过对ABP基因的进化关系、结构特征、组织表达等进行分析,拟探讨以下问题:(1)滇水金凤ABP蛋白亲缘进化关系;(2)该蛋白的基本理化性质和结构特征;(3)滇水金凤ABP基因在花距发育的不同时期和不同部位中的表达模式。
1 材料与方法
1.1 材料
材料为西南林业大学后山试验大棚的滇水金凤,采取其花苞期(S1)、始花期(S2)和盛花期(S3)的花距距部和花距檐部进行目的基因的qRT-PCR实验(图1)。
1.2 总RNA的提取与ABP基因的克隆
利用RNA提取试剂盒(OMEGA)提取滇水金凤花器官总RNA;根据逆转录试剂盒(全式金)将 RNA逆转录成cDNA,保存在-20 ℃条件下备用。
以滇水金凤转录组中的IuABP基因为依据,对引物进行设计,并送往生工合成。引物为IuABPF(5′-ATGTTGCGCCTCGTTTTC-3′)、IuABPR(5′-TTAATTGGTTCCTCCAAGAACACC-3′)。以滇水金凤花距的cDNA为模板进行ABP基因的cDNA扩增,扩增体系为20 μL,反应条件:95 ℃ 5 min;95 ℃ 5 s,56 ℃ 30 s,72 ℃ 48 s,35个循环;72 ℃ 10 min,4 ℃保存。PCR产物经回收纯化后,与载体pMD19-T连接,转化DH5α感受态细胞,最后挑选阳性菌液送生工测序。
1.3 滇水金凤ABP基因序列分析
运用ExPasy在线软件(https://web.expasy.org/protparam/)对滇水金凤IuABP基因的基本理化特性进行分析;借助SMART在线工具(http://smart.embl-heidelberg.de/)来预测IuABP基因结构域;运用Target P(https://services.healthtech.dtu.dk/service.php?TargetP-2.0)预测IuABP蛋白的亚细胞定位;借助SWISS-MODEL(https://swissmodel.expasy.org/interactive)预测IuABP蛋白的三维空间结构;利用DNAMAN v9.0对IuABP蛋白进行比对分析;运用MEGA-X软件的邻接法(Bootstrap= 1 000)进行系统进化分析。
1.4 滇水金凤ABP时空表达模式分析
分别提取滇水金凤3个时期(花苞期、始花期、盛花期)和2个部位(檐部和距部)花距器官的RNA,逆转录合成的cDNA备用。IuABP基因qRT-PCR引物为qABPF(5′-CGGGCTTTGTGGCTCAAT
AC3′)、qABPR(5′-TTCGCAAACAGCGCGAAATC′),内参基因为IuActin[ActinF(5′-TGAATGTCCCTGCT
GTTTG-3′)、ActinR (5′-ACCTTCCGCATAACTTTAC
C-3′)]。以3个时期的2个部位的cDNA为模板,借助Light Cycler 480 Ⅱ(Roche)实时定量PCR仪进行基因表达相对定量分析。反应体系为20 μL,反应程序为预变性95 ℃,5 min;变性95 ℃,10 s,退火60 ℃,20 s;延伸72 ℃,20 s,40个循环。每个样品进行3个重复,采用 2-△△Ct法计算。将盛花期花距距部定义为单位1作为对照,对IuABP基因在不同时期和不同部位的时空表达模式进行分析。
2 结果与分析
2.1 滇水金凤 ABP基因的克隆及序列分析
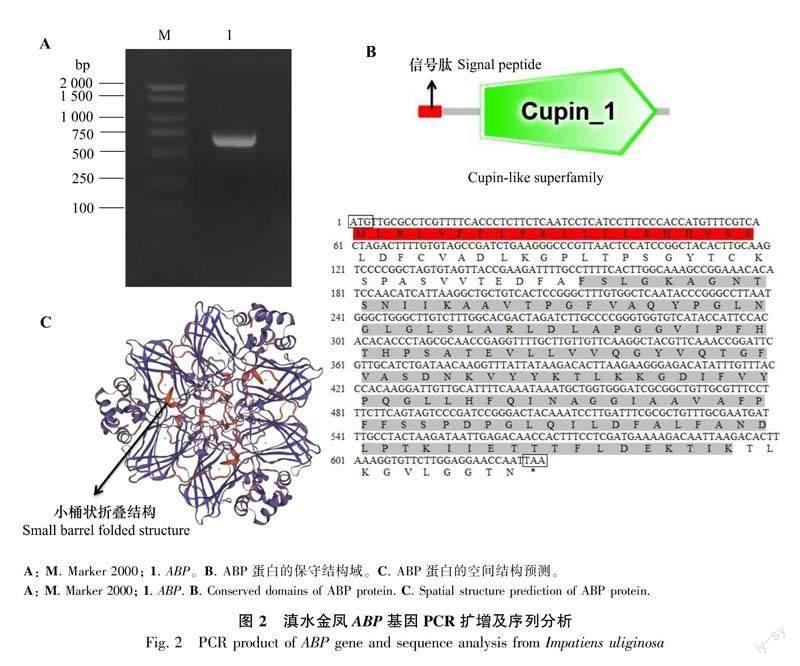
根据滇水金凤花距转录组设计的特异性扩增引物,以花距器官的cDNA为模板,采用 RT-PCR克隆获得ABP的基因片段(图2:A)。
运用ExPasy-ProtParam对滇水金凤ABP基因编码的蛋白进行分析,IuABP全长627 bp,编码208 aa,相对分子量为22 108.6 Da,理论等电点为6.95,总共包括3 162个原子,不稳定指数为27.46,属于稳定蛋白。总平均亲疏水性指数为0.405,表明该蛋白为疏水性蛋白。利用SMART分析发现IuABP含有一个典型的Cupin-1结构域(147个氨基酸),E-value为7.85e-36, 并含有一个20 aa的信号肽, 说明该基因属于Cupin超家族成员(图2:B)。滇水金凤ABP基因不存在跨膜结构域,亚细胞定位于细胞壁。此外,借助SWISS-MODEL对滇水金凤ABP基因进行三维空间结构的预测,发现IuABP蛋白具有Cupin超家族蛋白典型的小桶装折叠结构(图2:C)。
2.2 滇水金凤ABP基因的系统进化分析
运用NCBI数据库中的BlastP功能,将IuABP基因编码的氨基酸序列与其他物种的ABP氨基酸序列进行在线比对,结果表明IuABP与喜马拉雅凤仙花(Impatiens glandulifera XP_047342663.1)、辣椒(Capsicum annuum XP_016567466.1)、桃(Prunus persica XP_007202573.1)、拟绒毛烟草(Nicotiana tomentosiformis XP_009600028.1)、野草莓(Fragaria vesca XP_004287628.1)、斑点猴面花(Erythranthe guttata XP_012830892.1)、美国山核桃 (Carya illinoinensis XP_042972396.1)、月季(Rosa chinensis XP_024182988.1)、胡桃 (Juglans regia XP_018844294.1)、杨梅(Morella rubra KAB1209489.1)、开心果(Pistacia vera XP_031267949.1)、马铃薯(Solanum tuberosum XP_006342915.1)、木薯(Manihot esculenta XP_021596589.1)、橡胶树(Hevea brasiliensis XP_021647439.1)的ABP蛋白同源,并且与它们具有较高的相似性。利用DNAMAN v9.0将IuABP和这些物种的氨基酸序列进行多序列比对,结果显示,IuABP与其他物种的ABP蛋白具有较高的相似性,均达71%(图3)。进一步利用MEGA-X软件,采用邻接法(Bootstrap=1 000)构建系统进化树,发现滇水金凤ABP基因与喜马拉雅凤仙花聚为一支,亲缘关系最近(图4)。
2.3 滇水金凤ABP基因的时空表达分析
研究发现IuABP基因在滇水金凤花距发育的3个时期(花苞期、始花期和盛花期)及2个部位(檐部和距部)均有表达(图5)。在滇水金凤花距檐部中,IuABP基因的表达量呈先下降后上升的趋势,在盛花期时达最高;而在花距距部中,在花苞期时表达最高,随后逐渐下降。此外,IuABP基因在滇水金凤盛花期檐部中表达量最高,其次是在花苞期檐部中,可能与IuABP基因在滇水金凤花距檐部的细胞生长与扩张中起重要作用有关。因此,可以推测IuABP基因在滇水金凤花距的细胞发育过程中发挥了重要作用。
3 讨论与结论
ABP对植物细胞的分裂与伸长具有较为显著的促进作用,因此逐渐被当作为一种生长素的潜在受体蛋白(张聪等,2018)。近年来,越来越多的ABP基因从不同植物中被分离克隆出来,并对其功能作用进行了研究。本研究从滇水金凤中成功克隆了花距发育相关基因IuABP,其cDNA 全长为627 bp,编码208 aa,属于疏水性稳定蛋白。Cupin结构域的β折叠桶状结构,具有热稳定性,能够用来储存氨基酸(符霖等,2021)。本研究中IuABP基因具有典型的Cupin-1结构域,三维空间结构也具有典型的小桶状折叠结构,与任浩然等(2019)对月季RcABP19基因结构的研究结果一致,推测IuABP属于Cupin超家族,可能参与了花距发育所需的氨基酸的储存过程。同源性分析发现,滇水金凤ABP基因与桃、喜马拉雅凤仙花、月季等物种ABP基因的同源性较高,均达71%。张巍等(2013)对桃ABP1进行了研究,发現在桃的果实发育过程中,存在ABP1介导的信号转导途径。大量研究表明ABP蛋白能够接收和转运生长素信号,并诱导细胞快速膨大和伸长等。因此,滇水金凤ABP蛋白是否与桃ABP1蛋白具有相似的功能仍需进一步探究。系统进化分析表明滇水金凤ABP基因与喜马拉雅凤仙花聚为一支,两者亲缘关系最近。
ABP1作為生长素信号途径中的新受体,不仅能够调控非转录细胞质反应,还能诱导许多生长素早期应答基因的转录,如PLT、Aux/IAA以及ARF基因等,从而参与细胞扩张和细胞增殖、生长素反馈调控等过程(Chen et al., 2001;Kim & Triplett, 2004)。Steffens等(2001)的研究发现,促使原生质体变得膨大的生长素信号是因为受到原生质体外面的ABP1基因诱导,玉米中的ABP1基因在烟草叶片中过量表达,能够提高细胞对生长素的敏感能力。本研究通过qRT-PCR分析发现,在滇水金凤檐部,IuABP基因的表达量随着花距的发育逐渐上升,在盛花期达到最高;而在距部中,IuABP基因的表达量在花苞期最高,随着花距的发育逐渐降低,这与ABP1基因在烟草细胞生长活跃的时期表达量较高,而在细胞快结束分化时表达较低的情况一致(高启祥等,2001)。ABP基因在植物体不同部位的表达可能存在较大的差异,本研究中IuABP基因在滇水金凤花距的檐部和距部的表达情况相反,这说明IuABP基因在滇水金凤花距中的表达存在发育时期和组织特异性, 推测IuABP基因在檐部和距部的作用机制可能不同(乔麟轶等,2012;张巍等,2013)。IuABP基因在距部的表达模式可能是在始花期促进了细胞分裂与伸长,而盛花期时其促进作用急剧减缓。综上所述,推测IuABP基因在滇水金凤花距生长发育过程具有重要作用,可能通过调控生长素来促进细胞的分裂与伸长进而参与调控花距的发育,但具体的调控机制有待进一步探究。
本研究发现的IuABP基因属于滇水金凤ABP亚族新成员,具有Cupin超家族典型的结构域。IuABP基因荧光定量的结果表明IuABP基因对滇水金凤的花距细胞生长有促进作用,但具体作用机制还需进一步探究。在今后的实验中,可以利用VIGS对IuABP基因进行沉默,验证IuABP基因在滇水金凤花距细胞生长发育中的功能。对本研究的进一步探索不仅为探究滇水金凤花距发育的分子机制奠定研究基础,还为凤仙花花距发育、花形改良及新品种培育提供一定的基础数据和理论依据。
参考文献:
BRAUN N, WYRZYKOWSKA J, MULLER P, et al., 2008. Conditional repression of auxin binding protein 1 reveals that it coordinates cell division and cell expansion during postembryonic shoot development in Arabidopsis and tobacco [J]. Plant Cell, 20(10): 2746-2762.
CHEN JG, SHIMOMURA S, SITBON F, et al., 2001. The role of auxin-binding protein 1 in the expansion of tobacco leaf cells [J]. Plant J, 28(6): 607-617.
CHEN JG, ULLAH H, YOUNG JC, et al., 2001. ABPl is required for organized cell elongation and division in Arabidopsis embryogenesis [J]. Genes Dev, 15(7): 902-9l1.
CULLEN E, FERNNDEZ-MAZUECOS M, GLOVER BJ, 2018. Evolution of nectar spur length in a clade of Linaria reflects changes in cell division rather than in cell expansion [J]. Ann Bot, 122(5): 801-809.
FERNNDEZ-MAZUECOS M, GLOVER BJ, 2017. The evo-devo of plant speciation [J]. Nat Ecol Evol, 1(4): 11.
FU L, WANG HH, HUANG SL, et al., 2021. Alternative splicing of rice OsEnS51 and structural analysis of encoding protein [J/OL].Mol Plant Breed. http://kns.cnki.net/kcms/detail/46.1068.S.20210901.1702.006.html. [符霖, 王慧慧, 黄思琳, 等, 2021. 水稻OsEnS51可变剪接及编码蛋白结构分析 [J/OL]. 分子植物育种. http://kns.cnki.net/kcms/detail/46.1068.S.20210901.1702.006.html.]
GAO QX, LI YZ, LIU SL, 2001. Distribution and expression of auxin binding protein 1 (ABP1) in the thin cell layers of tobacco [J]. Acta Bot Sin, 43(10): 1018-1023. [高启祥, 李颖章, 刘淑兰, 2001. 烟草薄层培养生长素结合蛋白ABP1的定位和ABP1在细胞分化中的变化 [J]. 植物学报, 43(10): 1018-1023.]
HODGES SA, ARNOLD ML, 1995. Spurring plant diversification: are floral nectar spurs a key innovation? [J]. Proc Royal Soc Lond Series B Biol Sci, 262(1365): 343-348.
HODGES SA, FULTON M, YANG JY, et al, 2003. Verne grant and evolutionary studies of Aquilegia [J]. New Phytol, 161(3): 113-120.
HUANG Y, LIU F, GUO QQ, et al., 2008. Cloning and expression of auxin-binding proteins 1 gene in ramie [Boehmeria nivea (Linn.) Gaud.] [J]. Acta Agron Sin, 34(8): 1358-1365. [黃妤, 刘峰, 郭清泉, 等, 2008. 苎麻生长素结合蛋白ABP1基因cDNA的克隆及表达 [J]. 作物学报, 34(8): 1358-1365.]
JONES AM, IM KH, SAVKA MA, et al., 1998. Auxin-dependent cell expansion mediated by overexpressed auxin-binding protein 1 [J]. Science, 282 (5391): 1114-1117.
KIM HJ, TRIPLETT BA, 2004. Characterization of GhRac1 GTPase expressed in developing cotton (Gossypium hirsutum L.) fibers [J]. Biochim Biophys Acta, 1679(3): 214-221.
LUO C, HUANG WL, ZHU JP, et al., 2019. The complete chloroplast genome of Impatiens uliginosa Franch., an endemic species in Southwest China [J]. Mitochondrial DNA B, 4(2): 3846-3847.
MACK JL, DAVIS AR, 2015. The relationship between cell division and elongation during development of the nectar-yielding petal spur in Centranthus ruber (Valerianaceae) [J]. Ann Bot, 115(4): 641-649.
PUZEY JR, GERBODE SJ, HODGES SA, et al., 2011. Evolution of spur-length diversity in Aquilegia petals is achieved solely through cell-shape anisotropy [J]. Proc Biol Sci, 279(1733): 1640-1645.
QIAO LY, ZHANG WP, ZHANG L, et al., 2012. Research advances in auxin binding protein ABP1 [J]. Guangdong Agric Sci, 39(7): 230-232. [乔麟轶, 张文萍, 张磊, 等, 2012. 植物生长素结合蛋白ABPl的研究进展 [J]. 广东农业科学, 39(7): 230-232.]
REN HR, FU XD, ZHI QJ, et al., 2019.Cloning and expression profile analysis of auxin binding protein gene RcABP19 in Rosa chinensis [J]. Plant Physiol J, 55(7): 983-992. [任浩然, 傅晓东, 支秋娟, 等, 2019. 月季生长素结合蛋白基因RcABP19的克隆及表达特征分析 [J]. 植物生理学报, 55(7): 983-992.]
STEFFENS B, FECKLER, PALME K, et al., 2001. The auxin signal for protoplast swelling is perceived by extracellular ABP1 [J]. Plant J, 27(6): 591-599.
STEPHANIE JC, CRISTINA WC, KATE SB, 2021. Brassinosteroids regulate petal spur length in Aquilegia by controlling cell elongation [J]. Ann Bot, 128(7): 931-942.
TONG ZK, LI Y, CAI B, et al., 2022. Cloning and expression analysis of SAUR gene of Impatiens uliginosa Franch. [J] Acta Bot Boreal-Occident Sin, 42(1): 21-28. [童桢开, 李洋, 蔡斌, 等, 2022. 滇水金凤SAUR基因的克隆及表达分析 [J]. 西北植物学报, 42(1): 21-28.]
TSAI T, DIGGLE PK, FRYE HA, et al., 2018. Contrasting lengths of Pelargonium floral nectar tubes result from late differences in rate and duration of growth [J]. Ann Bot, 121(3): 549-560.
VERVOORT A, JACQUEMART AL, CAWOY V, 2011. Comparative reproductive biology in co-occurring invasive and native Impatiens species [J]. Int J Plant Sci, 172(3): 366-377.
YANT L, COLLANI S, PUZEY J, et al., 2015. Molecular basis for three-dimensional elaboration of the Aquilegia petal spur [J]. Proc Biol Sci, 282(1803): 20142778.
ZHANG C, ZHAO KL, HU JJ, et al., 2018. Analysis of ABP1 family in Arabidopsis thaliana and Gramineae [J]. Mol Plant Breed, 16(11): 3526-3532. [張聪, 赵康路, 胡静静, 等, 2018. 拟南芥和禾本科植物 ABP1 家族分析 [J]. 分子植物育种, 16(11): 3526-3532.]
ZHANG R, MIN Y, LYNN DH, et al., 2020. A role for the auxin response factors ARF6 and ARF8 homologs in petal spur elongation and nectary maturation in Aquilegia [J]. New Phytol, 227(5): 1392-1405.
ZHANG W, SHI MY, YU J, et al., 2013. Cloning and expression analysis of auxin-binding proteins 1 from Prunus persica L. fruit [J]. J Beijing Agric Coll, 28(2): 1-4. [张巍, 史梦雅, 余佳, 等, 2013. 桃果实生长素结合蛋白ABP1的克隆及表达分析 [J]. 北京农学院学报, 28(2): 1-4.]
(责任编辑 周翠鸣)
收稿日期: 2022-07-29
基金项目: 国家自然科学基金(32060364,32060366,31860230,31560228); 云南省重大科技专项(202102AE090052); 云南省高校园林植物与观赏园艺科技创新团队项目(51700204); 云南省园林植物遗传改良与高效繁育博士生导师团队项目; 云南省中青年学术技术带头人培养项目(2018HB024)。
第一作者: 魏春梅(1998-),硕士,研究方向为园林植物资源与应用,(E-mail)weichunmei@swfu.edu.cn。
*通信作者: 黄海泉,博士,教授,博士生导师,研究方向为园林植物研究,(E-mail)haiquanl@163.com。

