电针调控肿瘤坏死因子受体1/受体相互作用蛋白激酶1/核因子κB轴对骶髓损伤后神经源性膀胱尿潴留大鼠尿动力学的影响
卢壮,刘敏,韦艳梅,黄钰岚,林静
作者单位:百色市人民医院,a康复医学科,b泌尿外科,广西壮族自治区 百色 533000
神经源性膀胱(neurogenic bladder, NB)是骶髓损伤(sacral cord injury, SCI)的常见临床并发症,SCI 病人中NB 的发生率近乎100%,严重影响了病人生存质量[1]。SCI后,受损的神经中枢无法有效调控膀胱逼尿肌及尿道括约肌,极易出现膀胱或尿道功能障碍,最终导致尿潴留,引发反复尿路感染、结石、慢性肾功能衰竭等疾病[2]。电针对神经官能症、神经痛和神经麻痹等疾病具有较好疗效。多项研究结果[3-4]表明,电针疗法具有促进损伤脊髓修复、双向调节膀胱功能及抗泌尿系统感染的独特功效。笔者前期研究已表明,电针取穴“次髎”“中极”“三阴交”可调控凋亡相关因子的表达,使SCI 后NB 模型大鼠的膀胱功能得到改善[3-4]。炎症反应与凋亡关系密切。过度炎症反应可诱发脊髓继发性损伤,加速神经元凋亡,影响SCI 后神经功能的修复以及膀胱功能。研究发现,电针刺激还可通过抑制炎症反应改善大鼠SCI后下肢运动功能[6],提示电针改善SCI 后NB 大鼠膀胱功能的机制也可能与其抗炎效应有关。故本研究拟选取SCI 后NB 大鼠模型为研究对象,探究电针对SCI后NB 尿潴留大鼠尿动力学及炎症反应的影响及机制。本研究起止时间为2019年1月至2021年12月。
1 材料与方法
1.1 试剂与仪器注射用青霉素钠(石家庄石药集团中诺药业公司,批号H23020930);乳酸钠林格注射液(安徽双鹤药业公司,批号H20055488);水合氯醛(上海山浦化工有限公司,批号30037516);TriQuick Reagent(北京Solarbio 公司);反转录试剂(武汉Monad 公司);SYBR qPCR Master Mix(安徽Biosharp 公司);肿瘤坏死因子α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6) ELISA 试剂盒(上海酶联生物);γ干扰素(IFN-γ)ELISA试剂盒(武汉基因美公司);肿瘤坏死因子受体1(TNFR1)、受体相互作用蛋白激酶1(RIPK1)、磷酸化kappa B 抑制因子激酶(p-IKKβ)、kappa B 抑制因子激酶(IKKβ)、核因子κB p65(NF-κB p65)、磷酸化核因子κB p65(p-NF-κB p65)、磷酸化NF-κB 抑制蛋白α(p-IκBα)、β-actin、GAPDH 抗体(英国Abcam 公司);NF-κB 抑制蛋白α(IκBα)抗体(美国CST 公司);BCA 蛋白定量试剂盒(北京Solarbio 公司);RIPA 裂解液(北京Solarbio 公司);WZ-50C6 微量灌注泵(浙江史密斯医学仪器公司);SDZ-V 型电针治疗仪(苏州医疗公司);MP150-WSW 多通道生理记录仪(美国Biopac 公司);电泳仪(美国Bio-Rad 公司);多功能酶标仪(美国MD 公司);Real-Time PCR System(美国Agilen 公司);低温离心机(德国Eppendorf公司)。
1.2 动物及分组SPF 级SD 大鼠45 只,雄性,体质量范围为250~300 g,由广西医科大学实验动物中心提供。采用随机数字表法挑选10 只大鼠作为空白组,其余35 只构建SCI 后NB 尿潴留大鼠模型,2 周后确定SCI 后NB 模型成功后随机数字表法选取30只分为模型组、电针组与电针对照组,每组10 只。动物实验过程符合动物伦理委员会标准。
1.3 动物模型制备采用脊髓横断法并加以改良,构建SCI后NB尿潴留大鼠模型[7-8]:大鼠在手术前禁食12 h;腹腔注射10%水合氯醛(30 mg/kg)麻醉后固定于鼠板上;取大鼠俯卧位,消毒铺巾;以L2~L3椎间隙为中心切开皮肤,分离肌肉和筋膜;切断L2~L3棘间韧带,咬除椎板;用牙科探针挑起并切断脊髓;止血、缝合、消毒。手术后常规喂养,连续腹腔注射7 d 20 万U 青霉素防止感染。手术后,大鼠处于脊髓休克期,膀胱会出现尿潴留,每天手法辅助排尿2~3次。手术后第14天,大鼠度过脊髓休克期后,出现前肢可行走、后肢拖动,膀胱无抑制性收缩、膀胱最大容量明显下降,尿潴留等症状,说明SCI 后NB尿潴留大鼠模型构建成功。
1.4 一般情况观察35 只造模大鼠中,有1 只后肢能自主活动,1只手术后死亡,1只不符合造模要求,共32 只符合造模成功标准,取30 只大鼠随机分为模型组、电针组和电针对照组,每组10只,纳入结果分析。
1.5 电针治疗建模成功2 周后行电针治疗[7,9]。电针组选取穴位:“次髎”“中极”“三阴交”,电针对照组选取上述3 个穴位的对照点(穴外侧旁开0.3 cm 处),两组针刺操作方法相同,20 min/d,连续7 d。空白组和模型组不进行电针治疗。
1.6 尿动力学检测各组大鼠水合氯醛麻醉后排空膀胱,将F3 导管从尿道导入,用微量灌注泵和MP150-WSW 多通道生理记录仪匀速(0.1 mL/min)灌注恒温生理盐水,检测并记录膀胱最大容量(mL)、膀胱基础压(cmH2O)、漏尿点压力(cmH2O)和膀胱顺应性(mL/cmH2O)。
1.7 样本采集和处理各组大鼠完成尿动力学检测后,水合氯醛腹腔麻醉,以L2~L3椎间隙为中心取上下各约l cm 脊髓组织,生理盐水洗净,−80 ℃保存备用。
1.8 实时荧光定量逆转录聚合酶链反应(qRTPCR)TRIzol 试剂盒从各组大鼠脊髓组织中提取总RNA,逆转录混合底物逆转录总cDNA。SYBR Green 法进行PCR 扩增,反应体系;95 ℃ 30 s 变性,94 ℃变性5 s,60 ℃退火30 s,72 ℃延伸30 s,40个循环;均重复3 次,结果取平均值,2−ΔΔCt法计算TNFR1和RIPK1的相对表达量。引物见表1。

表1 引物序列
1.9 蛋白质印迹法(Western Blotting)将大鼠脊髓组织匀浆后,离心取上清液,BCA 法测定蛋白浓度,5×Loading buffer 混匀,沸水浴5 min;提总蛋白,行恒压SDS-PAGE 电泳,转PVDF 膜;TBST 洗涤,5%脱脂奶粉-TBST 37 ℃封闭1 h,加一抗,4 ℃孵育过夜;加对应HRP 标记二抗,37 ℃孵育1 h,TBST 洗涤,ECL 显影,Image J 分析条带,计算TNFR1、RIPK1、p-IKKβ、IKKβ、NF-κB(p65)、p-NF-κB(p65)、p-IκBα、IκBα的相对表达量。
1.10 酶联免疫吸附剂测定法(ELISA)取适量组织块,预冷PBS 冲洗,称重;加预冷PBS(组织与PBS质量体积比为1∶5)于冰上充分研磨;匀浆液5 000×g离心5 min,取上清;严格按说明书检测TNF-α、IL-1β、IL-6、IFN-γ含量。
1.11 统计学方法使用SPSS 25.0 和GraphPad Prism 5 进行数据分析和绘图,计量资料表示为xˉ ±s。符合正态分布的数据用参数检验,多组间比较用单因素方差分析,组间两两比较用LSD-t和SNK-q检验;不符合正态分布的数据用非参数检验,多组间比较和组间两两比较用Kruskal-Wallis 检验。P<0.05表示差异有统计学意义。
2 结果
2.1 大鼠尿动力学检测与空白组比较,模型组大鼠膀胱最大容量、膀胱基础压、漏尿点压力、膀胱顺应性增加,差异有统计学意义(P<0.05);与电针组治疗前比较,电针组治疗后膀胱最大容量、膀胱基础压、漏尿点压力、膀胱顺应性降低,差异有统计学意义(P<0.05);与电针对照组治疗后比较,电针组治疗后膀胱最大容量、膀胱基础压、漏尿点压力、膀胱顺应性降低,差异有统计学意义(P<0.05);电针对照组治疗后与治疗前比较差异无统计学意义(P>0.05);电针组及电针对照组治疗前与模型组比较均差异无统计学意义(P>0.05)。见表2,3。
表2 大鼠尿动学检测结果/
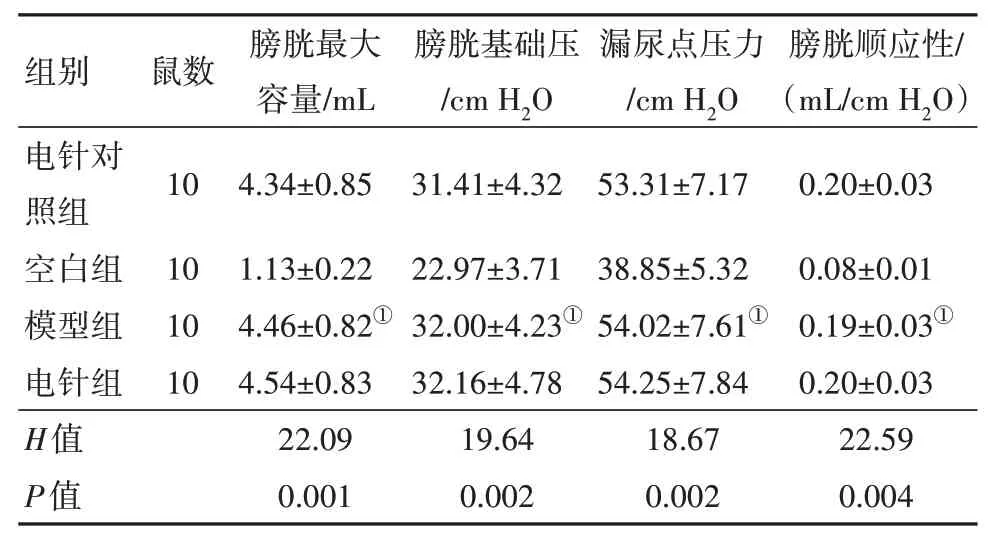
表2 大鼠尿动学检测结果/
注:①与空白组比较,P<0.05。
?
表3 大鼠治疗前后尿动学检测结果/

表3 大鼠治疗前后尿动学检测结果/
注:①与治疗前比较,P<0.05。②与电针对照组比较,P<0.05。
?
2.2 电针对大鼠脊髓组织TNFR1/RIPK1 通路指标表达的影响与空白组比较,模型组TNFR1、RIPK1 mRNA 和TNFR1、RIPK1、p-IKKβ/IKKβ 和p-IκBα/IκBα 蛋白表达升高,差异有统计学意义(P<0.05);与模型组比较,电针组TNFR1、RIPK1 mRNA和TNFR1、RIPK1、p-IKKβ/IKKβ 和p-IκBα/IκBα 蛋白表达降低,差异有统计学意义(P<0.05);电针对照组与模型组比较差异无统计学意义(P>0.05)。见表4,5。
表4 各组大鼠脊髓组织TNFR1、RIPK1 mRNA的表达/

表4 各组大鼠脊髓组织TNFR1、RIPK1 mRNA的表达/
注:TNFR1为肿瘤坏死因子受体1,RIPK1为受体相互作用蛋白激酶1。①与空白组比较,P<0.05。②与模型组比较,P<0.05。③与电针对照组比较,P<0.05。
?
表5 各组大鼠脊髓组织TNFR1/RIPK1通路指标蛋白的表达/

表5 各组大鼠脊髓组织TNFR1/RIPK1通路指标蛋白的表达/
注:TNFR1为肿瘤坏死因子受体1,RIPK1为受体相互作用蛋白激酶1,p-IKKβ为磷酸化kappa B 抑制因子激酶,IKKβ为kappa B 抑制因子激酶,p-IκBα为磷酸化NF-κB抑制蛋白α。①与空白组比较,P<0.05。②与模型组比较,P<0.05。③与电针对照组比较,P<0.05。
?
2.3 电针对大鼠脊髓组织NF-κB 通路指标表达及炎症反应的影响与空白组比较,模型组p-NF-κB p65/NF-κB p65 蛋白表达和TNF-α、IL-1β、IL-6、IFNγ 含量升高,差异有统计学意义(P<0.05);与模型组比较,电针组p-NF-κB p65/NF-κB p65 蛋白表达TNF-α、IL-1β、IL-6、IFN-γ 含量降低,差异有统计学意义(P<0.05);电针对照组与模型组比较差异无统计学意义(P>0.05)。见图1和表6,7。

图1 各组大鼠脊髓组织中NF-κB p65、p-NF-κB p65的表达
表6 各组大鼠脊髓组织NF-κB通路指标蛋白的表达/

表6 各组大鼠脊髓组织NF-κB通路指标蛋白的表达/
注:NF-κB p65 为核因子κB p65,p-NF-κB p65 为磷酸化核因子κB p65。①与空白组比较,P<0.05。②与模型组比较,P<0.05。③与电针对照组比较,P<0.05。
?
表7 各组大鼠脊髓组织中炎症相关因子的表达/(ng/L,)
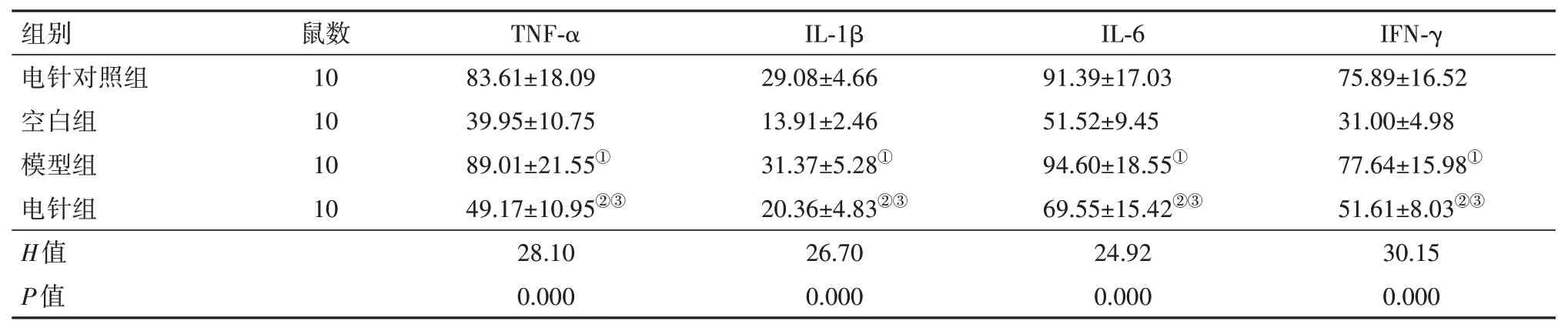
表7 各组大鼠脊髓组织中炎症相关因子的表达/(ng/L,)
注:TNF-α为肿瘤坏死因子α,IL-1β为白细胞介素1β,IL-6为白细胞介素6,IFN-γ 为γ干扰素。①与空白组比较,P<0.05。②与模型组比较,P<0.05。③与电针对照组比较,P<0.05。
?
3 讨论
中医学将SCI后NB 尿潴留归于“癃闭”范畴,肾气不足、正气亏损、膀胱气化失司、三焦不能同调水道是其主要病机,膀胱内充满尿液无法排出。大量研究表明,临床运用电针治疗可双向调节膀胱功能及抗泌尿系统感染[10-11]。笔者前期研究证实电针取穴“次髎”“中极”“三阴交”治疗SCI后NB 大鼠,可一定程度改善受损膀胱组织功能障碍。“次髎”属膀胱经,主治排尿不利而导致的尿潴留,骶神经(支配膀胱等盆腔脏器)位于该穴下,刺激“次髎”可激活传入神经元将刺激传导至脊髓排尿中枢,运动逼尿肌和括约肌节,引发排尿反射。“中极”为膀胱之募穴,是治六腑病的要穴,髂腹下神经(支配膀胱和直肠)位于该穴下,刺激“中极”可收缩膀胱逼尿肌,引发排尿反射,利于膀胱功能调节及气化。“三阴交”是足三经交会穴,主下焦气机不通,刺激“三阴交”可通过反射弧传导至脊髓后跟,刺激腰骶部排尿中枢,引发排尿反射,调节膀胱活动和功能。本研究构建SCI后NB 尿潴留大鼠模型后,大鼠膀胱最大容量、漏尿点压力和膀胱顺应性升高,说明模型大鼠尿潴留现象明显,膀胱功能障碍,造模成功。利用电针刺激SCI 后NB 尿潴留大鼠次髎、中极、三阴交后发现,膀胱最大容量、漏尿点压力和膀胱顺应性降低,与既往研究结果一致[12-13],表明电针可改善SCI 后排尿中枢功能,刺激逼尿肌及括约肌活动,降低膀胱内压、最大容量,减少残尿量,恢复尿潴留大鼠膀胱功能。
SCI 后神经元和轴突中大量分泌炎性因子(TNF-α、IL-1β、IL-6 和IFN-γ 等),过度的神经元炎症加重了脊髓神经组织损伤,影响膀胱功能恢复,而电针可抑制SCI 大鼠的炎症反应,促神经系统恢复[14]。研究发现,SCI 后NF-κB 通路在脊髓组织神经组织中异常激活,大量研究表明抑制该通路可减轻神经元炎症反应,恢复调控功能[15-16]。正常状态下,NF-κB 在胞质中以IKB-NF-κB p65-NF-κB p50复合物形式存在,受到外界刺激因素(如TNF-α)后,IKBα发生磷酸化,而后被泛素化并降解,NF-κB p65移位入核,诱发一系列炎性因子表达。NF-κB 受到TNFR1/RIPK1 通路的调控,TNFR1 活化后会快速募集RIPK1,激活其下游IKKβ,IKKβ 活化进一步磷酸化IKBα,释放并激活NF-κB。研究[17]表明,通过抑制SCI 大鼠TNFR1 表达可减少组织损伤及炎症反应,改善运动功能。但电针能否通过调控TNFR1/RIPK1/NF-κB通路发挥作用尚未可知。
本研究结果显示,SCI 后NB 尿潴留大鼠脊髓组织TNFR1、RIPK1和p-IKKβ/IKKβ 蛋白表达升高,表明TNFR1/RIPK1 通路在SCI 后NB 尿潴留大鼠脊髓组织中显著激活;利用电针治疗后,TNFR1、RIPK1、p-IKKβ/IKKβ 蛋白表达降低,表明电针可抑制TN⁃FR1/RIPK1 通路活化。同时我们发现,在应用电针治疗后,大鼠脊髓组织p-NF-κB p65/NF-κB p65 及pIKBα/IKBα 蛋白表达降低,提示电针可通过抑制TNFR1/RIPK1通路活化进一步拮抗NF-κB。本研究还进行了NF-κB 下游炎症相关因子的检测,发现电针治疗可降低大鼠脊髓组织中TNF-α、IL-1β、IL-6和IFN-γ 的水平,表明电针治疗后,TNFR1/RIPK1/NF-κB 通路被抑制,进而影响下游TNF-α、IL-1β、IL-6 和IFN-γ 的表达,减轻神经元炎症反应,促进神经组织修复,恢复排尿中枢功能,改善膀胱功能。
既往研究证实,电针刺激“中极”“次髎”“三阴交”可显著改善SCI 后NB 尿潴留,但相关机体机制研究较少,主要为抑制神经元凋亡(如活化PI3K/AKT 通路和拮抗NGF/TrkA 通路),与笔者前期研究发现电针可抑制PTEN/Akt 通路抑制神经元凋亡相似。而对于SCI后脊髓组织中广泛的炎症反应和异常激活的NF-κB,电针对其的调控机制尚未见研究。既往研究中,不乏围绕NF-κB 对电针调控机制的研究,如电针抑制NF-κB 活性改善大鼠认知障碍[18]、治疗高血压性脑出血[19]和溃疡性结肠炎[20]等。本研究首次发现电针可通过抑制TNFR1/RIPK1 通路拮抗NF-κB 活化,减轻脊髓神经元炎症反应,重塑部分脊髓神经功能,使逼尿肌和括约肌正常活动,改善SCI后NB尿潴留大鼠膀胱功能。
综上所述,本研究结果表明电针“次髎”“中极”“三阴交”可改善SCI 后NB 尿潴留大鼠膀胱功能,其机制可能与抑制TNFR1/RIPK1/NF-κB 通路,减轻神经元炎症反应,促进神经组织修复有关,表明电针在治疗SCI 后NB 尿潴留有较好疗效,具有明显抗炎效应,临床应用价值较高,值得应用、推广。

