苍术内酯对骨关节炎大鼠软骨损伤修复和软骨细胞凋亡的影响
郭跃生,穆岭,张锟,赵大伟,姚太顺
作者单位:洛阳正骨医院(河南省骨科医院)足踝一科,河南 洛阳 471002
骨关节炎(osteoarthritis, OA)为中老年人常见病症,是一种慢性退行性关节疾病,其发病率随着年龄增长而升高,70 岁以上的老人患病率高达70%[1]。临床病理表现主要为关节肿痛、关节软骨退化或缺失、关节活动僵硬等,严重影响病人日常生活[2]。软骨组织靠关节液进行物质交换,一旦受到损伤,靠自身代谢修复组织功能十分困难[4]。OA发病机制复杂,目前临床仍为保守治疗,迫切需要寻找更加安全有效的药物。苍术内酯(atractyleno⁃lide, AT)是分离自中草药白术的一种生物活性成分,具有良好的抗炎止痛、祛风散寒药理作用,中医学临床中常用于治疗风湿和消化系统疾病[5]。研究表明,AT 可以调节炎性因子水平,对细胞增殖和凋亡亦有影响,推测其或对软骨损伤有积极作用[6]。因此,本研究自2022 年1―4 月建立OA 大鼠模型,探讨AT 对软骨损伤的影响,并分析其可能作用机制,旨在为临床提供参考。
1 材料与方法
1.1 材料
1.1.1 实验动物SPF 级SD 大鼠,雄性,60 只,7~8周龄,购自北京维通利华实验动物技术有限公司,合格证号:SCXK(京)2016-0011。体质量210~230 g。饲养条件设置为:环境温度为20~24 ℃,保持良好通风,给予充足饮水和普通饲料,适应性饲养1周。
1.1.2 药品、主要试剂和仪器AT(纯度≥98%,上海沪峥生物科技有限公司,批号HZ-22023);肿瘤坏死因子-α(tumour necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β, IL-1β)、白细胞介素-6(in⁃terleukin-6, IL-6)ELISA 试剂盒(北京雅安达生物科技有限公司);兔抗β-actin 多克隆抗体、高迁移率族蛋白2(high mobility group proteins,HMGA2)、糖原合成酶激酶-3β(glycogen synthetase kinase,GSK-3β)、凋亡蛋白B 细胞淋巴瘤因子2(Bcl-2)、Bcl-2 相关蛋白(bcl-2 related x protein, Bax)多克隆抗体、山羊抗兔二抗IgG(北京索莱宝科技有限公司);小动物手术器械(南京赛博生物技术有限公司);石蜡包埋机(徕卡-2018型,赛默飞世尔仪器有限公司)。
1.2 方法
1.2.1 OA 大鼠模型建立采用前后交叉韧带断离术建立OA模型,选取48只大鼠腹腔注射3%戊巴比妥钠进行麻醉后,固定于手术台上,将大鼠左后腿毛剃除并消毒,无菌条件下在左侧膝关节髌内纵向切开皮肤,暴露出整个膝关节,止血钳钝性分离结缔组织、血管、肌肉等,显露前交叉韧带横向剪断,切除1/3 半月板,保留关节软骨面,逐层缝合。手术完毕给各组大鼠腹腔注射青霉素,预防感染。术后3 d 内,每日将大鼠放入跑步笼中30 min,观察大鼠状态,大鼠出现膝关节肿胀变形,走路跛行或侧倒,视为建模成功[7]。
1.2.2 分组与给药造模成功大鼠随机分为模型组、AT 低、中、高剂量组,各12 只,剩余12 只为对照组。参照文献[8-9],AT 低、中、高剂量组腹腔注射给药5、10、20 mg/kg AT 注射液(生理盐水配制),对照组及模型组给予等量生理盐水,每组给药1 次/天,连续注射30 d。
1.3 检测指标
1.3.1 标本采集末次给药后,腹腔注射3%戊巴比妥钠麻醉,腹主动脉采血,4 ℃下3 000 r/min 离心15 min,取血清,−20 ℃保存。脊椎脱臼法处死大鼠,取膝关节,分离软骨组织,剪取部分装入无菌冻存管内,−80 ℃保存备用,其余软骨组织置入4%多聚甲醛液固定24 h备用。
1.3.2 大鼠软骨组织Mankin's 评分光学显微镜下观察软骨组织形态变化,并采用Mankin's 软骨组织学分级标准对各组大鼠软骨组织进行评分,从大鼠软骨结构、软骨细胞、潮线评定大鼠软骨组织病变程度,各部分数相加为最终得分。评分越高表明OA病变程度越严重,详细评定标准见表1。

表1 Mankin's软骨组织学评定标准
1.3.3 血清炎性因子水平检测取出ELISA试剂盒铝箔袋,置于室温1 h 平衡温度后,按照TNF-α、IL-1β、IL-6 试剂盒说明书操作,主要步骤为:取出相关板条设置板孔,分别为样品孔与标准孔,标准孔加入标准品,样品孔加入10 µL 待测样本。再添加40 µL 稀释液于样品孔,将100 µL 辣根过氧化物酶标记好的检测抗体加入各板孔中,封膜37 ℃孵育60 min,弃液并使用洗涤液清洗×5 次。将50 µL 底物A、B 液加入板孔,封膜37 ℃孵育15 min。终止反应于15 min 内在酶标仪450 nm 处检测各板孔光密度(OD)值,根据标准品梯度浓度结果建立标准曲线,计算样本浓度。
1.3.4 软骨组织HE 染色观察取出已固定好的软骨组织,置于10%EDTA 液中脱钙,梯度浓度乙醇脱水,二甲苯透明,石蜡包埋,切片机切成薄片(4µm),切片再烘干3 h至水分完全消失。将切片放入二甲苯Ⅰ10 min→二甲苯Ⅱ10 min→无水乙醇Ⅰ5 min→无水乙醇Ⅱ5 min→95%乙醇3 min→80%乙醇2 min→75%乙醇2 min 进行脱蜡复水,分别经苏木素染色10 min,盐酸分化1 s,伊红染液染色2 min,脱水透明,中性树脂封固。置于光学显微镜下观察软骨组织病理变化并拍片。
1.3.5 TUNEL 法检测软骨组织细胞凋亡取软骨组织石蜡切片,二甲苯脱蜡,乙醇脱水,浸入枸椽酸缓冲液盒60 min,PBS 冲洗×3 次,严格按照TUNEL试剂盒说明书操作,加入显色剂孵育30 min,PBS 冲洗×3 次,复染后封片,光学显微镜下移动切片观察软骨组织神经细胞凋亡情况,选择5个无重复视野,观察棕黄色的凋亡细胞数,计算凋亡率(凋亡细胞数/细胞总数×100%)。
1.3.6 RT-PCR 检测miR-98-5p、HMGA2、GSK-3β mRNA 表达取出软骨组织,预冷的PBS 清洗后迅速加入500 µL Trizol裂解液,上下吹打混匀,再加入氯仿、异丙醇,12 000 r/min 高速离心机离心15 min,离心后吸取上清,检测RNA浓度。使用TAKARA 反转录试剂盒,配制10 µL逆转录体系得到cDNA。将得到的cDNA 配制PCR 反应体系:正、反向引物各0.8 µL,ROX Refermce Dye Ⅱ 0.4 µL,SYBR Premix Ex Tap 10 µL,cDNA 2 µL,RNase free-ddH2O 6 µL。将配置好的反应体系混匀后加入PCR 板,于反应条件为95 ℃ 30 s,95 ℃ 5 s,60 ℃ 35 s 下进行40 个循环。取样本CT值平均数,以目的基因相对内参的表达量计算各样本之间基因表达差异,2−ΔΔCT为各样本基因的表达比较倍数。反应引物序列设计为miR-98-5p:正 向(5′-TATTGTTGTGGGGTAGGGATT-3′),反向(5′-ATAACTTCACCCCAAAAATCG-3′);U6:正向(5′-CGTTCACGCATCTTTAAAATTGGA-3′),反向(5′-TTATGCGTGTCATCCTTGCG-3′)。HMGA2:正向(5′-CATTGGAGAAAAACGGCCAAG-3′),反向(5′-TTGCGAGGATGTCTCTTCAGT-3′);GSK-3β:正向(5′-ATGGCAGCAAGGTAACCACAG-3′),反向(5′-TCTCGGTTCTTAAATCGCTTGTC-3′);以β-actin 为内参,β-actin:正向(5′-GGCTG⁃TATTCCCCTCCATCG-3′),反向(5′-CCAGTTGGTA⁃ACAATGCCATGT-3′)。
1.3.7 蛋白质印迹法检测HMGA2、GSK-3β、Bax、Bcl-2 蛋白表达软骨组织裂解匀浆,4 ℃下12 000 r/min 离心15 min,吸取上清液使用BCA 蛋白浓度测定盒测定蛋白浓度,按照每组蛋白上样量20 µL,加入4 倍体积的缓冲液混匀放入恒温水浴锅中100 ℃加热10 min 进行变性,加入配制好的分离胶与浓缩胶,进行SDS-PAGE 凝胶电泳,之后将蛋白转至PD⁃VF 膜上,5%脱脂牛奶封闭2 h,加入1∶1 000 稀释的HMGA2、GSK-3β、Bax、Bcl-2 一抗,4 ℃封闭过夜,TBST 洗膜,加入二抗(1∶5 000),室温封闭60 min,TBST洗膜,滴加显影液进行显影,显影曝光,分析条带灰度值。
1.4 统计学方法运用SPSS 23.0 统计学软件分析数据,计量数据以表示,采用单因素方差分析进行多组间比较,LSD-t检验进行两组间比较。P<0.05为差异有统计学意义。
2 结果
2.1 软骨组织学评分比较与对照组(1.71±0.12)分比较,模型组大鼠软骨组织学Mankin's 评分(8.62±0.69)分升高(P<0.05)。与模型组比较,AT 低(5.05±0.47)、中(4.68±0.36)、高剂量组(2.15±0.23)大鼠软骨组织学Mankin's评分均降低(P<0.05)。与AT 低剂量组比,AT 中、高剂量组大鼠软骨组织学Mankin's 评分降低(P<0.05)。与AT 中剂量组比,AT高剂量组Mankin's评分降低(P<0.05)。
2.2 血清炎性因子水平比较与对照组比,模型组TNF-α、IL-1β、IL-6 水平上升(P<0.05)。与模型组比,AT低、中、高剂量组TNF-α、IL-1β、IL-6水平降低(P<0.05)。与AT 低剂量组比,AT 中、高剂量组TNF-α、IL-1β、IL-6 水平降低(P<0.05)。与AT 中剂量组比,AT 高剂量组TNF-α、IL-1β、IL-6 水平降低(P<0.05)。见表2。
表2 各组大鼠血清炎性因子水平比较/(ng/L,)
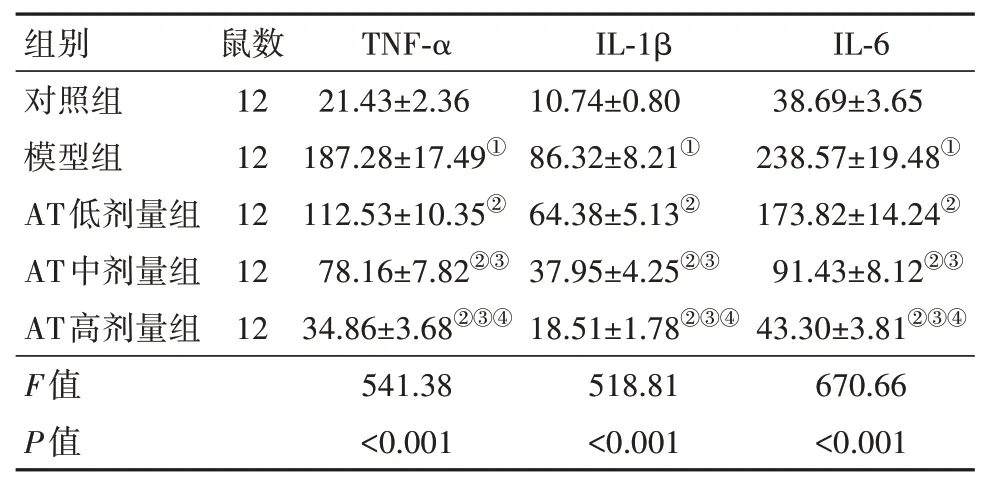
表2 各组大鼠血清炎性因子水平比较/(ng/L,)
注:TNF-α 为肿瘤坏死因子-α,IL-1β 为白细胞介素-1β,IL-6 为白细胞介素-6。①与对照组比,P<0.05。②与模型组比,P<0.05。③与AT 低剂量组比,P<0.05。④与AT中剂量组比,P<0.05。
?
2.3 软骨组织HE 染色比较结果显示,对照组大鼠关节软骨组织结构完整,基质均匀,表层光滑并无裂隙生成,表层细胞形态正常、排列整齐,中层细胞呈圆形或圆柱形四散分布,各层细胞均未见破坏;未见炎性细胞浸润、水肿等现象。模型组大鼠关节软骨组织结构破坏严重,表层明显变薄,形成裂隙深达钙化层,表层细胞缺失,深层细胞排列紊乱,细胞及细胞核明显受到压缩;可见大量炎性细胞浸润。AT 低、中、高剂量组大鼠关节软骨组织结构受损现象得到改善,表层逐渐平整,结构基本清晰,偶见微小裂隙,骨细胞及细胞核形态正常;炎性细胞浸润现象减少。见图1。
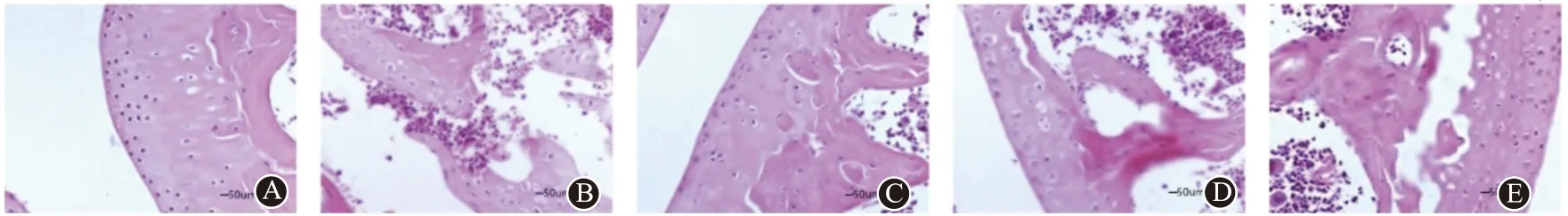
图1 软骨组织HE染色结果(×200):A为对照组;B为模型组;C为AT低剂量组;D为AT中剂量组;E为AT高剂量组
2.4 软骨组织细胞凋亡率比较与对照组(8.41±1.74)%比较,模型组大鼠软骨组织细胞凋亡率(47.82±4.26)%上升(P<0.05)。与模型组比较,AT低、中、高剂量组大鼠软骨组织细胞凋亡率[(32.05±2.84)%、(23.68±2.89)%、(12.15±2.13)%]下降(P<0.05)。与AT 低剂量组比较,AT 中、高剂量组大鼠软骨组织细胞凋亡率下降(P<0.05)。与CA 中剂量组比较,AT高剂量组大鼠软骨组织细胞凋亡率下降(P<0.05)。见图2。

图2 软骨组织TUNEL染色结果(×200):A为对照组;B为模型组;C为AT低剂量组;D为AT中剂量组;E为AT高剂量组
2.5 miR-98-5p、HMGA2、GSK-3β mRNA 水平比较与对照组比较,模型组大鼠软骨组织miR-98-5p表达水平升高,HMGA2、GSK-3β mRNA 水平降低(P<0.05)。与模型组比,AT 低、中、高剂量组大鼠软骨组织miR-98-5p 表达水平降低,HMGA2、GSK-3β mRNA 表达水平均升高(P<0.05)。与AT 低剂量组比较,AT中、高剂量组大鼠软骨组织miR-98-5p表达水平降低,HMGA2、GSK-3β mRNA 表达水平升高(P<0.05)。与AT 中剂量组比,AT 高剂量组miR-98-5p 水平降低,HMGA2、GSK-3β mRNA 水平升高(P<0.05)。见表3。
表3 大鼠miR-98-5p及HMGA2、GSK-3β mRNA水平比较/

表3 大鼠miR-98-5p及HMGA2、GSK-3β mRNA水平比较/
注:HMGA2为高迁移率族蛋白2,GSK-3β为糖原合成酶激酶-3β。①与对照组比,P<0.05。②与模型组比,P<0.05。③与AT 低剂量组比,P<0.05。④与AT中剂量组比,P<0.05。
?
2.6 HMGA2、GSK-3β、Bax、Bcl-2 蛋白水平比较与对照组比,模型组HMGA2、GSK-3β、Bcl-2 蛋白水平降低,Bax 蛋白水平升高(P<0.05)。与模型组比,AT 低、中、高剂量组大鼠软骨组织HMGA2、GSK-3β、Bcl-2 蛋白表达水平升高,Bax 蛋白表达水平降低(P<0.05)。与AT 低剂量组比较,AT 中、高剂量组大鼠软骨组织HMGA2、GSK-3β、Bcl-2 蛋白表达水平升高,Bax 蛋白表达水平降低(P<0.05)。与AT 中剂量组比较,AT 高剂量组大鼠软骨组织HMGA2、GSK-3β、Bcl-2 蛋白表达水平升高,Bax 蛋白表达水平降低(P<0.05)。见表4,图3。

图3 软骨组织蛋白检测
表4 大鼠HMGA2、GSK-3β、Bax、Bcl-2 蛋白水平比较/

表4 大鼠HMGA2、GSK-3β、Bax、Bcl-2 蛋白水平比较/
注:HMGA2为高迁移率族蛋白2,GSK-3β为糖原合成酶激酶-3β,Bax为Bcl-2相关蛋白,Bcl-2为B细胞淋巴瘤因子2。①与对照组比,P<0.05。②与模型组比,P<0.05。③与AT低剂量组比,P<0.05。④与AT中剂量组比,P<0.05。
?
3 讨论
关节软骨作为骨与骨之间的联合,可将外界对人体的作用力均匀分布,人的所有运动都离不开关节软骨的负荷[10]。研究表明,关节炎是在机械和生物因素共同影响下,引发软骨基质降解、软骨细胞自身代谢紊乱的退行性疾病[11]。关节软骨由基质与软骨细胞组成,软骨组织需靠仅占组织1/10 的软骨细胞进行正常代谢,所以代谢缓慢和修复能力低都使OA 难以完全治愈,一旦发病会将不断反复发作,疼痛难忍[12]。目前现代医学的医治方法主要以非甾性抗炎药为主,但非甾性抗炎药对肠胃的毒副作用明显,因此,寻找更加安全、毒副作用低的药物对OA临床治疗有着重大意义[13]。
AT 是提取自菊科植物白术根茎的生物活性成分,是一种倍半萜烯类化合物。现代药理学研究证实了AT 具有多种药理活性,包括抗炎、抗病毒、抗溃疡、保肝及抗肿瘤等[14]。中医学对OA 的研究极为久远,已有研究发现,AT 可代替非甾性药物对软骨损伤修复有着良好效用[15]。横断前后交叉韧带和切除半月板造模方法可引起软骨表面缺失、表层基质缺陷、软骨细胞代谢紊乱等改变,与OA 病人临床表现十分贴近,是公认的OA 造模方法[16]。故本研究建立OA 大鼠模型,结果显示,模型组大鼠软骨组织学Mankin's评分降低,血清TNF-α、IL-1β、IL-6、细胞凋亡率水平上升,表明模型组大鼠软骨组织受到损伤且伴有炎症反应,在给予不同剂量AT 治疗后上述指标水平降低,提示AT 可缓解大鼠体内炎症反应,修复软骨损伤。此外,软骨组织HE 染色和TUNEL 染色结果也表明软骨各基层结构受损现象得到改善,细胞肿胀、炎性细胞浸润现象和软骨细胞凋亡现象明显减少,进一步证实AT 可以抑制软骨细胞的凋亡,对软骨组织损伤具有修复作用。
在本研究中,模型组大鼠软骨组织miR-98-5p表达水平升高,HMGA2 和GSK-3β 基因表达和蛋白表达水平明显降低,同时研究发现,模型组大鼠促凋亡蛋白Bax 蛋白表达水平升高,且抑凋亡蛋白Bcl-2 表达降低。结合模型组大鼠软骨细胞凋亡率升高,表明模型组大鼠软骨组织受到损伤后,体内miR-98-5p 水平骤然升高,HMGA2/GSK-3β 信号通路被激活,细胞凋亡与抑凋亡平衡被打破,导致大量骨细胞凋亡流失。微小RNA(microRNA, miR⁃NA)是一种由19~25 个核苷酸组成的非编码小RNA,参与机体内细胞增殖、分化、迁移、凋亡等生理过程。miR-98-5p 是miRNAs 家族在肿瘤和骨骼方向倍受关注的成员之一,其可以通过抑制HM⁃GA2表达抑制细胞凋亡,GSK-3β是一种多功能丝氨酸/苏氨酸激酶,可调节能量代谢、细胞生长和凋亡,是HMGA2 反向底物和效应器[17]。miR-98-5p/HM⁃GA2/GSK-3β 轴是调控骨细胞生长的重要通路,在正常的生理状态下维持着骨组织的动态平衡[18]。与模型组比较,AT 各剂量组大鼠软骨组织miR-98-5p 表达、Bax 蛋白表达水平降低,HMGA2、GSK-3β mRNA 和Bcl-2 蛋白表达水平均升高。结合大鼠软骨组织细胞凋亡率变化,可见AT 能够干扰miR-98-5p 促进HMGA2、GSK-3β 蛋白表达抑制软骨细胞凋亡,对大鼠软骨损伤有积极影响。
综上所述,AT 能够调整OA 大鼠血清炎性因子水平,抑制软骨细胞凋亡,可能是通过干扰miR-98-5p,促进HMGA2、GSK-3β 蛋白表达发挥作用,为临床治疗OA提供实验依据。
(本文图1,2见插图8-1)

