基于网络药理学和分子对接探讨甘草治疗异位性皮炎的作用机制
杨素青,沈成英,周莉华,李靖阳,申宝德,胡建新
作者单位:1江西省人民医院(南昌医学院第一附属医院)药学部,江西 南昌 330006;
2南昌大学药学院,江西 南昌 330036;
3江西中医药大学现代中药制剂教育部重点实验室,江西 南昌 330004
异位性皮炎(atopic dermatitis, AD),又称特应性皮炎或异位性湿疹,是临床上常见的一种皮肤屏障破坏、免疫功能失调的慢性炎症性皮肤病[1]。已有研究[2]表明,全球AD病人数高达2.3亿,儿童发病率为15%~25%,成人患病率约为1%~10%。AD 病因复杂,反复发作,难以治愈,且常引发严重的并发症。目前,临床治疗AD 的常用药物糖皮质激素、抗组胺药物及免疫抑制剂等长期使用副作用大,病人依从性差[3]。近年来,传统中药在治疗慢性复杂疾病过程中发挥了举足轻重的作用,具有治疗效果理想及毒副作用较低等优势。其中,甘草因具有抗炎、免疫调节、皮质激素样等作用,在皮肤科学领域得到广泛应用[4]。甘草及其活性成分制剂作为经验用药在临床上被广泛应用于治疗AD,且效果显著[5-6]。然而,甘草治疗AD 的药效物质基础及作用机制等尚不明确。
鉴于中药治疗疾病具有多成分、多靶点、多途径的特性,基于实验的方法对其进行靶点鉴定和分子机制分析成本往往较为昂贵,费时费力,且对仪器设备等实验条件要求较高[7-8]。如果中药的潜在靶点蛋白不能被锁定在较小空间范围内,则需要重复进行大量的高难度实验筛选工作。随着计算机和公共的化学基因组学数据库的发展,中药网络药理学技术逐渐兴起,它可以利用各种靶点预测方法找出与中药成分作用概率大的一系列蛋白质,加速整个中药作用机制的阐述过程[9-11]。然而,现有的中药网络药理学研究模式存在一些不足。例如,收集中药化学成分的来源过于单一或毫无文献验证及成分过滤信息,导致收集的成分信息不可靠或筛选出的药理活性成分对抗该疾病无选择性等;靶点预测的方法单一(例如广泛应用的TCMSP[12],Swis⁃sTargetPrediction[13]),由于每种方法的算法以及描述的分子维度不同,单用一种方法极易导致较大的预测偏差。因此,本研究自2021 年9 月至2022 年4 月通过泛干扰化合物过滤、物理性质过滤、ADME 评估、毒性评估等获得高质量高可信度的甘草潜在活性成分,利用多平台、多尺度的靶点预测工具,借助中药网络药理学及分子对接技术,对甘草治疗AD的主要活性成分及作用靶点进行数据挖掘,初步解析其治疗AD的物质基础和作用机制。
1 材料与方法
1.1.1 泛干扰化合物过滤PAINS:意指泛干扰化合物,即高通量筛选中呈现阳性结果的频繁命中化合物(frequent hitter, FH),该类化合物对多数靶点具有相互作用[14]。使用python 包Scopy 对成分进行过滤。
1.1.2 成药性过滤(1)Lipinski 五规则与Pfizer 规则:Lipinski 五规则和Pfizer 规则可作为类药性的判断标准。Lipinski 五规则包括分子量<500;氢键给体数目<5;氢键受体数目<10;脂水分配系数<5;旋转键的数量≤10。Pfizer 规则包括log P>3;极性表面积(topological polar surface area,TPSA)<75。去除不符合Pfizer 规则并且违反Lipinski 五规则中三项规则的成分。
(2)ADME 评估:采用薛定谔Shordinger 软件的QikProp 模块计算上述过滤后成分的吸收、分布、代谢、排泄(absorption, distribution,metabolism,excre⁃tion,ADME)性质,包括脂溶性QPlogo/w(Octanol/Water Partition Coefficient),水溶性QPlogS(aqueous solubility),细胞渗透率QPPcaco(Apparent Caco-2 Cell Permeability in nm/sec),人类口服吸收率(per⁃cent human oral absorption,HOA)。按照建议的QPlogo/w-2.0~6.5,QPlogS-6.5~0.5,QPPcaco>500,HOA>80% 原则进行过滤,去除违反ADME 性质>3条的成分。
1.1.3 毒性过滤将上述原则过滤后的成分使用ADMET Lab 2.0(https://admetmesh.scbdd.com/)中的毒性模块进行预测[15],包括hERG 毒性,肝毒性(the human hepatotoxicity,H-HT),药源性肝损伤(druginduced liver injury,DILI),致畸性(AMES toxicity),大鼠口服急性毒性(rat oral acute toxicity,ROA),移除符合毒性规则>2的成分。
1.1.4 基于经验的过滤手动检查删除长链烷烃/不饱和脂肪酸等经验认为无活性意义的成分。
1.2 甘草活性成分靶点预测通过4 种常用的基于配体的靶点预测平台SEA (http://sea.bkslab.org/search/),SwissTargetPrediction (http://www.swisstar⁃getprediction.ch/) ,Poly pharmacology Browser PPB2(http://ppb2.gdb.tools/)和TargetNet (http://targetnet.scbdd.com/), 对筛选得到的甘草活性成分进行靶点预测,以获取甘草发挥抗AD可能的作用途径。
瓷贴面修复,因其色泽稳定、对牙龈无刺激、牙体预备量少等优点,已被广泛应用于临床中[1]。传统的修复方法,主要依靠肉眼观察及手工来完成,存在一定的误差,既增加了患者的每次就诊的时间和就诊次数,又降低了患者的舒适程度。随着科技的发展及口腔技术的改革创新,数字化技术在口腔领域中逐渐被广泛应用,目前口腔医生已可采用数字化技术制作出更精确的全瓷贴面修复体[2],在时间效率、制作精度和患者舒适度方面显示出了更多的优势。本研究对数字化方法和传统方法制作的全瓷贴面的临床疗效进行了观察。
由于不同的靶点预测平台展示预测结果的靶点注释ID 各不相同,如SEA 采用Entry name,PPB2采用ChEMBL ID,SwissTargetPrediction 和TargetNet采用UniProt ID( 如Tankyrase-1,Entry name:TNKS1_HUMAN,ChEMBL ID: CHEMBL6164,Uni⁃Prot ID: O95271)。因此,我们通过Python 包进行网络爬取与ID 转换获取所有预测靶点的注释信息,注释信息包含ChEMBL ID、UniProt ID、Entry name,基因名称。其中基因名称为标准注释信息。
1.3 AD 潜在靶点收集通过OMIM(https://www.ncbi.nlm.nih.gov/omim)和GeneCards 5.0(https://www.genecards.org/)数据库,以“Atopic Dermatitis”为关键词,检索AD 相关的治疗靶点。通过合并两个数据库收录的靶点,再据文献调研与经验判断进一步筛选得到AD潜在靶点基因。
1.4 “中药-成分-靶点”网络构建利用Python代码将活性成分在每个网站预测到的靶点都转换为基因名称,然后对四个网站的预测结果进行合并得到该成分的预测靶点。将甘草所有活性成分的预测靶点与AD 潜在靶点取交集靶点,即得到甘草成分抗AD潜在靶点。将获取的活性成分-蛋白靶点的相关数据导入Cytoscape 3.9.0 软件构建可视化的“中药-成分-靶点”网络。
1.5 生物通路富集分析及“中药-靶点-通路”网络构建为说明预测出的抗AD 靶点在基因功能中的作用,采用DAVID V6.8 数据库(https://david.ncifcrf.gov/)进行基因本体论(gene ontology,GO)和京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes, KEGG)功能注释和富集分析。GO 功能富集分析是为了进一步分析甘草活性成分的抗AD 潜在靶点蛋白在基因功能中拟发挥的作用。将研究物种限定为人类(homo sapiens),选择生物过程(biological process, BP)、细胞组成(cellular compo⁃nent, CC)和分子功能(molecular function, MF)三个部分来进行分析,以P<0.05 为筛选条件,对富集结果按照P值由小到大排序;KEGG 通路富集分析是分析甘草活性成分的靶点蛋白是通过何种通路发挥抗AD 的作用。对KEGG 分析得到的前30 条主要靶点和潜在信号通路绘制气泡图。最后通过Cyto⁃scape 3.9.0 软件构建与AD 密切相关的前30 个“中药-靶点-通路”网络图。
1.6 蛋白-蛋白相互作用网络构建将“1.4”项下筛选得到的甘草治疗AD 的潜在靶点信息导入String数据库(https://string-db.org/),限定物种为“Homo sapiens”,以置信度>0.4 为筛选条件,获得靶点间的蛋白相互作用(protein-protein interaction,PPI)数据,再将此数据导入Cytoscape 3.9.0软件构建PPI网络。
1.7 “中药-成分-靶点-通路”网络构建及核心靶点筛选通过整合“中药-活性成分-靶点”网络、“中药-靶点-通路”网络和PPI 网络构建“中药-成分-靶点-通路”网络,结合每个网络中节点度靠前的靶点蛋白,筛选出甘草抗AD的核心靶点。
1.8 活性成分-核心靶点分子对接从RCSB Pro⁃tein Data Bank 数据库获取核心靶点的蛋白三维结构,选取各个蛋白三维结构的PDB ID,选取蛋白的标准包括:(1)蛋白-配体复合物中的配体结构与本文中的核心成分结构大小相近;(2)X线衍射的分辨率 ≤ 2.5 Å,并对蛋白进行包括质子化、用缺失的原子补全残基、并选择替代位置等处理;然后使用MOE软件wash模块对每个活性成分进行预处理,包括去除金属离子、去质子化、加氢等;再采用MOE软件对接,每个化合物生成30 个构象,并应用基于力场的积分函数GBVI/WSA dG 对结合姿势的自由能进行打分,所有其他参数都保持默认值;最后,取打分值最高的构象重新对接到相应的蛋白晶体结构中,使用MOE 软件对结合姿势、结合构象和相互作用模式进行可视化。
2 结果
2.1 甘草活性成分通过文献报道及TCMSID数据库,共收集到甘草已知成分212 种。依次通过泛干扰化合物过滤(剩余174个成分)、成药性过滤(剩余73 个成分)、毒性过滤(剩余49 个成分)以及经验过滤,最终获得甘草的46个活性成分。
2.2 甘草活性成分靶点预测通过SEA、SwissTar⁃getPrediction、PPB2 和TargetNet 软件对甘草筛选获得的46 个化合物进行靶点预测。首先,保留这46个成分在每个预测平台的前10个预测靶点(每个方法各获得预测靶点460个)。其次,为了进一步缩小靶点空间以及获得更可信的靶点,采用更严苛的靶点过滤规则进行挑选,即靶点被多个预测软件同时预测或预测得分较高才被认为是成分的潜在靶点,经过筛选共得到甘草46 个活性成分的149 个预测靶点。
2.3 AD 潜在靶点通过OMIM 和GeneCards5.0 数据库,以“Atopic Dermatitis”为关键词,检索AD 相关的治疗靶点。其中,GeneCards 5.0 以相关性数值(Relevance score≥中位数)作为筛选条件。通过合并两个数据库收录的靶点,再据文献调研与经验判断进一步筛选得到AD潜在靶点基因404个。
2.4 甘草的“中药-化学成分-靶点”网络构建将46个化合物预测到的靶点与AD 潜在靶点取交集靶点,即得到甘草的AD 潜在靶点共47 个。甘草中共29个成分与这些蛋白具有相互作用(另外17个成分并未预测到AD相关靶点),涉及的成分-蛋白相互作用关系对共157对。潜在活性成分的物理化学性质见表1。使用预测到的相互作用数据,借助Cyto⁃scape 3.9.0软件构建的“中药-成分-靶点”网络图,见图1。图中方形为甘草的29 个活性成分,圆形为这些成分潜在的作用靶点,每个点的大小代表其在网络图中的节点度,即方形的大小代表成分被靶点命中的个数多少,圆形的大小代表靶点被成分命中的个数多少。
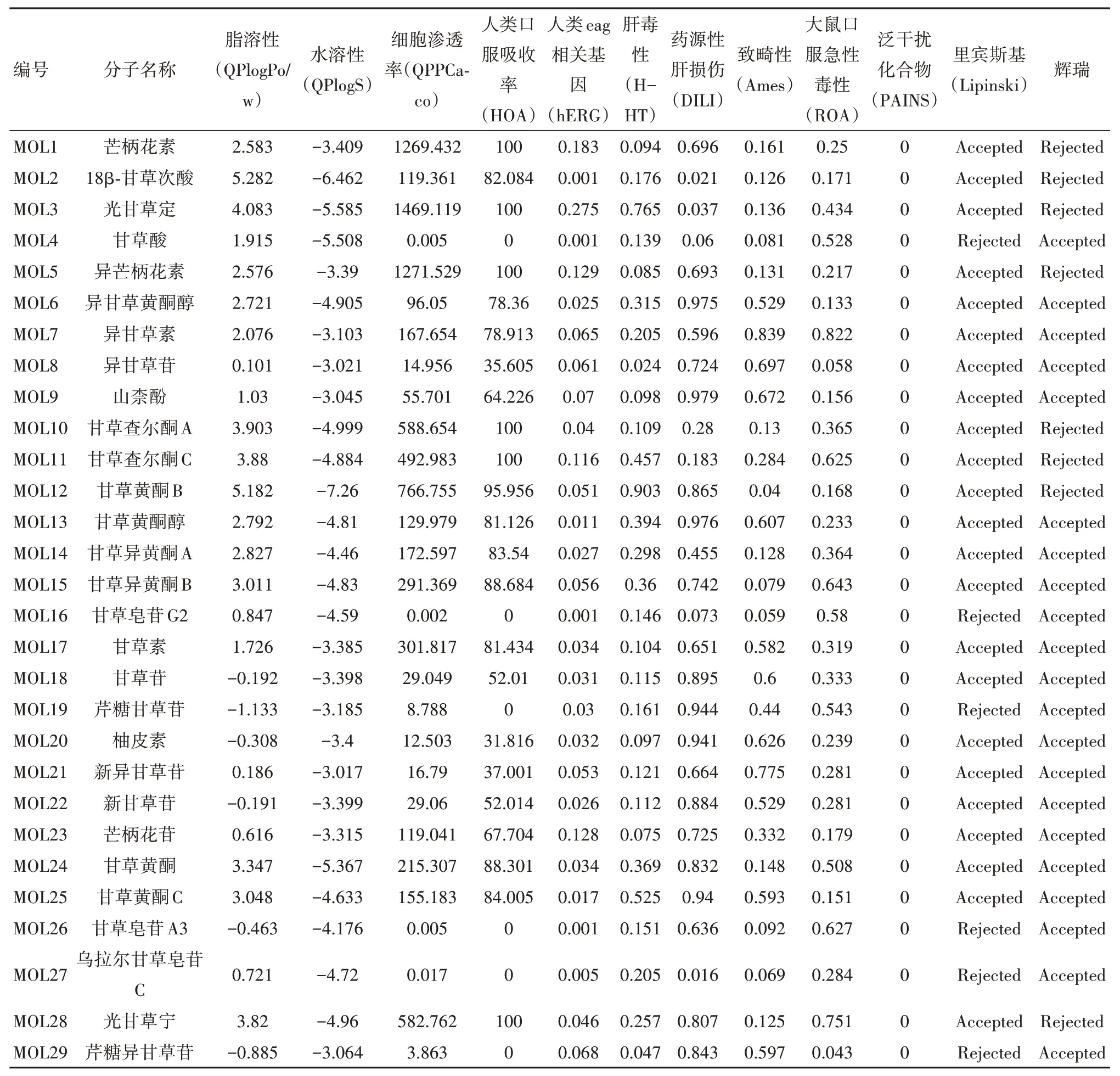
表1 筛选出的甘草活性成分的理化性质
由图1可推知甘草中的化学成分通过调节多个蛋白来发挥药理活性作用。网络中节点度排名靠前的成分依次为甘草查尔酮C(MOL11,节点度值为13)、甘草查尔酮A(MOL10,节点度值为12)、异甘草黄酮醇(MOL6,节点度值为12)、光甘草定(MOL3,节点度值为11)、光甘草宁(MOL28,节点度值为10)、甘草黄酮醇(MOL13,节点度值为9)、甘草黄酮C(MOL25,节点度值为8)、异芒柄花素(MOL5,节点度值为8)、异甘草素(MOL7,节点度值为8)、芒柄花素(MOL1,节点度值为8)、山柰酚(MOL9,节点度值为6)、异甘草苷(MOL8,节点度值为5)、甘草酸(MOL4,节点度值为5)、芒柄花苷(MOL23,节点度值5);被成分命中较多的靶点依次是ALOX5(Ara⁃chidonate 5-Lipoxygenase,节点度值为12)、EGFR(epidermal growth factor receptor,节点度值为10)、PPARG (peroxisome proliferator-activated receptor gamma,节点度值为9)、MIF(macrophage migration inhibitory factor,节点度值为9)、PTGS2(prostaglan⁃din-endoperoxide synthase 2,节点度值为9)、TLR9(toll like receptor 9,节点度值为9)、AHR(aryl hydro⁃carbon receptor,节点度值为9)、IL-2(Interleukin-2,节点度值为8)。
2.5 生物通路富集分析及“中药-靶点-通路”网络构建我们利用DAVID V6.8 数据库(https://david.ncifcrf.gov/)对上述47 个潜在抗AD 靶点进行GO 和KEGG通路富集分析。GO富集分析后共获得291个条目,其中,BP 结果包含217 个条目,主要涉及炎症反应、基因表达的正向调节、凋亡过程负调控、MAP激酶活性的正向调节以及肽基丝氨酸磷酸化的正向调控等多种细胞凋亡反应;CC 结果包含29 个条目,主要涉及细胞外空间、膜筏、细胞表面、胞外区、质膜外侧、细胞质基质以及细胞核的构成;MF 结果包含45 个条目,主要涉及相同的蛋白结合、受体信号转导蛋白酪氨酸激酶、蛋白磷酸酶结合、蛋白结合、磷脂酰肌醇-4,5-二磷酸3-激酶活性以趋化因子受体活性等。选取GO 富集分析中每个类别的排名靠前项绘制柱状图,见图2A。
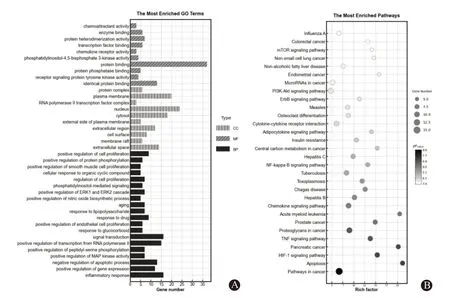
图2 预测蛋白的富集分析结果:A为GO生物学功能;B为KEGG通路
KEGG 通路富集分析结果显示,设定生物信号通路P<0.05,共获得75条信号通路。将所获得通路以−logP值转换的P值排序,选取富集程度前30 条绘制高级气泡图,见图2B。分析KEGG 结果可知,甘草参与抗AD 主要有缺氧诱导因子1(HIF-1)、肿瘤坏死因子(TNF)、核因子-κB(NF-κB)信号通路等。
通过KEGG 数据构建的甘草“中药-靶点-通路”网络图见图3,其中节点度排名靠前的10 个基因是PIK3CA(phosphatidylinositol-4,5-bisphosphate 3-ki⁃nase catalytic subunit alpha,节点度值为55)、AKT1(AKT serine/threonine kinase 1,节点度 值为55)、RELA(Nuclear factor NF-kappa-B p65 subunit,节点度值为44)、TNF(tumor necrosis factor,节点度值为38)、BRAF(serine/threonine-protein kinase B-raf,节点度值为27)、EGFR(epidermal growth factor recep⁃tor,节点度值为22)、CASP3(caspase 3,节点度值为24)、MTOR(mechanistic target of rapamycin kinase,节点度值为21)、STAT3(signal transducer and activa⁃tor of transcription 3,节点度值为19)。
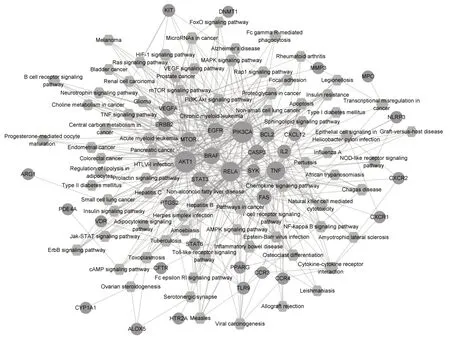
图3 甘草“中药-靶点-通路”网络图
2.6 PPI 网络分析通过String 数据库和Cytoscape 3.9.0软件针对所获得的潜在靶点构建PPI网络。甘草潜在靶点间相互作用的平均节点度值为15.4,其中大于平均度值靶点共22 个。PPI 网络包含47 个节点和362 条边。PPI 网络显示,TNF(Tumor Necro⁃sis Factor,节点度值为38)、AKT1(AKT Serine/Threo⁃nine Kinase 1,节点度值为36)、IL-2(Interleukin-1,节点度值为32)、VEGFA(vascular endothelial growth factor receptor,节点度值为32)、STAT3(signal trans⁃ducer and activator of transcription 3,节点度值为30)、EGFR(epidermal growth factor receptor,节点度值为29)、PTGS2(prostaglandin-endoperoxide syn⁃thase 2,节点度值为28)、CXCL12(C-X-C Motif Che⁃mokine Ligand 12,节点度值为26)、CASP3(Caspase 3,节点度值为24)、MTOR(mechanistic target of rapa⁃mycin kinase,节点度值为20)等靶点为PPI 网络的中心节点,节点度值较高。
2.7 “中药-成分-靶点-通路”网络构建及核心靶点筛选通过整合“中药-成分-靶点”网络、“中药-靶点-通路”网络和PPI 网络构建“中药-成分-靶点-通路”网络。结合每个网络中节点度靠前的靶点蛋白,筛选出甘草抗AD 的核心靶点用于后续的分子对接。其中,“中药-成分-靶点”网络获得核心靶点9个、“中药-靶点-通路”网络获得10 个核心靶点、PPI网络获得核心靶点22个。通过靶点去重,共获得核心靶点24个。
2.8 活性成分-核心靶点分子对接对筛选得到的29 个有效成分和22 个核心靶点(核心靶点中,除TLR9 与STAT6 外,TLR9 无人类相关的蛋白晶体结构,STAT6 蛋白无口袋对接)进行分子对接,核心蛋白基本信息见表2。为了从分子水平阐明蛋白和化合物的作用模式,将化合物对接至蛋白的活性口袋,29 个分子与这22 个核心蛋白的平均亲和力S 值为(−6.61±0.79)kJ/mol,证明这些成分与蛋白之间具有比较强的结合亲和力[16]。
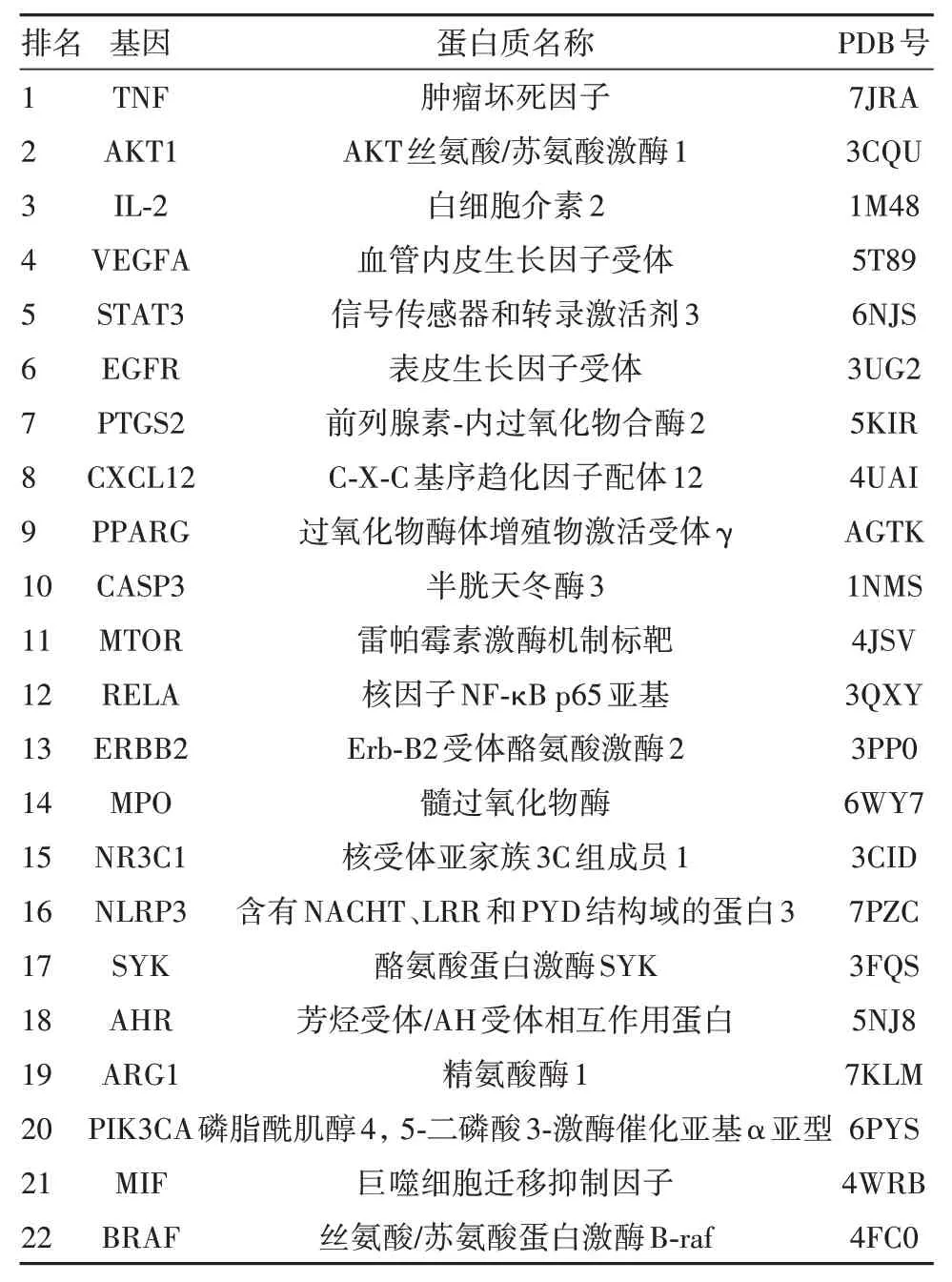
表2 分子对接蛋白信息
此外,我们绘制结合亲和力强的成分-蛋白对接示意图和相互作用模式图进行分析,包括光甘草定-EGFR,光甘草定-IL-2,甘草酸-EGFR,甘草酸-IL-2,甘草酸-PTGS2,甘草酸-TNF,异甘草素-IL-2,异甘草素-AKT1,这些成分与蛋白之间均形成了数目不等的氢键。
光甘草定结合到EGFR 蛋白活性位点,与活性对接口袋的氨基酸残基Leu 718 形成氢键相互作用,另外与氨基酸残基Pro 794 形成PI-cation 相互作用。光甘草定结合到IL-2 蛋白活性位点,与活性对接口袋的氨基酸残基Thr 41 形成氢键相互作用,另外与氨基酸残基Leu 72形成PI-cation相互作用。甘草酸结合到EGFR 蛋白活性位点,与活性对接口袋的氨基酸残基His 805、Lys 745、Met 790 形成3 个氢键相互作用。甘草酸结合到IL-2 蛋白活性位点,与活性对接口袋的氨基酸残基Arg 38、Glu 62 形成两个氢键相互作用,另外与氨基酸残基Leu 72、Phe 42形成PI-cation相互作用。甘草酸结合到PTGS2蛋白活性位点,与活性对接口袋的氨基酸残基His207、Asn 382、Tyr 385 形成4 个氢键相互作用,另外与氨基酸残基Leu 72、Phe 42 形成PI-cation 相互作用。甘草酸结合到TNF 蛋白活性位点,与活性对接口袋的氨基酸残基Tyr 195、Tyr 135形成PI-cation 相互作用。异甘草酸结合到AKT1 蛋白活性位点,与活性对接口袋的氨基酸残基Glu 228形成氢键相互作用,另外与氨基酸残基Met 281形成PI-cation相互作用。异甘草酸结合到IL-2 蛋白活性位点,与活性对接口袋的氨基酸残基Arg 38 形成氢键相互作用,另外与两个氨基酸残基Leu 71、Phe 42 形成PI-cation 相互作用。
3 讨论
本研究针对网络药理学现有方法在收集中药化学成分的来源、成分过滤方法以及靶点预测方法单一的不足,提出了利用泛干扰化合物过滤、物理性质过滤、ADME评估、毒性评估等方法收集高质量高可信度的中药活性成分,并结合多平台多尺度的分子靶点预测工具,充分利用每种方法的优势提高预测能力,以得到更加客观公正有效的甘草抗AD活性成分及其作用机制。
我们的研究结果显示,甘草抗AD 的潜在活性成分共29 个,靶向47 个潜在的AD 靶点。“中药-成分-靶点”网络中节点度值靠前成分主要有甘草查尔酮C、甘草查尔酮A、异甘草黄酮醇、光甘草定、光甘草宁、甘草黄酮醇、甘草黄酮C、异芒柄花素、异甘草素、芒柄花素、山柰酚、异甘草苷、甘草酸等。现有研究表明,甘草酸可通过抑制HMGB1-RAGE 表达,进而抑制PI3K/AKT/NF-κB 和ERK/NF-κB 信号通路的表达,减少TNF-α、IL-6 等炎性因子的释放以减轻DNCB 诱导的小鼠AD 皮损样症状[17]。异甘草素可通过抑制DNCB 诱导AD 模型小鼠血液中IgE 和Th2细胞因子上调,抑制皮损部位的促炎症细胞因子如TNF-α、IL-6 以及IL-4 的表达,发挥治疗AD 作用[18]。甘草查尔酮C 具有抗炎作用,可通过调节PI3K/Akt/eNOS和NF-κB/iNOS/NO 信号通路、降低炎性因子的释放,以减轻AD临床症状[19]。此外,甘草查尔酮A、光甘草定等均具有较好的抗炎作用[20],这说明甘草抗AD 可能是通过多种成分进行共同调控。此外,异甘草黄酮醇、光甘草宁、甘草黄酮醇、甘草黄酮C、异芒柄花素、异甘草苷等成分对AD 的治疗作用尚未得到证实,这为甘草治疗AD 的作用机制给出了新的潜在化合物。
通过对47 个靶点蛋白进行KEGG 通路富集分析,“中药-靶点-通路”网络结果显示甘草获得的这47 个潜在靶点靶向AD 的通路主要涉及HIF-1、TNF、NF-κB 等信号通路,这些信号通路均与炎症免疫应答密切相关。AD 发病机制复杂,涉及遗传、环境、免疫紊乱、皮肤屏障受损等。HIF-1 是缺氧条件下广泛存在于哺乳动物和人体内的一种转录因子,是应答缺氧应激的关键因子,在生物发育、代谢、贫血、损伤修复等生理和病理过程中具有重要生物学意义[21],HIF-1α 表达的升高会破坏AD 皮肤的紧密连接,加重AD 皮损状态[22]。TNF 信号通路能够调节人体炎症反应、细胞凋亡与免疫应答,常常与NFκB信号通路构成TNF/NF-κB通路发挥上述作用[23]。NF-κB信号通路具有抗凋亡作用,可被炎症、自身免疫性疾病感染或者癌症激活[24],当AD 发生时,细胞因子与附近的血管内皮细胞受体结合,激活NF-κB信号级联反应,促进大量炎性因子的表达和释放[25];Sung 等[26]研究证明阻断NF-κB 信号通路可以改善AD 症状。总之,AD 的发病与上述通路密切相关,且本研究的富集分析结果也表明甘草活性成分的作用靶点与上述通路相关。
PPI 网络分析得到靶点-靶点间的相互作用,了解了蛋白与蛋白之间在参与生物信号传递、基因表达调节、能量和物质代谢及细胞周期调控等生命过程的各个环节的相互作用关系。通过整合“中药-活性成分-靶点”网络、“中药-靶点-通路”网络和PPI网络,得到“中药-成分-靶点-通路”网络,通过网络获得甘草对抗AD 的24 个核心靶点,主要有TNF、AKT1、IL-2、VEGFA、STAT3、EGFR、PTGS2、CX⁃CL12、CASP3、MTOR 等。将29 个潜在的活性成分与潜在靶点进行对接,对接亲和力结果显示,这些活性成分和潜在靶点之间的结合构型具有强烈的亲和活性和良好的相互作用模式。其中,甘草的主要活性成分如甘草酸与TNF、EGFR、PTGS2、IL-2 形成了数量不等的氢键,获得了较好的对接模式与较高亲和力;异甘草素与AKT1、IL-2 蛋白形成较好的对接模式与较高亲和力。光甘草定与EGFR、IL-2蛋白形成较好的对接模式与较高亲和力。有研究证实,TNF 可通过刺激免疫细胞分泌各种炎性因子从而促进炎症反应的发生;Liu 等[27]研究发现TNF超家族的TWEAK 可通过诱导Fn14 参与AD 炎症反应和角质形成细胞凋亡;AKT1 表达的降低能够引起角质形成细胞微丝聚集蛋白加工减少,使AD 皮肤屏障功能受损[28];AD 发生时,其他细胞因子会诱导VEGF 表达,加重AD 病情,如Chen 等[29]研究发现IL-6和 IFN-γ 能够诱导VEGF-A 表达升高,促进IL-4转基因AD 模型小鼠的皮肤微血管生成,进而加重AD症状;STAT3参与炎症、免疫、凋亡及细胞增殖等过程,可通过调节Th2 细胞分化、炎性因子分泌、刺激各种趋化因子等进而影响AD 病程[30];此外,IL-2[31]、PTGS2[32]、CXCL12[33]等均在AD 中检测到高表达,被证实是AD的重要靶点。
综上所述,本研究以临床常用药物—甘草为探讨对象,通过网络药理学及分子对接分析,初步论证了甘草治疗AD 是通过甘草酸、甘草查尔酮C、甘草查尔酮A、异甘草素、光甘草定等活性成分作用于TNF、AKT1、IL-2、VEGFA、STAT3、EGFR、PTGS2 等多种基因靶点,从而影响HIF-1 信号通路、TNF 信号通路、NF-κB信号通路等多种通路发挥作用,为进一步的实验研究奠定了基础。甘草抗AD 实验验证以及临床上与甘草多配伍其他药物的协同作用研究将是课题组接下来探索的出发点和拓展点。

