微RNA-223-3p调控NOD样受体热蛋白结构域3/胱天氨酸蛋白酶-1/白细胞介素-1β信号通路抗小鼠肝纤维化的作用及机制
胡毅翔,左清平,刘任祝,闫庆梓,邢琪昌,刘湘
作者单位:1湘潭市中心医院临床药学科,湖南 湘潭 411000;
2长沙市第一医院药剂科,湖南 长沙 410006
肝纤维化(hepatic fibrosis,HF)是指肝脏遭到各种致病原侵袭,引起肝脏损害与炎症反应后,导致过度的细胞外基质释放,进而诱导肝星状细胞活化以及肝脏组织纤维化的病理过程[1-2]。目前临床尚缺乏治疗肝纤维化的有效手段,导致部分病人进展为肝硬化,严重影响病人的生活质量[3]。MicroR⁃NAs (miRNAs)是一类高度保守且化学性质稳定的内源性非编码RNA,多项研究表明miRNA与多种类型的肝脏疾病的发病机制相关[4]。微小RNA-223-3p(miR-223-3p)具有多种生物学功能,可抑制肝纤维化的发生及进展[5]。NOD 样受体热蛋白结构域3(NLRP3)炎性体是NOD 样受体(NLRs)家族成员之一,同时也细胞焦亡的关键起始位点,对于肝纤维化的进展起促进作用[6]。活化的NLRP3炎症小体可将胱天氨酸天冬氨酸蛋白水解酶-1(Caspase-1)剪切成熟,进而促进反向效应分子裂解细胞膜,释放成熟形式的白细胞介素-1β(IL-1β)和IL-18,导致机体产生炎症,而IL-1β 作为早期的炎性细胞因子在炎症的发展过程中起重要作用[7]。本研究自2020 年10 月至2021 年6 月以质量浓度为40%四氯化碳(CCl4)腹腔注射诱导小鼠肝纤维化模型,以NLRP3/Caspase-1/IL-1β 信号通路为切入点,探究miR-223-3p对小鼠肝纤维化的影响与机制。
1 材料与方法
1.1 实验动物和分组本实验共计32只ICR小鼠,购自湖南斯莱克景达实验动物有限公司[许可证号SCXK(湘)2020-0006],体质量范围为18~20 g,所有小鼠均在同一实验室按照清洁级小鼠要求由专人饲养,保持室内温度为20~24 ℃,相对湿度50%,小鼠自由进食摄水,将32 只ICR 小鼠采用随机数字表法分为空白组、模型组、miR-223-3p 模拟物(miR-223-3p agomir)组和阴性对照miRNA 模拟物(agomir-NC)组,每组8 只。本研究符合一般动物实验伦理学原则,经湘潭市中心医院伦理委员会批准(批号2020-KY-25)。
1.2 试剂和仪器四氯化碳购于国药集团化学试剂有限公司(批号20200106),血清总胆红素(TBIL)、白蛋白(Alb)、血清透明质酸(HA)、Ⅲ型前胶原(PCⅢ)、Ⅳ型胶原(Ⅳ⁃C)购自南京建成生物工程研究所,批号分别为101547、105647、106784、106541、105861;NLRP3、Caspase-1、IL-1β 蛋白抗体购自美国Santa Cruz 公司,批号分别为S5201RTA、S5410RES、S2144RYU;PCR 引物、miR-223-3p agomir 模拟物(批号20201201)及阴性对照agomir-NC 和阴性对照(批号20201202)购自广州瑞博生物科技有限公司。
全自动酶标仪(型号WD-2102B,北京六一仪器有限公司),病理图像分析仪(型号OLYMPUSDP71,奥林巴斯中国有限公司),荧光定量PCR 仪(型号:IQ5,美国Bio-Rad 公司)凝胶成像仪(型号:Gel Doc EZ,美国Bio-Rad 公司),DLAB 高速微量离心机(型号:D1524R,北京大龙仪器有限公司)。
1.3 肝纤维化小鼠模型制备和给药将ICR 小鼠随机分为空白组、模型组、miR-223-3p agomir 组和NC antagomir 组,每组8 只,共32 只。建立小鼠肝纤维化模型,建模步骤:采用质量浓度为40% CCl4花生油溶液腹腔注射,2 mL/kg,每周3 次,连续4 周。miR-223-3p agomir 组和agomir-NC 组于第4 周末尾静脉注射miR-223-3p agomir及agomir-NC(给药剂量均为200 nmol/L),每周给药3 次,连续给药2 周,空白组和模型组尾静脉注射等量的生理盐水。
1.4 血清指标检测第6周末,各组小鼠禁食12 h,采用摘眼球取血法取血1 mL,于25 ℃静置0.5 h 后于3 600 r/min 离心10 min,分离血清收集上清液,将上清液装置干净的EP 管中进行分装,置于−80 ℃冰箱中保存备用。按照生化试剂盒操作步骤测定小鼠血清总胆红素(TBIL)、白蛋白(Alb)、血清透明质酸(HA)、Ⅲ型前胶原(PC Ⅲ)、Ⅳ型胶原(Ⅳ-C)含量。
1.5 HE染色及Masson染色小鼠处死后,将肝脏周围的韧带组织游离,把肝脏小心取出,在肝乳头叶处用剪刀剪下一块2 cm3的肝组织,甲醛固定后制作石蜡切片。依据HE 染色及Masson 染色试剂盒说明书处理组织,脱水封片后于显微镜下随机选取5个视野拍照,观察各组小鼠肝组织病理变化。
1.6 纤维化半定量评分用半定量计分系统(SSS)检测肝脏的纤维化程度,用胶原纤维面积密度对肝纤维程度进行分析[7]。(1)炎症活动度半定量计分公式为汇管区炎症(0~3 分)+小叶内炎症(0~3 分)+碎屑坏死(0~2分)+桥接坏死(0~2分);(2)纤维化半定量计分公式为小叶内炎症(0~3分)+汇管区炎症(0~3分)+纤维间隔数量×纤维间隔宽度(0~4分);(3)胶原纤维面积密度:用图像成像分析软件对每张切片的5个视野中的纤维面积密度进行测定。
1.7 miR-223-3p靶基因预测、GO-KEGG分析采用Targetscan 数据库(https://www.mirbase.org)对miR-223-3p 的靶基因进行预测及分析,通过Bioinfo数据库(http://bioinfo. jialab-ucr. org/CancerMIR⁃Nome/),将miR-223-3p 的治疗靶点导入,进行 GO、KEGG 富集分析及功能分析,获取miR-223-3p 相关生物进程(BP)、细胞组分(CC)、分子功能(MF)及KEGG富集分析数据,评价其生物学功能。
1.8 实时荧光定量PCR 检测分别取各组左叶的相同部位组织,超声粉碎,将组织用胰蛋白酶消化后加入总RNA 抽提试剂(Trizol)裂解提取总RNA,测定浓度及纯度,反转录成cDNA,引物序列如表1所示。cDNA 合成过程中采用特异性引物构建反转录体系,反应条件为:90 ℃预变性10 min,38 ℃40 min,90 ℃ 5 s。以甘油醛-3-磷酸脱氢酶(GAP⁃DH)为内参,采用2−ΔΔCt法对NLRP3、Caspase-1、IL-1β mRNA表达进行相对定量分析。

表1 引物序列表
1.9 蛋白质印迹法检测肝组织中NLRP3、Caspase-1、IL-1β 蛋白表达分别取4 组小鼠50 mg 肝组织,蛋白裂解液裂解,用玻璃均浆器在冰上对组织进行研磨,30 min 后以12 000 r/min 的速度离心5 min,测定蛋白浓度,每个加样孔加入60 µg 的蛋白进行分析。电泳2 h 后,采用湿法转膜至聚偏二氟乙烯膜(PVDF),将膜用5%脱脂奶粉封闭1 h,4 ℃孵育一抗(Santa Cruz;1∶1 000 稀释)过夜,次晨采用TBST漂洗膜,加入辣根过氧化物酶标记的二抗(Santa Cruz;1∶3 000 稀释),37 ℃孵育1 h,凝胶成像系统曝光成像,以GAPDH 为内参,采用Quantity One 软件测光密度值。
1.10 统计学方法采用SPSS 25.0 软件对数据进行统计学分析,计量资料符合正态分布,以表示,多组定量数据采用方差分析,组间两两比较采用SNK-q检验分析,以P<0.05 表示差异有统计学意义。
2 结果
2.1 肝纤维化相关血清标志物检测与空白组相比,肝纤维化模型组小鼠血清TBIL、Alb、HA、PCⅢ、Ⅳ-C 表达水平均显著升高(P<0.05),与模型组相比,miR-223-3p agomir 组小鼠血清TBIL、Alb、HA、PCⅢ、Ⅳ-C 均明显降低,差异有统计学意义(P<0.05),提示miR-223-3p agomir 可降低小鼠血清肝纤维化指标TBIL、Alb、HA、PCⅢ、Ⅳ-C 的表达水平。见表2。
表2 AF对肝纤维化小鼠血清生化指标的影响/
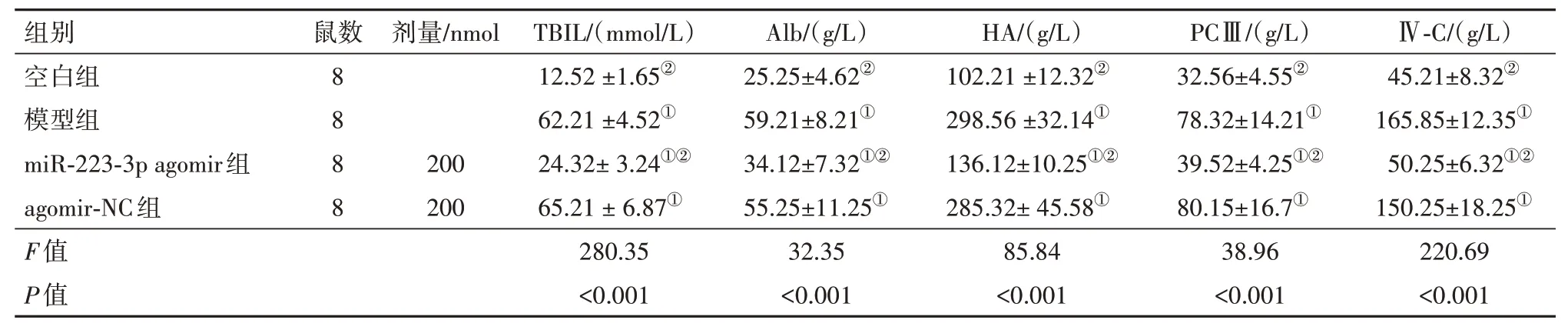
表2 AF对肝纤维化小鼠血清生化指标的影响/
注:TBIL为血清总胆红素、Alb为白蛋白、HA为血清透明质酸、PCⅢ为Ⅲ型前胶原、Ⅳ-C为Ⅳ型胶原。①与空白组比较,P<0.001。②与模型组比较,P<0.001。
?
2.2 各组小鼠肝组织HE 染色比较HE 染色结果如图1所示,相较于空白组,模型组小鼠肝小叶结构受损,组织切片中有大量假小叶形成,坏死病灶面积较大,大量的炎性细胞浸润到肝组织中,细胞排列较乱无规则。给予miR-223-3p agomir 干预后,小鼠肝小叶炎症浸润情况明显改善,肝组织内浸润的炎性细胞明显减少,坏死病灶也显著减少,大多数的肝细胞都整齐排列,肝小叶结构有所恢复,说明miR-223-3p agomir 能明显抑制肝纤维化的进展,减少炎症细胞浸润。

图1 小鼠肝组织(HE染色×100):A为空白组;B为模型组;C为miR-223-3p agomir组;D为agomir-NC组
2.3 各组小鼠肝组织Masson染色比较Masson染色结果如图2所示,相较于空白组,模型组大量炎性细胞浸润导致小鼠肝小叶正常结构受损,大量胶原及细胞外基质沉积导致肝细胞纤维化,胶原纤维增生严重。给予miR-223-3p agomir 干预后,相较于模型组,小鼠肝脏组织纤维化状态显著改善,肝小叶胶原及细胞外基质明显减少,局灶性坏死组织显著减少,从而抑制肝纤维化的形成与进展。

图2 小鼠肝组织(Masson三色染色×100):A为空白组;B为模型组;C为miR-223-3p agomir组;D为agomir-NC组
2.4 各组小鼠纤维化半定量评分比较纤维化半定量评分比较,模型组小鼠炎症活动度半定量评分、纤维化半定量评分和胶原纤维面积密度较sham组均显著升高(P<0.05);干预后的miR-223-3p agomir 组小鼠炎症活动度半定量评分、纤维化半定量评分和胶原纤维面积密度均得到了明显的抑制,较HF组显著降低(P<0.05)。见表3。
表3 各组小鼠肝组织纤维化半定量评分比较/

表3 各组小鼠肝组织纤维化半定量评分比较/
注:①与空白组比较,P<0.001。②与模型组比较,P<0.001。
?
2.5 miR-223-3p 靶基因结合位点及GO-KEGG 分析通过DAVID 数据库,获取miR-223-3p的治疗靶点及相关生物学过程分析结果。GO、KEGG 富集及miRNA-mRNA-KEGG 关联分析结果显示,miR-223-3p 可在炎症、T 细胞免疫、细胞周期等的59 个生命进程中发挥作用。KEGG 结果中治疗靶点共富集FOXO 信号通路、p53 信号通路、HIF-1 信号通路等12 条信号通路,根据P 值选出前30 位KEGG 的全部结果,对选定的GO、KEGG 结果中P值取−lgP,并作为横坐标,绘制GO、KEGG 条形图。Targetscan 数据库对miR-223-3p 靶基因预测结果显示NLRP3 可能为miR-223-3p 的反向靶基因(图3)。生物学靶点预测分析结果显示miR-223-3p 可靶向作用于NLRP3,结合位点如图4所示。

图3 富集分析图:A为GO生物学功能;B为KEGG通路

图4 miR-223-3p与靶基因NLRP3结合位点分析
2.6 实时荧光定量PCR 检测结果与空白组比较,模型组小鼠肝组织NLRP3、Caspase-1、IL-1β mRNA 表达水平明显上升(P<0.05),与模型组相比,给予miR-223-3p agomir 干预后,miR-223-3p agomir组小鼠肝组织中NLRP3、Caspase-1、IL-1β mRNA 表达[(1.24±0.12)比(2.17±0.14)、(1.44±0.11)比(2.65±0.18)、(1.31±0.13)比(1.97±0.21)]均显著下降,差异有统计学意义(P<0.05),而给予agomir-NC后,NLRP3、Caspase-1、IL-1β mRNA表达与模型组差异无统计学意义(P>0.05)。结果见表4。

表4 q-PCR法检测NLRP3、Caspase-1、IL-1β mRNA相对表达量
2.7 蛋白质印迹法检测结果蛋白质印迹法检测结果如图5、表5所示,与模型组比较,给予miR-223-3p agomir干预后,小鼠肝组织NLRP3、Caspase-1、IL-1β 蛋白表达[(0.89±0.05)比(1.93±0.04)、(1.29±0.07)比(2.15±0.09)、(1.50±0.05)比(2.52±0.12)]均显著下降,差异有统计学意义(P<0.05),而给予agomir-NC 后,NLRP3、Caspase-1、IL-1β mRNA 表达与模型组差异无统计学意义(P>0.05),表明miR-223-3p agomir 可抑制小鼠肝组织NLRP3、Caspase-1、IL-1β mRNA表达。

图5 蛋白质印迹法检测NLRP3、Caspase-1、IL-1β蛋白表达情况
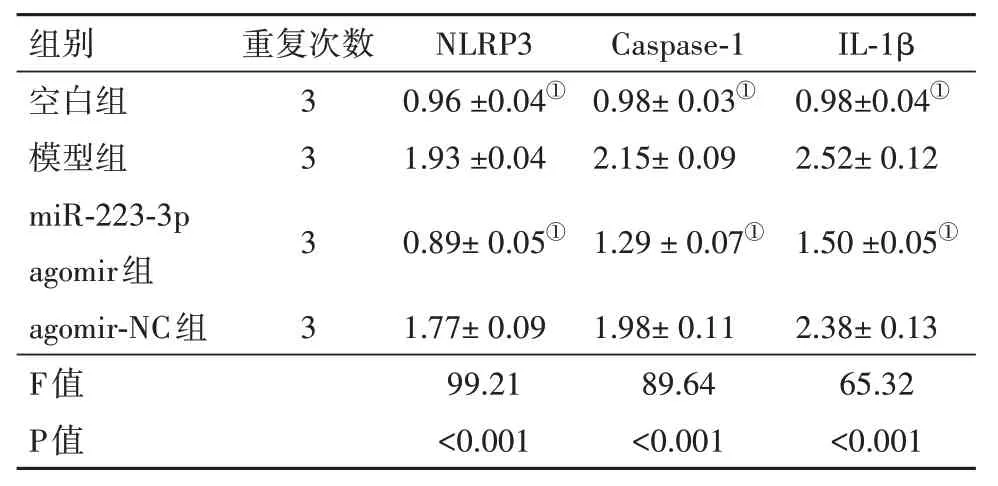
表5 q-PCR法检测NLRP3、Caspase-1、IL-1β蛋白相对表达量
3 讨论
炎症被认为是宿主对抗病原体的一种防御机制,在相关刺激下可产生炎症因子激活固有免疫。炎症小体是细胞内的一种大型多蛋白复合物,在识别病原体或危险信号后可介导炎症反应的起始,导致细胞膜裂解,释放多种炎性细胞因子诱导细胞焦亡的发生及进展[8-9]。NLRP3 炎症小体主要由NOD样受体NLRP3,衔接分子凋亡相关斑点样蛋白CARD(ASC)以及效应分子pro-caspase-1 组成[10]。在细胞内外刺激下,NLRP3 炎症小体被激活并剪切pro-caspase-1,诱导效应分子在细胞膜上形成直径为10~15 nm 的膜孔,进而导致IL-1β和IL-18释放到细胞外从而促进细胞焦亡的发生[11]。
肝纤维化早期阶段以多种炎性细胞因子和免疫细胞因子浸润为特征[12]。这一病理过程主要包括3个阶段:①愈合阶段,②炎症阶段,③重塑阶段。这一炎症过程主要由上皮细胞和内皮细胞介导,并触发炎症细胞(包括巨噬细胞、淋巴细胞、肥大细胞、嗜酸性粒细胞和嗜碱性粒细胞)的募集。NLRP3炎症小体表达于内皮细胞、免疫细胞、肝脏细胞等细胞中,NLRP3/Caspase-1/IL-1β 通路激活后可导致炎症细胞募集,通过分泌大量的炎症细胞因子加速肝细胞的炎症性死亡,进而导致肝纤维化的进展[13]。由于NLRP3 炎症小体在细胞焦亡中的重要调控作用,抑制其活化可能为肝纤维化提供潜在的治疗策略。MCC950是一种阻断NLRP3炎症小体活化的特异性小分子抑制剂。机制上,MCC950 直接与NLRP3 的NACHT 结构域结合,抑制腺嘌呤核苷三磷酸(ATP)水解,阻止NLRP3 炎症小体形成,阻断经典和非经典的性NLRP3活化通路[14-15]。研究显示,miRNA 具有多种生物学功效,以NLRP3 炎性小体为靶点的miRNA 治疗策略是目前肝纤维化治疗研究的重点方向[16-17]。
miR-223-3p 由于其广泛的生物学作用已成为目前研究者重点关注的miRNAs 分子。研究表明,miR-223-3p 作为抑癌因子在肝细胞癌细胞中异常低表达,并调控细胞增殖,同时可发挥抗炎作用[18]。Ji等[19]的研究发现,人环状RNA-0070963(Hsa_circ_0070963)可通过调控miR-223-3p 的表达抑制肝星状细胞活化及IL-1β、IL-1β等炎症细胞因子的表达,进而抑制肝纤维化的发生及进展。另有研究表明,miR-223-3p 可抑制肝细胞炎症性损伤,抑制细胞外基质的沉积[20]。与普通miRNA 模拟物(mimics)相比,miRNA 体内模拟物(agomir)与细胞膜亲和力更高,特别适合动物体内干扰实验,并且在体内实验中具有更高的稳定性和抑制效果,可以采用全身注射或局部注射等多种方式给药[21]。本项目通过建立小鼠肝纤维化模型,采用静脉注射的方式给予生物模拟物miR-223-3p agomir,探讨miR-223-3p agomir对肝纤维化小鼠的治疗作用。
本实验结果显示,miR-223-3p agomir 可显著抑制四氯化碳诱导的小鼠肝损伤,降低TBIL、Alb、HA、PC Ⅲ、Ⅳ-C 的表达水平,此外,miR-223-3p agomir 可有效抑制肝纤维化小鼠的炎症状态。HE染色和masson 染色结果显示,模型组大量炎性细胞浸润导致小鼠肝小叶正常结构受损,大量胶原及细胞外基质沉积导致肝细胞纤维化,胶原纤维增生严重,细胞排列较乱无规则,给予miR-223-3p agomir干预后,肝脏组织纤维化状态显著改善,肝小叶胶原及细胞外基质明显减少,局灶性坏死组织显著减少,表明miR-223-3p agomir 可显著改善肝纤维化组织炎症细胞浸润,降低肝纤维化组织评分,抑制肝纤维化的进展。此外,miR-223-3p agomir 尾静脉注射可降低小鼠肝组织中NLRP3、Caspase-1、IL-1β 蛋白表达水平,表明 miR-223-3p agomir 可抑制NLRP3炎症小体介导的细胞焦亡通路的激活。综上所述,过表达miR-223-3p 可抑制NLRP3/Caspase-1/IL-1β信号通路的激活,降低机体炎症损伤,改善小鼠肝组织损伤,进而发挥抗肝纤维化作用。
(本文图1~3见插图8-6)

