1株木质素降解菌的筛选、鉴定及固态发酵产酶优化
寇 慧 黄长浩 严 骋 邹 伟
(四川轻化工大学生物工程学院,四川 宜宾 644005)
油菜是我国的主要油料作物之一,种植面积居世界前列[1]。目前,油菜秸秆的处置方式多为露天焚烧和自然降解,会造成资源浪费和环境污染,因此探究优质高效的秸秆资源综合利用方法成为热点话题[2]。但油菜秸秆木质化程度高、生物质结构复杂,造成其利用难、利用率低。高效且低成本的降解技术是实现资源化利用油菜秸秆的亟须解决的难题。目前,油菜秸秆的降解方法主要有物理处理法、化学处理法、生物处理法,其中生物降解技术操作简单、生产费用较低且效用高,不会污染环境,在降解纤维素类物质方面具有巨大的潜力[3]。
秸秆的主要成分包括木质素、纤维素和半纤维素,木质素和半纤维素以共价键的形式形成一种天然的屏障包裹纤维素,防止纤维素被酶解[4]。木质素结构复杂,对纤维素和半纤维素的酶解产生可发酵糖及高附加值产品的开发形成了一定阻碍,因此能否有效去除木质素也会影响纤维素和半纤维素的有效利用[5]。生物降解木质素主要借助于自然界中真菌、放线菌、细菌等,与细菌相比,真菌降解木质素的能力较强,且具有产生多种氧化还原酶的能力[6-7],在木质素解聚方面起重要作用,其中关于白腐真菌的研究最多。但白腐真菌存在效率低、碳水化合物损失大、覆盖面积大、发酵周期长等缺点,因此有需要筛选新菌株、探索新方法降解木质素[8]。本研究从腐烂木头及土壤中筛选、分离、鉴定具有木质素降解能力的真菌,进一步探究了该菌株以油菜秸秆为底物的固态发酵产酶优化以及降解效果,为后续油菜秸秆生物降解提供高效微生物资源,为秸秆的资源化利用提供一定参考。
1 材料与方法
1.1 试验材料
1.1.1 样品来源
土壤和腐烂木头采自四川轻化工大学汇南校区树林里含腐烂木头的土壤地表下2~5 cm 处,使用无菌袋包装,冰袋保存带回实验室,4 °C冰箱保存。
1.1.2 培养基
富集培养基:葡萄糖5 g、蛋白胨10 g、牛肉膏5 g、NaCl 10 g、蒸馏水1 000 mL,pH 值自然,121 ℃高压灭菌20 min。
初筛培养基:木质素2 g、硫酸铵2 g、磷酸二氢钾1 g、磷酸氢二钠0.2 g、琼脂20 g,pH 值7.0,蒸馏水1 000 mL,121 ℃高压灭菌20 min,倒平板备用[9]。
复筛培养基:
愈创木酚-PDA:马铃薯200 g、葡萄糖20 g、琼脂20 g、蒸馏水定容至1 000 mL,pH 值6.0~6.5,121 ℃高压灭菌20 min,冷却至不烫手,使用0.22 μm 滤膜过滤,除菌,加入0.1%愈创木酚[9]。
苯胺蓝-PDA:马铃薯200 g、酵母膏20 g、蛋白胨5 g、葡萄糖20 g、NaCl 5 g、蒸馏水定容至1 000 mL,pH 值5.5 左右,琼脂20 g;灭菌,冷却至不烫手,用0.22 μm滤膜过滤除菌加入0.1 g苯胺蓝,倒平板备用[10]。
木质素降解培养基[10]:碱性木质素2 g、KH2PO41 g、MgSO4·7H2O 1 g、蒸馏水1 000 mL,pH值7.0。
初始固态发酵产酶培养基[10]:预处理过的油菜秸秆3.0 g、麸皮2 g 装入150 mL 锥形瓶中,以料液比1∶2 加入营养液摇匀。
营养液为KH2PO41.0 g/L、MgSO4·7H2O 1.0 g/L、(NH4)2SO410 g/L、蛋白胨1.0 g/L。
所有培养基均需1×105Pa灭菌30 min后冷却。
1.1.3 试剂与仪器
1.1.3.1 试验试剂
木质素、碱性木质素、铁氰化钾、乳酸钠购自上海麦克林生化科技有限公司;葡萄糖、氯化铁购自成都市科隆化学品有限公司;2,2-二氮-双(3-乙基苯并噻唑-6-磺酸)购自合肥巴斯夫生物科技有限公司;苯胺蓝、愈创木酚购自上海泰坦科技股份有限公司;藜芦醇购自上海阿拉丁生化科技股份有限公司。
1.1.3.2 试验仪器
HH-4恒温水浴锅购自上海力辰邦西仪器科技有限公司,LRH-300 生化培养箱购自常州诺基仪器有限公司,UV-1800紫外/可见分光光度计购自上海美谱达仪器有限公司,SW-CJ-2D 型超净工作台购自上海苏净实业有限公司,PHS-3C 酸度计购自成都世纪方舟科技有限公司,LS-50HJ 立式压力蒸汽灭菌器购自江阴滨江医疗设备有限公司,F2000全自动纤维分析仪购自济南海能仪器股份有限公司)。
1.2 试验方法
1.2.1 油菜秸秆的预处理
参考王辉等[11]预处理秸秆方法,称取20.00 g 粉碎至过20 目筛的油菜秸秆粉,置于250 mL 锥形瓶中,加入200 mL 1.1% NaOH(液料比为10 mL/g),密封,置于45 ℃环境中浸泡36 h,置于滤袋中洗至中性,烘干至恒重,称量。
1.2.2 木质素降解菌株的分离筛选
取10 g土壤样品于已灭菌的50 mL富集培养基中,放入摇床28 ℃、180 r/min富集7 d。取出在超净工作台内取上清液1 mL梯度稀释至10-1~10-8,吸取10-5、10-6、10-7、10-8各200 μL涂布于初筛培养基上,每个梯度设置3个重复。28 ℃恒温培养箱中培养3 d,选择生长旺盛的菌株转接至初筛分离培养基上进行划线分离纯化,直至得到纯菌,并对筛选得到菌株进行编号。
挑取初筛培养基上的单菌落,使用牙签点种至愈创木酚-PDA、苯胺蓝-PDA 培养基上的中心,28~30 ℃恒温培养5 d,分别挑取周边有红色显色圈、脱色圈明显的菌株,反复划线纯化,保藏。
1.2.3 木质素降解菌的鉴定
将筛选出的菌株M20 根据菌落培养特征和菌体结构特征,参考《真菌鉴定手册》[12]进行初步鉴定,将菌种送至上海生工进行内转录间隔区(ITS)测序,测序结果使用BLAST 程序在NCBI GenBank 数据库进行同源性分析,利用MEGA 5.0 软件计算序列的相似度,使用Neighbor-joining 法构建菌株系统发育树,确定物种的系统发育地位[13]。
1.2.4 木质素降解菌株降解率测定
采用普鲁士法[14]测木质素浓度,将菌株涂布于初筛培养基平板上,均匀铺满平板后,使用打孔器做成直径8 mm 菌塞,每个木质素降解培养基中无菌操作接种5个菌塞,28 ℃、150 r/min降解5 d,取出,摇匀,过滤掉菌的孢子,滤液使用0.22 μm滤膜抽滤,所得滤液测木质素含量。木质素含量标准曲线操作步骤参考文献[13],得到回归方程y=0.028 2x+0.030 1(R2=0.992 2)。
1.2.5 木质素降解菌株酶活测定
木质素胞外漆酶(Lac)、木质素过氧化物酶(Lip)和锰过氧化物酶(MnP)活性的测定具体操作步骤参考文献[15-17]。
1.2.6 固态发酵产酶单因素优化
碳、氮源优化:在初始固态发酵产酶培养基的基础上,分别选取秸秆与麸皮比为4∶1、3∶1、2∶1、3∶2、1∶1,选取蛋白胨、硫酸铵、硝酸铵作为氮源,初始添加量为3%。选出最优氮源后,分别选取1%、2%、3%、4%添加量,在发酵条件为接种量10%、28 ℃、5 d进行试验。
采用最优碳氮源,即秸秆、麸皮比3∶1,硫酸铵2%,分别选取液料比1、2、3、4 L/g,发酵温度24、28、32、36、40 ℃,发酵时间为2、3、4、5、6、7 d,接种量分别取5%、10%、20%、25%、30%进行单因素优化。
1.2.7 固态发酵产酶优化正交试验设计
根据单因素试验结果,选择对固态发酵产酶影响较大的因素设计正交试验,进一步获得最佳工艺条件,以秸秆与麸皮比(A)、时间(B)和氮源添加量(C)作为3 个因素,选取3 个水平进行试验。采用L9(34)正交表进行正交试验设计,确定固态发酵产酶的最佳工艺。正交试验因素及水平设计见表1。

表1 正交试验因素水平设计
1.2.8 验证试验
以最优发酵工艺检验正交法所获得的结果的可靠性,通过比较初筛发酵条件和优化后的酶活,评价优化前后发酵条件对固态发酵产酶的影响。
1.2.9 油菜秸秆降解率的测定方法
参照GB/T 20805—2006、GB/T 6434—2006,采用滤袋法分别测定饲料中的酸性洗涤木质素含量和粗纤维含量。将发酵油菜秸秆粉碎过40目筛,称取约0.5 g左右发酵油菜秸秆于滤袋封口,将滤袋放入烧杯中用石油醚浸没10 min 脱脂,在通风橱晾干。放入F2000 全自动纤维分析仪中,设置不同程序进行消煮和洗涤,取出滤袋,沥干水分,放入丙酮中浸没5 min,通风橱晾干,放入烘箱(100±2)℃烘干至恒重,马弗炉灰化至恒重,计算酸性洗涤木质素含量、粗纤维含量。
2 结果与分析
2.1 木质素降解菌的筛选
从初筛培养基上共挑出56株菌,共有20株菌出现褪色圈或/和显色圈。其中14株菌株同时在愈创木酚-PDA培养基、苯胺蓝-PDA 培养基上显色/褪色圈出现时间较快且直径圈较大,表明其产漆酶和过氧化物酶能力较强。但仅通过褪色圈/显色圈只能简单判断产酶的特性,无法具体了解酶的活性,因此还需后续试验加以验证。将14株菌株分别接入木质素降解培养基中通过发酵后测木质素降解率进行下一步复筛,结果显示,降解率大于30%的有10株菌,再分别接入以油菜秸秆为唯一碳源的初始固态产酶培养基中,以筛选出高效降解油菜秸秆的菌株。10株木质素降解菌的木质素酶活见表2。
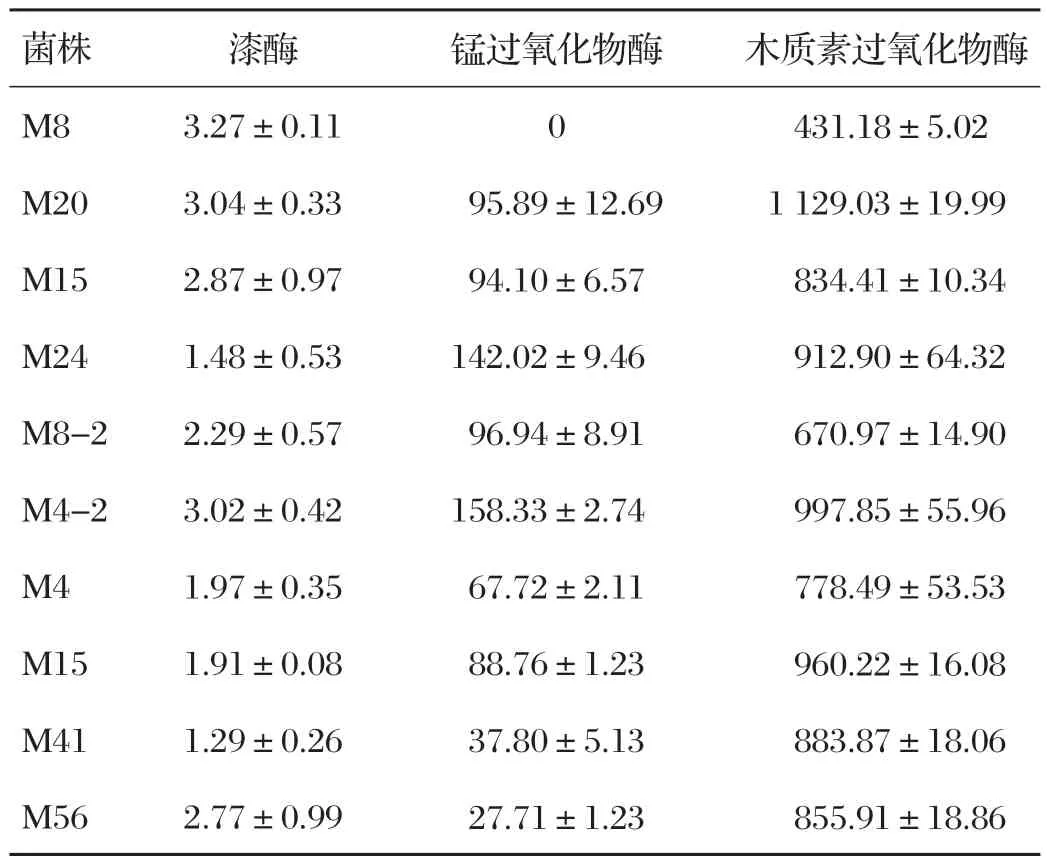
表2 10株木质素降解菌的木质素酶活 单位:U/g
由表2可知,菌株M8的漆酶最高,但其余两种酶活很低;M20、M4-2 的3 种酶活均较高,M20 的均略高于M4-2,且M20的苯胺蓝褪色效果以及木质素降解效果比M4-2好,因此最终确定M20为目的菌株进行后续研究。
2.2 木质素降解菌的鉴定
2.2.1 菌株M20的形态特征及显微观察结果(见图1)

图1 菌株M20的形态特征及显微观察结果
由图1可知,菌株M20在苯胺蓝-PDA、愈创木酚-PDA平板上均呈黄绿色,丝绒质地,菌丝为致密短绒状,向四周扩展,边缘不规整,在平板上呈中央凸起生长。显微镜观察菌体形态,菌株具有分生孢子梗,孢梗茎壁薄且长,壁平滑,顶端有球形顶囊,由顶囊的小梗产生孢子,分生孢子头辐射状。结合邓维琴等[18]对米曲霉的鉴定研究结果,初步判断筛选出的M20菌株为米曲霉。
2.2.2 菌株M20的ITS序列分析及系统发育树
双向测序获得菌株M20 的ITS基因序列,经拼接后在NCBI 数据库中进行序列同源性比对,选取BLAST 中相似度较高的真菌序列,利用MEGA5.0计算真菌序列相似度,采用其中的Neighbor Joining 法构建系统发育树,结果见图2。由图2 可知,M20 与AspergillusoryzaeBS A2 在同一个分支上,序列相似性为100%。因此,将该菌株初步命名为A.oryzaeM20。

图2 菌株M20系统发育树
2.3 固态发酵产酶优化单因素试验结果(见图3~图9)
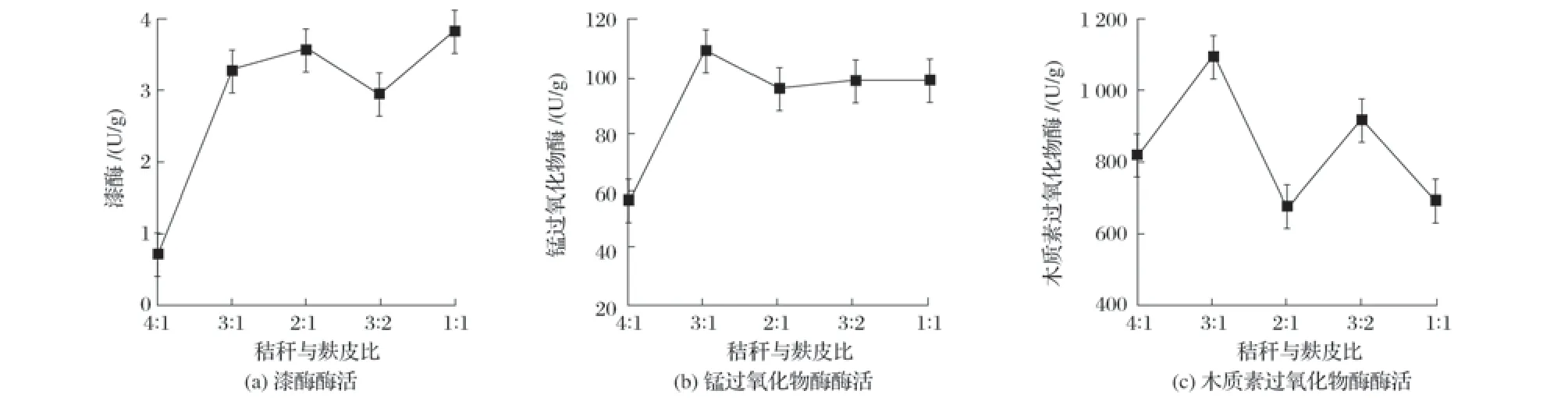
图3 秸秆与麸皮比对固态发酵产酶的影响

图4 不同氮源对固态发酵产酶的影响

图5 氮源添加量对固态发酵产酶的影响

图6 接种量对固态发酵产酶的影响

图7 发酵时间对固态发酵产酶的影响
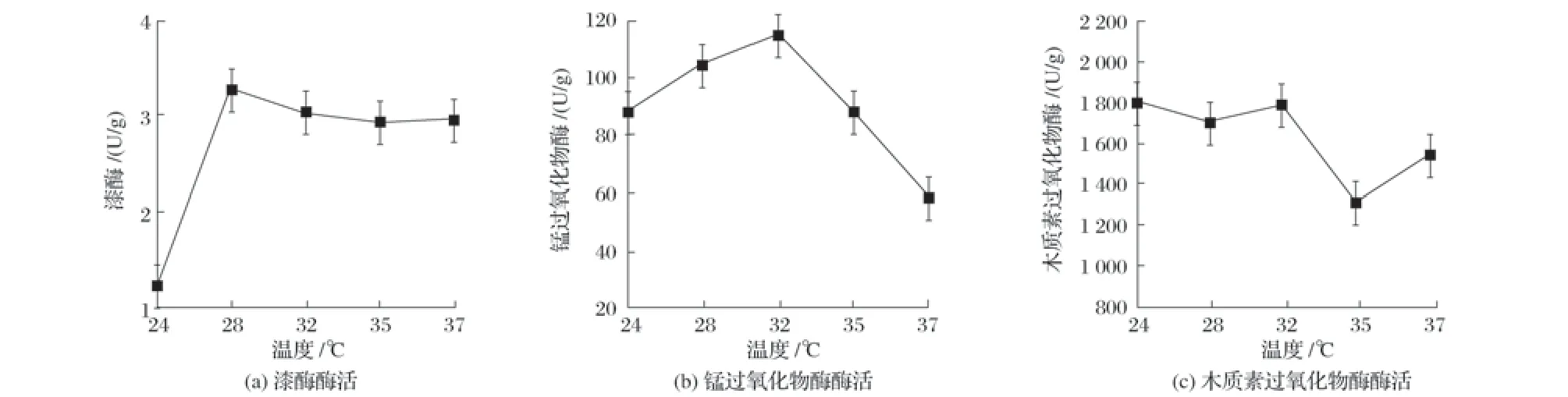
图8 温度对固态发酵产酶的影响
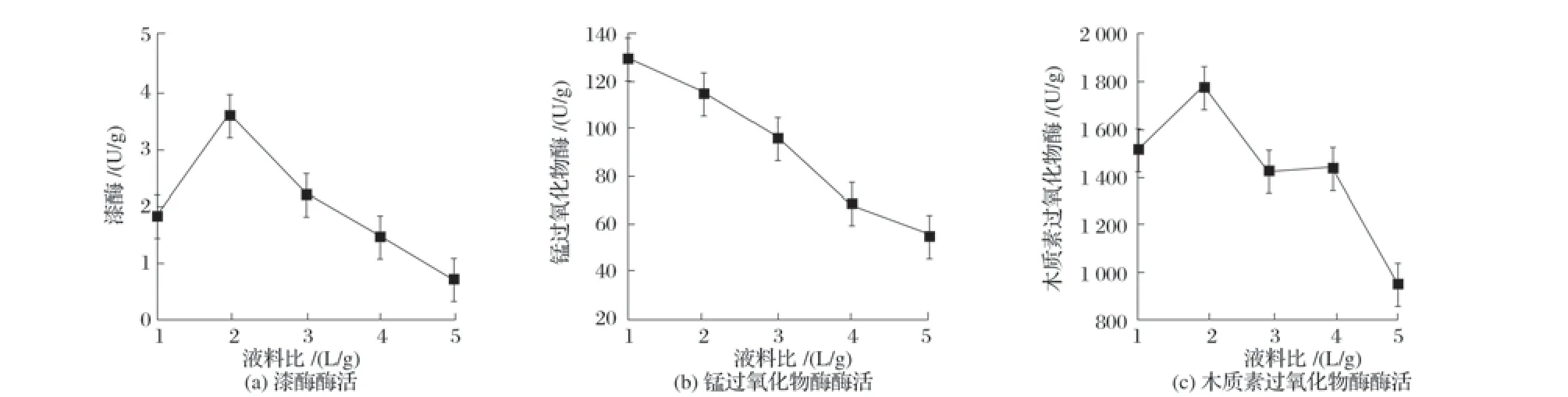
图9 液料比对固态发酵产酶的影响
由图3 可知,当秸秆与麸皮比例为3∶1 时,木质素过氧化物酶和锰过氧化物酶均达到峰值,漆酶的酶活略低于秸秆与麸皮比为2∶1和1∶1;考虑秸秆的利用率最大化,选择秸秆与麸皮比例4∶1~2∶1进行后续试验。
由图4、图5 可知,以硫酸铵为氮源时,3 种酶活性均最高。随着硫酸铵含量的增加,3种酶的活性均上升再下降,其中漆酶和木质素过氧化物酶的在硫酸铵含量为2%时达到峰值,锰过氧化物酶在硫酸铵含量为3%时达到峰值;当硫酸铵含量为4%时,3种酶活性均下降。因此,选择2%~4%硫酸铵含量进行后续试验。
由图6 可知,当接种量在5%~20% 范围内时,3 种酶活波动幅度不大。因此,接种量对产酶结果影响不大,分析原因是接种量过多,微生物生长旺盛,使环境竞争加剧,微生物群提前衰亡期,且在进入主要代谢阶段之前底物已经大量被消耗,使最终产物减少。
由图7可知,随着发酵时间延长,3种酶活均逐渐升高,到6 d时,3种酶活性均下降。
因此,本试验选择发酵时间为3~5 d 进行后续试验。
由图8 可知,24~32 ℃范围内,3 种酶活性随着温度的升高而逐渐增大,在米曲霉最适生长温度32~36 ℃范围内[19],3 种酶活性均逐渐下降。因此,选取32 ℃作为后续试验。
由图9 可知,液料比为1~2 时,漆酶与木质素过氧化物酶活性均随着液料比增加而增加,而锰过氧化物酶活性呈下降趋势;液料比大于2 时,随时液料比增加,3 种酶活性均下降,可能是固态发酵适宜霉菌生长,水分含量过大会导致培养基透气性不足,影响菌株生长,产酶降低[20]。
2.4 固态发酵产酶正交试验优化结果
为考察各因素之间的关系及影响,进一步优化各因素的最佳量,应用SPSS 24软件,设计秸秆与麸皮比、发酵时间、氮源添加量3因素3水平的正交试验,正交试验结果见表3,方差分析见表4~表6。
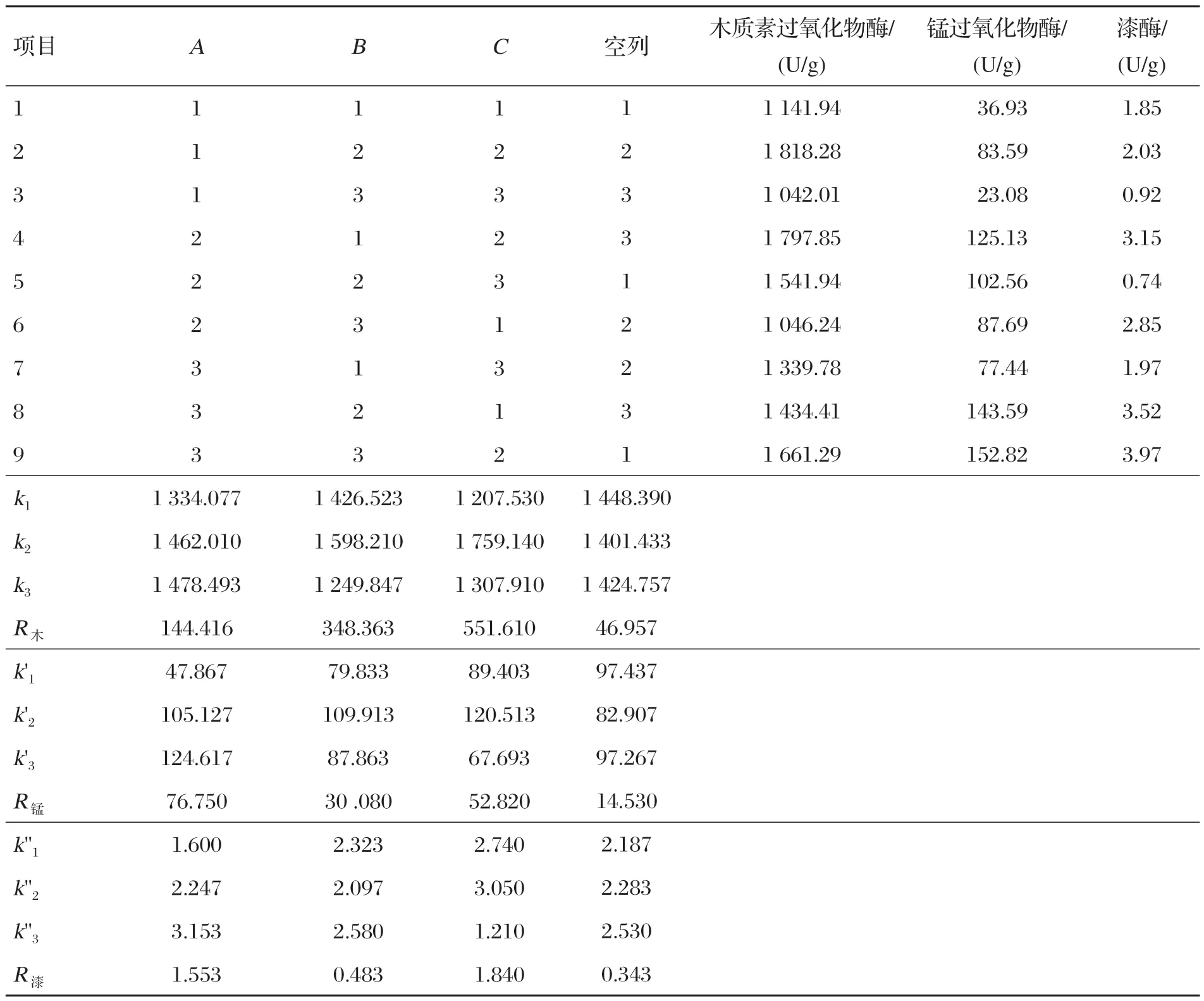
表3 正交试验结果及极差分析

表4 锰过氧化物酶方差分析

表5 漆酶方差分析
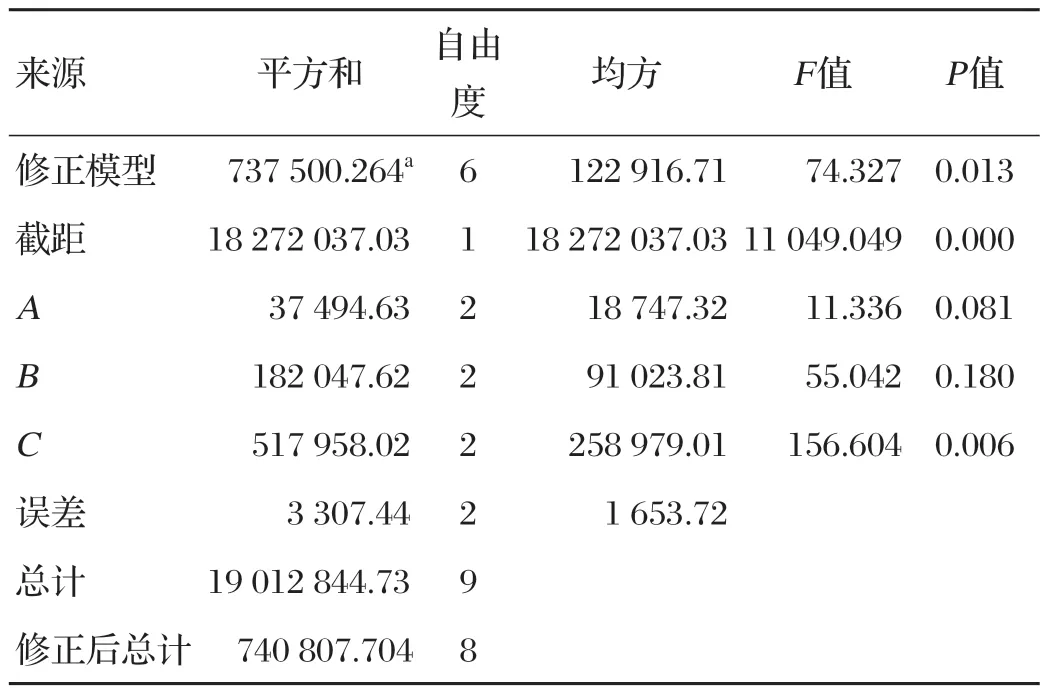
表6 木质素过氧化物酶方差分析
由表3~表6可知,氮源添加量对3种酶活力影响均显著(P<0.05),发酵时间仅对过氧化物酶活力影响显著(P<0.05),对其余两种酶活力影响不显著(P>0.05),而秸秆与麸皮比例对锰过氧化物酶和漆酶活力影响显著(P<0.05),对木质素过氧化物酶活性影响不显著(P>0.05),因此最佳方案为A3B2C2,即产木质素过氧化物酶最佳的发酵条件为秸秆与麸皮比为2∶1、时间4 d、(NH4)2SO4添加量为3%;产锰过氧化物酶最佳的发酵条件为秸秆与麸皮比为2∶1、时间4 d、(NH4)2SO4添加量为3%;产漆酶最佳的发酵条件为秸秆与麸皮比为2∶1、时间5 d、(NH4)2SO4添加量为3%。根据极差分析结果,产漆酶的最佳方案为A3B3C2,即产漆酶的最佳发酵条件中仅发酵时间与另两种酶发酵时间不同,但发酵时间仅对过氧化物酶活力影响显著,因此以过氧化物酶的最佳发酵时间为准,最终最佳方案为A3B2C2。
2.5 最优发酵条件的验证
以正交试验得到的最优发酵培养条件组合为秸秆与麸皮比为2∶1、(NH4)2SO4添加量为3%、发酵4 d进行试验验证。优化后木质素过氧化酶从1 121.03 U/g 上升到1 796.74 U/g,提高了60.28%;锰过氧化酶从101.13 U/g上升至146.78 U/g,提高了45.14%;漆酶从3.135 U/g 上升至3.979 U/g,提高了27.00%。
2.6 油菜秸秆中木质素、纤维素的降解率
在最优发酵培养基条件下,未接菌的秸秆固体培养基粗纤维含量47.76%、木质素含量为13.34%;接入菌株M20 经过发酵后的秸秆固体培养基粗纤维33.09%、木质素含量为6.71%。菌株M20 对油菜秸秆中木质素降解率达49.70%,粗纤维降解率达30.72%,均高于Ćilerdžić等[21]利用Ganodermaapplanatum对秸秆的木质素、纤维素的降解率。
将未发酵的油菜秸秆固体培养基发酵基质与发酵过后的秸秆培养基基质分别烘干、粉碎、过筛,用导电双面胶带固定在样品台上,在真空环境下进行镀金处理,物料表面形成一层导电膜后,用扫描电子显微镜进行观察秸秆表面形态变化[22],结果见图10。
由图10可知,未发酵的秸秆表面光滑,结构紧密且完整,试验组秸秆经菌株发酵处理后可见,菌体孢子覆盖、夹杂在秸秆细胞中,秸秆致密完整的结构被破坏。
3 讨论
李佳少[23]将米曲霉CGMCC5992 进行固态发酵后,发现锰过氧化物酶达到2.08 U/g,木质素过氧化物酶达到1.79 U/g,而通过单因素和响应面试验优化了米曲霉CGMCC5992固态发酵培养的工艺条件,得到木质素过氧化物酶最大酶活值可达到6.62 U/g,秸秆木质素降解率达40.25%。本研究筛选的米曲霉M20 产的锰过氧化物酶、木质素过氧化物酶活均远高于上述研究结果,同时还能够产漆酶。张芳芳等[4]利用白腐真菌接种到玉米秸秆固体培养基中,发酵过程中漆酶活性最高值为21.36 U/g,锰过氧化物酶活性峰值0.32 U/g,木质素过氧化物酶峰值为15 U/g。与张芳芳等[4]的研究结果相比,本研究中的菌株M20 的漆酶活性较低,但木质素过氧化物酶和锰过氧化物酶分别是其119倍和456倍。由M20的固态发酵产酶结果发现,米曲霉M20 在油菜秸秆为底物的固态发酵中,木质素过氧化物酶在木质素降解中起主要作用,与Pinto等[24]报道的木质素过氧化物酶在固态发酵占优势的结果一致,与Fackler 等[25]用白腐菌降解木质素时,锰过氧化物酶起主要作用结果不同,可能是不同菌种代谢差异导致[26]。
此外,与已报道其他种属的木质素降解菌相比,M20 在短时间、低能耗的发酵条件下对水溶碱性木质素和油菜秸秆(天然木质素)均具有较强的降解能力。李灵灵等[10]以白腐菌BYL-7 发酵5 d 对碱性木质素降解率为36.5%,培养8 d 对秸秆木质素降解率为32.8%,而M20 在液体培养基中发酵5 d 对碱性木质素降解率约为40%,固态发酵5 d后对秸秆木质素降解率达49.70%,分别提高了4.5%和16.9%。Zhu等[27]以变色栓菌为木质素降解试验菌株,发现秸秆木质素降解率为34.8%,本试验中M20的木质素降解率提高了14.9%,且明显缩短了发酵周期。范寰等[28]利用复合木质素菌系发酵30 d 时,秸秆的木质素降解率达到(57.0±0.2)%,虽M20 秸秆木质素降解率比其低(7.3±0.2)%,但发酵周期缩短了7.5倍。
4 结论
本研究分离筛选的菌株米曲霉M20 具有较强的产木质素酶活和木质素降解能力,对其利用油菜秸秆固态发酵培养基进行发酵优化,在初始发酵培养基的基础上改变秸秆与麸皮比为2∶1、(NH4)2SO4添加量为3%、发酵4 d可明显提高其产木质素酶活能力,且油菜秸秆中木质素降解率达49.70%,粗纤维降解率达30.72%。该菌株在油菜秸秆生物降解方面具有较大的开发利用前景,一定程度上为秸秆资源化利用提供了新的微生物资源。后续还可利用此菌株与其他菌株结合处理油菜秸秆,多菌协同产酶,使酶系统更加完整,提高油菜秸秆的降解率。

