黄贞菌质总黄酮与多糖同步优化提取及体外抗氧化分析
徐福飞 庞佳慧 吴雨龙 江海涛 李盛杰 霍光明 华 春
(1.南京师范大学生命科学学院,江苏 南京 210046;2.南京晓庄学院食品科学学院,江苏 南京 211171;3.江苏省高校特殊生物质废弃物资源化利用重点建设实验室,江苏 南京 211171)
菌质是一种以药食两用真菌为发酵菌株,以中药材或中药渣为药性基质进行发酵的产物[1]。在发酵过程中,药性基质为真菌的生长代谢提供营养成分,而真菌代谢所产的酶反作用于药性基质改变其结构与成分,从而生成新的活性成分,其含量高于真菌与药性基质的叠加,药性基质毒性得到降低[2]。竹黄菌是一种药食两用真菌,含黄酮、萜类等活性成分,具有抗氧化[3]、保肝[4]、抗菌、提高免疫力[5]等功效。
女贞子为木樨科植物女贞的果实[6],经90%乙醇提取后的女贞子渣中还含有黄酮、多糖、氨基酸等活性成分,可以作为药性基质[7-8]。黄贞菌质是以女贞子渣为药性基质,以竹黄菌为发酵真菌,经固体双向发酵技术获得的产物,该产物含有女贞子渣基质、竹黄菌菌丝以及竹黄菌在女贞子渣基质上的代谢产物。黄酮和天然多糖在抗氧化[9]、抗菌、抗炎[10]、抗病毒[11]、抗肿瘤[12]等方面均表现出较好的生物活性。传统工艺是对同一物质中黄酮和多糖常采用分批分次提取,存在提取过程烦琐、效率低、成本高、费时费力等特点。本研究采用超声波辅助液体双相渗透法从黄贞菌质中同步提取总黄酮与多糖,以响应面CCD法优化提取工艺条件,并测定黄贞菌质总黄酮和多糖的体外抗氧化活性,为开发黄贞菌质类饲料添加剂提供参考。
1 材料与方法
1.1 试验材料
黄贞菌质由南京晓庄学院食品科学学院药用菌物研究所提供。芦丁和葡萄糖标准品购自上海源叶生物有限公司;DPPH、ABTS、乙酸乙酯和无水乙醇购自国药集团化学试剂有限公司。
1.2 仪器设备
KQ.250B 超声波清洗仪(江苏省昆山市超声仪器有限公司);RE-3000 旋转蒸发器、SHZ-Ⅲ型循环水真空泵(上海亚荣生化仪器厂);紫外-可见分光光度计(北京普析通用仪器有限责任公司);台式冷冻干燥机(美国Labconco公司);高速冷冻离心机(美国热电公司)。
1.3 试验条件
1.3.1 黄贞菌质的制备
参考文献[13-14]方法制备黄贞菌质。称取粉末状女贞子渣53.3 g装入发酵菌袋中,加入66.7 mL纯净水,搅拌均匀,于121 ℃灭菌30 min 后冷却。竹黄菌菌种在马铃薯琼脂固体培养基平板上活化,从活化的竹黄菌平板上挑取生长良好的竹黄菌菌苔接种于马铃薯液体培养基,置于恒温摇床培养箱,设置温度27 ℃,转速140 r/min,培养3 d。取一定量竹黄菌种子液接种于灭菌后的女贞子渣菌袋内,采用无菌玻棒搅拌均匀,于27 ℃恒温培养箱中静置培养30 d,直至菌丝布满整个培养菌袋,发酵完成。将黄贞菌质从菌袋中取出,40 ℃烘干,粉碎后装入密封袋中,于-20 ℃保存。
1.3.2 ULDPM提取黄贞菌质总黄酮与多糖
准确称取黄贞菌质粉末10 g 于烧杯中,加入一定体积的乙酸乙酯(上相)和纯净水(下相),使用玻棒搅拌均匀,封上保鲜膜,转移到超声波仪中,设置一定的超声功率、超声温度和超声时间进行处理,结束后将混合物以4 500 r/min 离心10 min,将上清液转移至分液漏斗中静置至上相和下相分离。上层溶液和下层溶液分别用旋转蒸发仪蒸发除去溶剂,下层浓缩液加入4 倍体积的95%乙醇醇沉,离心收集沉淀,随后上相和下相沉淀经真空冷冻干燥得黄贞菌质总黄酮与多糖。
1.3.3 黄贞菌质总黄酮与多糖得率的测定
1.3.3.1 黄贞菌质总黄酮得率的测定参考文献[15]的方法测定黄贞菌质总黄酮得率。以芦丁标准品绘制标准曲线,得回归方程为Y=6.308 6X+0.049 6,R2=0.998;计算黄贞菌质总黄酮得率。
式中:c为黄贞菌质总黄酮提取液的质量浓度(g/mL);V为样品定容体积(mL);N为测定时样液的稀释倍数;M为黄贞菌质粉末的质量(g)。
1.3.3.2 黄贞菌质多糖得率的测定
参考文献[16]的方法测定黄贞菌质多糖得率。以葡萄糖标准品绘制标准曲线,按苯酚-硫酸法测定吸光度,得回归方程为Y=5.821 4X+0.092 5,R2=0.991;计算黄贞菌质多糖得率。
式中:c为黄贞菌质多糖浓度(g/mL);V为黄贞菌质多糖溶液体积(mL);N为稀释倍数;M为黄贞菌质粉末质量(g)。
1.3.4 单因素试验
以乙酸乙酯和纯净水为提取溶剂,根据不同上相液料比(3、6、9、12、15、18 mL/g)、下相液料比(5、10、15、20、25 mL/g)、超声功率(40、50、60、70、80、90 W)、超声温度(30、35、40、45、50、55 ℃)和超声时间(15、25、35、45、55、65 min)考察对黄贞菌质总黄酮和多糖得率的影响,选择最佳工艺条件,各试验重复3次。
1.3.5 响应面CCD法优化提取工艺设计
根据单因素试验结果,以上相液料比、下相液料比、超声功率、超声温度和超声时间为自变量,以黄贞菌质总黄酮和多糖得率为响应值设计试验,并采用响应面CCD 法分析各因素之间的交互作用,以确定获得较高黄贞菌质总黄酮和多糖得率的最佳工艺条件。响应面试验因素和水平见表1。

表1 响应面试验的因素与水平
1.3.6 黄贞菌质总黄酮与多糖的体外抗氧化活性
经优化提取获得的黄贞菌质总黄酮和多糖分别配成浓度为0.1、0.2、0.4、0.8、1.4、2.0 g/L的待测液,配制相同浓度的维生素C(VC)溶液为对照,分别测定黄贞菌质总黄酮与多糖对DPPH和ABTS的清除率及还原力。
1.3.6.1 黄贞菌质总黄酮与多糖的DPPH自由基清除能力
参考文献[17]的方法,稍作改进。天平称取DPPH试剂1 mg用10 mL的无水乙醇溶解,得到浓度为0.1 g/L的DPPH 工作液,摇匀,取100 μL DPPH 工作液和100 μL不同浓度的待测样品于酶标板中充分混合,静置30 min,于酶标仪中517 nm 测定其吸光度,以VC 作为对照组。重复操作3次,求出清除率。
式中:A0为100 μL 无水乙醇加100 μL DPPH 的吸光度;A1为100 μL 样品溶液加100 μL DPPH 的吸光度;A2为100 μL样品溶液加100 μL无水乙醇的吸光度。
1.3.6.2 黄贞菌质总黄酮与多糖的ABTS自由基清除能力
参考文献[17]的方法,稍作改进。准确称取3.841 mg的ABTS 溶于1 mL 纯水中,配置成7 mmol/L 的ABTS 储备液。准确称取过硫酸钾0.672 3 mg 溶于1 mL 水中,配制2.45 mmol/L 过硫酸钾储备液。取上述两种储备液各0.2 mL 混合,于暗处室温下反应12~16 h。反应结束后,将混合液用蒸馏水稀释至A734nm处值为(0.70±0.02),形成ABTS+工作液(约稀释45~55倍)。
取40 μL 不同浓度样品溶液和160 μL ABTS+工作液,混匀后,于室温下静置6 min,在A734nm处测吸光值,以抗坏血酸作为对照组。重复操作3次,求出清除率。
式中:A0为40 μL 蒸馏水加160 μL ABTS+吸光度;A1为40 μL样品溶液加160 μL ABTS+吸光度。1.3.6.3 黄贞菌质总黄酮与多糖还原力的测定
吸取0.5 mL 不同浓度的样品溶液于5 mL 离心管中,依次加入0.2 mol/L 磷酸缓冲液(pH 值6.6)1.0 mL,1%铁氰化钾溶液1.0 mL,在50 ℃水浴反应30 min 后冷却。再加入10%三氯乙酸溶液1.0 mL,混匀后,4 000 r/min离心15 min。吸取离心后的上清0.5 mL 于2 mL 离心管中,加入等体积蒸馏水和0.1%三氯化铁溶液100 μL,避光反应30 min,于700 nm 下测定吸光值。其总还原力与吸光值的大小成正比。重复操作3次。
1.4 数据统计与分析
试验数据采用SPSS 19.0软件和GP 6.0软件进行分析和处理,DE 8.0 响应面软件分析试验结果。P<0.05 表示差异显著。
2 结果与分析
2.1 单因素试验结果
2.1.1 上相液料比对黄贞菌质总黄酮与多糖得率的影响(见图1)

图1 上相液料比对黄贞菌质总黄酮与多糖得率的影响
由图1 可知,黄贞菌质总黄酮与多糖得率随着上相液料比的降低先增加后降低,当液料比为12 mL/g时,黄贞菌质总黄酮得率达最高;当液料比为9 mL/g 时,黄贞菌质多糖得率达最高。原因可能是当上相液料比较高时,提取系统黏度较大,不利于目标物迁移,从而造成得率较低;而提取溶剂的量增加有利于目标物溶出,导致得率增加。但当提取溶剂继续增加到一定值后,目标物已基本提取完毕,若提取溶剂用量继续增加会造成单位提取液中目标物浓度的降低,也会造成提取试剂浪费和能耗增加,同时增加了后续溶液处理难度,影响得率。此外,由于上相液料比为12 mL/g 时多糖得率与9 mL/g 时差异不大,选择上相液料比12 mL/g用于后续试验。
2.1.2 下相液料比对黄贞菌质总黄酮与多糖得率的影响(见图2)

图2 下相液料比对黄贞菌质总黄酮与多糖得率的影响
由图2 可知,黄贞菌质总黄酮得率随下相液料比的降低呈先增高后降低,在液料比为20 mL/g 时得率最高;黄贞菌质多糖得率随下相液料比的降低呈先增加后趋于平稳。原因可能是随着下相液料比的降低,提取溶剂量增加,目标物溶出量增加,得率增加。但由于乙酸乙酯微溶于水,所以随着水相(下相)增加,乙酸乙酯(上相)实际用于提取的量减少,从而导致黄贞菌质总黄酮得率降低;而对于黄贞菌质多糖,当水相量达到一定值时多糖全部溶出,即使水相再增加对多糖得率也无明显影响。因此,选择下相液料比20 mL/g用于后续试验。
2.1.3 超声功率对黄贞菌质总黄酮与多糖得率的影响(见图3)

图3 超声功率对黄贞菌质总黄酮与多糖得率的影响
由图3 可知,黄贞菌质总黄酮与多糖得率随着超声功率的增大先增高后降低,当超声功率达60 W时,黄贞菌质总黄酮与多糖得率达最高。原因可能是超声功率的增大导致空化效应增强,黄酮和多糖大量溶出,但当超声功率过高时,过强的空化效应导致黄酮和多糖活性物质发生降解引起得率减少。综合各因素考虑,选择超声功率60 W用于后续试验。
2.1.4 超声温度对黄贞菌质总黄酮与多糖得率的影响(见图4)
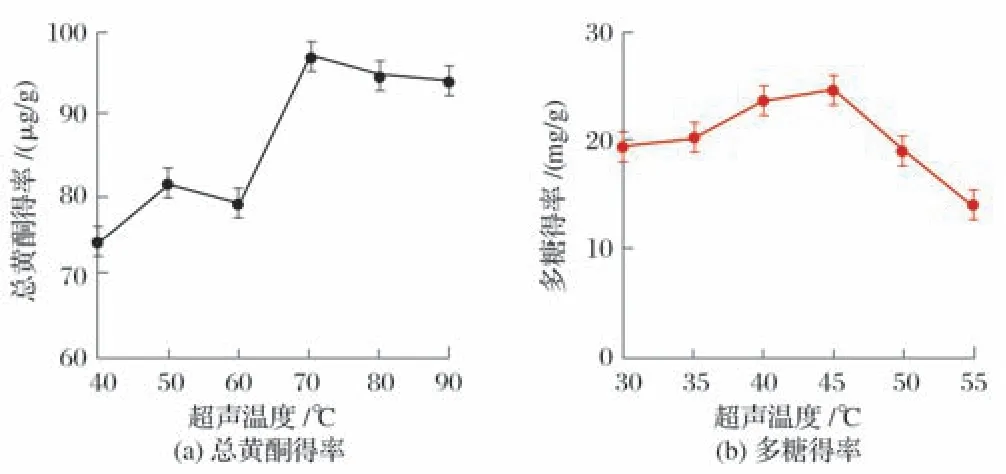
图4 超声温度对黄贞菌质总黄酮与多糖得率的影响
由图4 可知,黄贞菌质总黄酮与多糖得率随着超声温度升高呈先增高后降低,当超声温度为45 ℃时黄贞菌质总黄酮与多糖得率达到最高。原因可能是随着超声温度的升高,水中的小气泡(空化核)增多,对产生空化作用有利,黄贞菌质细胞破裂加速,胞内总黄酮和多糖大量溶出;但当超声温度过高时,气泡中的蒸气压太高,将增强气泡闭合时的缓冲作用,导致空化作用减弱,黄贞菌质总黄酮与多糖得率减少。综合各因素考虑,选择超声温度45 ℃用于后续试验。
2.1.5 超声时间对黄贞菌质总黄酮与多糖得率的影响(见图5)

图5 超声时间对黄贞菌质总黄酮与多糖得率的影响
由图5 可知,黄贞菌质总黄酮与多糖得率均随着超声时间延长先增高后降低,黄贞菌质总黄酮得率在超声时间为45 min 时达最大值,黄贞菌质多糖得率在超声时间为55 min时达最大值。原因可能是刚开始超声处理时,由于超声波的机械效应、空化效应和热效应使黄贞菌质细胞总黄酮和多糖快速溶出,而超声时间过长可能会导致总黄酮和多糖被破坏,影响得率。此外,超声时间过长增加耗能,提高成本。综合各因素考虑,选择超声时间45 min用于后续试验。
2.2 响应面试验结果
2.2.1 黄贞菌质总黄酮与多糖得率模型建立与分析
响应面试验设计与结果见表2,运用DE 8.0软件进行多元回归拟合,建立以黄贞菌质总黄酮与多糖得率的响应面二次回归模型的回归系数和方差分析(见表3、表4),得黄贞菌质总黄酮(Y1)与多糖(Y2)的多元回归分析方程。

表2 响应面试验结果分析

表3 黄贞菌质总黄酮得率回归模型方差分析

表4 黄贞菌质多糖得率回归模型方差分析

由表3、表4可知,黄贞菌质总黄酮和多糖的相关系数R2分别为0.942 3和0.955 6,校正复相关系数RAdj2和预测复相关系数RPred2 分别为0.907 2、0.867 7 和0.912 0、0.882 9,且两系数值均较为接近,表明总黄酮和多糖的实际值和预测值之间存在高度相关性。经统计学分析发现,总黄酮和多糖的F值分别为15.08和21.71,两者均具有极显著性(P<0.000 1),且失拟性P值均具有不显著性(P>0.05),表明该回归模型精确性高。上述结果表明,Y1与Y2多元回归分析方程可较好地预测与分析总黄酮和多糖的得率。此外,从5 个因素对总黄酮和多糖得率的影响来看,一次项中X1、X2、X3、X4、X5,二次项中,交互项中X1X3、X2X3、X2X4、X2X5对总黄酮得率影响显著;一次项中X2、X4、X5,二次项中,交互项中X1X2、X1X4、X1X5、X2X3、X2X4、X2X5、X3X5、X4X5对多糖得率影响显著。由F值可知,各因素对总黄酮和多糖得率的影响次序均为X2>X5>X4>X1>X3。
2.2.2 各因素对黄贞菌质总黄酮与多糖得率的影响(见图6、图7)

图6 两因素交互作用对黄贞菌质总黄酮得率的影响

图7 两因素交互作用对黄贞菌质多糖的影响
由图6 可知,上相液料比与超声功率、超声温度、超声时间以及超声功率与超声温度的交互作用对黄贞菌质总黄酮得率具有显著影响(P<0.05),其余交互作用无显著影响,且上相液料比与超声温度、超声时间的交互作用对黄贞菌质多糖得率的影响表现出类似的趋势。
由图7可知,上相液料比与下相液料比、超声温度、超声时间以及下相液料比与超声功率、超声温度、超声时间以及超声时间与超声功率、超声温度的交互作用对黄贞菌质多糖得率具有显著影响(P<0.05),但上相液料比与超声功率以及超声功率与超声温度的交互作用对黄贞菌质多糖的率影响不显著(P>0.05);超声功率与上相液料比以及超声温度的交互作用不是影响黄贞菌质多糖得率主要因素。
2.2.3 黄贞菌质总黄酮与多糖最佳提取工艺条件的确定和验证
根据二项回归模型的预测,得出黄贞菌质总黄酮与多糖最佳提取工艺条件为上相液料比10.71 mL/g、下相液料比15 mL/g、超声功率68.7 W、超声温度48.5 ℃、超声时间55 min。考虑实际操作的便利性,修正黄贞菌质总黄酮与多糖最佳提取工艺条件为上相液料比11 mL/g、下相液料比15 mL/g、超声功率69 W、超声温度49 ℃、超声时间55 min。
在此条件下,进行3 次重复试验,黄贞菌质总黄酮与多糖的实际得率为142.00 μg/g和26.12 mg/g,与预测得率143.98 μg/g 和25.34 mg/g 接近,表明该模型与实际情况拟合较好,能够用于预测试验结果,可作为黄贞菌质总黄酮与多糖同步提取工艺的回归分析和参数优化。
2.2.4 黄贞菌质总黄酮与多糖体外抗氧化活性测定结果(见图8)
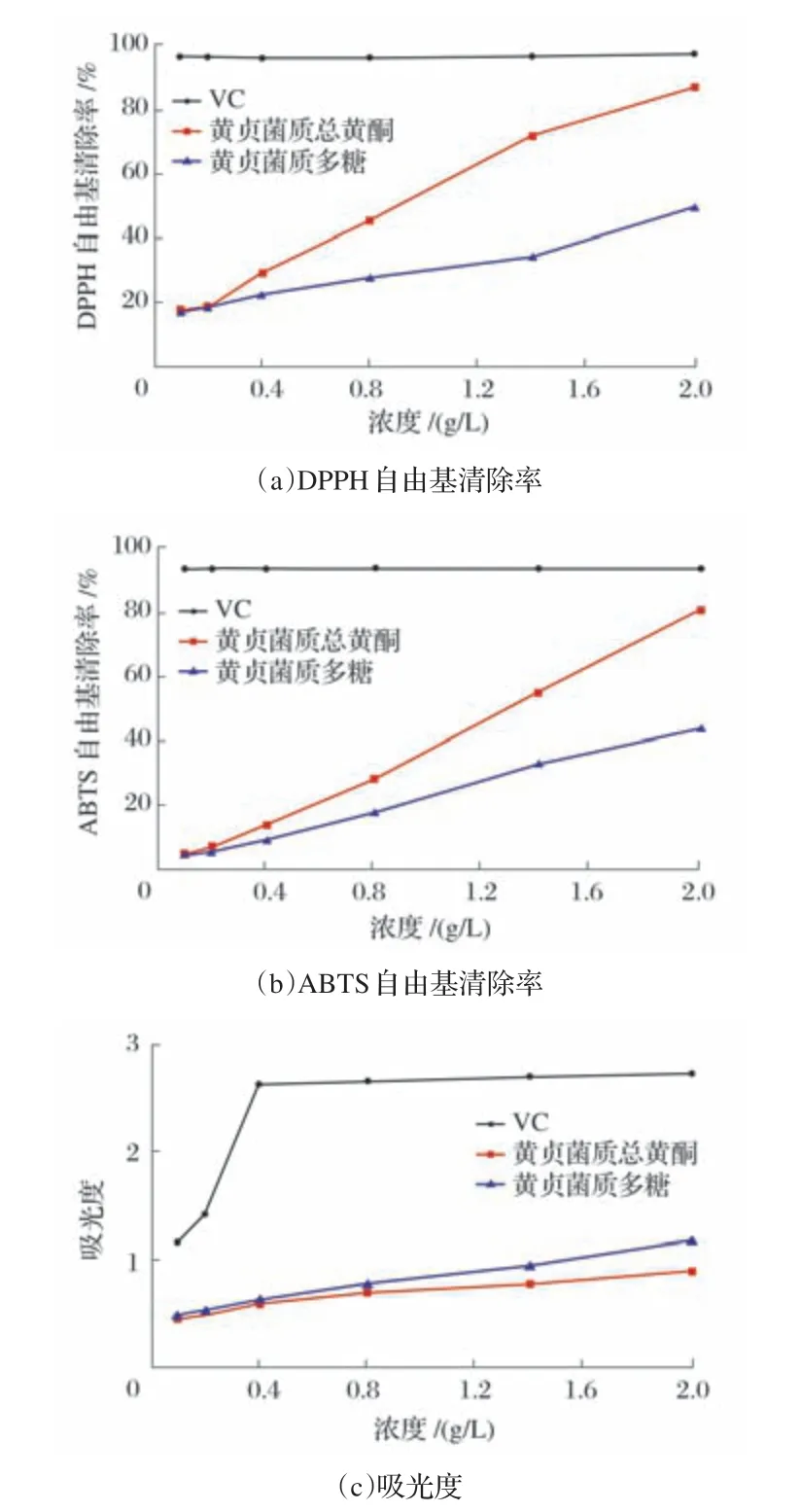
图8 黄贞菌质总黄酮与多糖体外抗氧化活性测定结果
由图8(a)、图8(b)可知,随着黄贞菌质总黄酮与多糖浓度的升高,其对DPPH和ABTS自由基清除率不断增强,当浓度达2.0 g/L 时,黄贞菌质总黄酮对DPPH、ABTS 的清除率分别为87.3%、80.3%;黄贞菌质多糖对DPPH、ABTS的清除率分别为49.5%、43.3%。其中黄贞菌质总黄酮对DPPH 和ABTS 的清除率高于黄贞菌质多糖,接近抗坏血酸对DPPH 和ABTS 的清除率。结果表明,相对于黄贞菌质多糖,黄贞菌质总黄酮具有更好的体外抗氧化活性。
由图8(c)可知,在对黄贞菌质总黄酮与多糖还原力测试试验中发现,随着二者浓度的增加,其还原力逐渐增强,在浓度为2.0 g/L时,二者的还原力分别为0.9和1.2。结果提示,相对于黄贞菌质总黄酮,黄贞菌质多糖具有较好的还原力。
3 讨论
提取同一物质中的不同目标物常采用分批分次分溶剂提取,因此存在提取过程烦琐[18]、效率低[19]、成本高[20]、费时费力[21]、提取不完全[22]等问题。Monteiro等[23]利用乙酸乙酯和乙醇双相溶剂成功从黄桃中同时提取类胡萝卜素和酚类物质。Bu等[24]利用硫酸铵与纯净水双相溶剂成功从黑醋栗中同时提取多酚和多糖。近年来,超声波技术应用于生物大分子的提取已成为一种新兴的领域研究方向[25-26]。由超声波产生的声学效应处理形成空化气泡,气泡破裂形成强大的冲击波和强大的机械剪切力,进而引起局部现象能量密度变化,加速溶剂和溶质之间的传质[9,27]。
本研究采用ULDPM从黄贞菌质中同步提取总黄酮和多糖,加之响应面CCD 法优化,形成了具有溶剂消耗少、操作简单、提取时间短、提取效率高等优点的创新提取方法。体外抗氧化研究表明,黄贞菌质总黄酮与多糖具有较好的体外抗氧化活性和还原力,其中黄贞菌质总黄酮具有更好的体外抗氧化活性,而黄贞菌质多糖具有较好的还原力。因此,黄贞菌质总黄酮和多糖可应用于饲料添加剂以及天然活性抗氧化药物的开发。
4 结论
采用ULDPM结合响应面同步优化提取黄贞菌质中总黄酮和多糖能够减少提取时间,简化提取流程,提高提取效率。黄贞菌质总黄酮与多糖较好的体外抗氧化活性可为进一步开发黄贞菌质类饲料添加剂奠定基础。

