ω-3多不饱和脂肪酸对鸡脂肪沉积的调控机制及添加策略的研究进展
闫世雄 简宗辉 刘 永 胡 梅 柴 倩 冯泽伟 贾俊静 豆腾飞
(云南农业大学动物科学技术学院,云南 昆明 650201)
肉鸡快速生长导致脂肪在皮下、腹部和肌内过度沉积,会影响鸡养殖业的经济效益,潜在威胁消费者健康[1]。使用遗传选育、限制饲喂等手段对鸡脂肪沉积具有一定的抑制作用,但仍存在选育周期过长、饲料营养分配不当、降低生产性能和屠宰性能等问题[2]。因此,寻找健康养殖措施减少脂肪沉积成为肉鸡养殖业亟须解决的问题。研究表明,富含ω-3 多不饱和脂肪酸(ω-3 PUFAs)的饲料与减少脂肪沉积有关,并且在脂肪细胞水平上ω-3 PUFAs 已被证明可抑制细胞增殖,减少脂肪细胞中脂质沉积,促进脂肪分解[3-4]。文章综述饲料中ω-3 PUFAs 的来源及代谢,讨论了ω-3 PUFAs 对鸡脂肪沉积的调控机制及添加策略,以期为ω-3 PUFAs 在家禽生产中进一步研究及应用提供参考。
1 ω-3 PUFAs来源及代谢
ω-3 PUFAs(也称n-3 PUFAs)是多不饱和脂肪酸的一个家族,在碳链第三、四个碳原子之间具有第一个双键,包括α-亚麻酸(18∶3 ω-3,ALA)、硬脂酸(18∶4 ω-3,SDA)、二十碳五烯酸(20∶5 ω-3,EPA)、二十二碳五烯酸(22∶5 ω-3,DPA)和二十二碳六烯酸(22∶6 ω-3,DHA)[5-6]。ω-3 PUFAs 是必需脂肪酸,只能通过饲料中添加植物源(以ALA形式)或海洋源(以EPA和DHA形式)ω-3 PUFAs提供。坚果和种子中ALA含量见表1[6],海洋源ω-3 PUFAs含量见表2[6]。
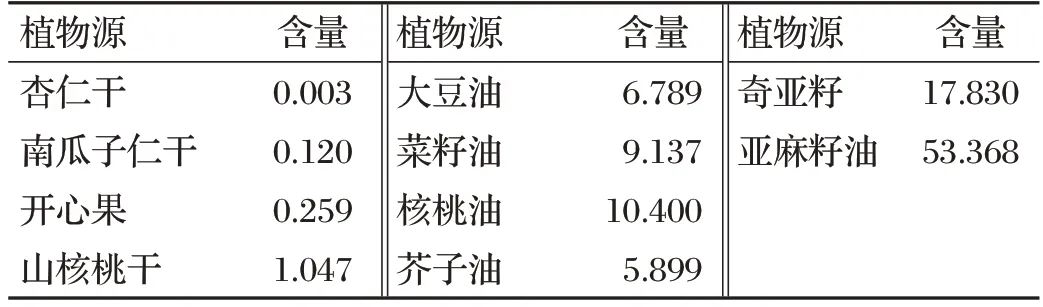
表1 坚果和种子中ALA含量 单位:g/100 g
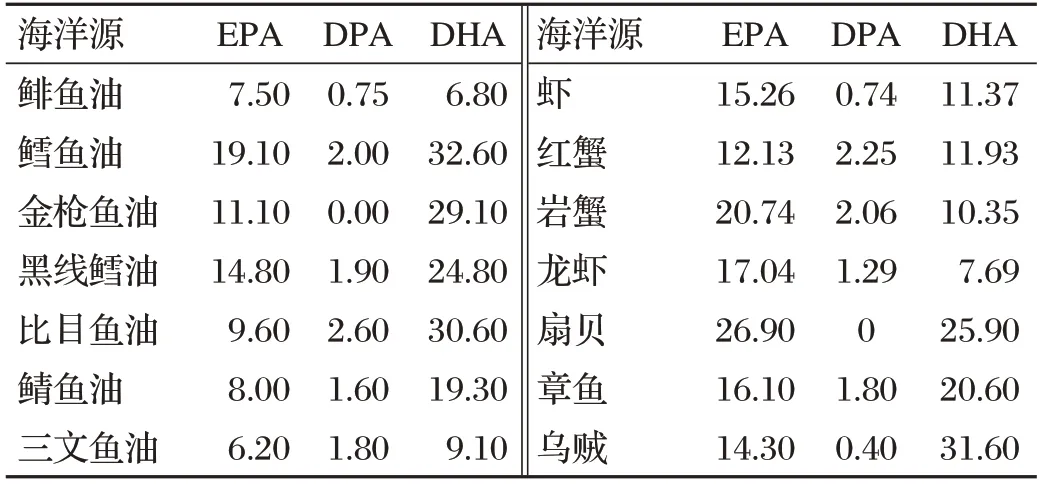
表2 海洋源ω-3 PUFAs含量单位:%
饲料中添加的油脂主要来自大豆、玉米等植物籽实压榨,ALA是饲料中主要的ω-3 PUFAs来源。ALA进入细胞后可用于合成细胞膜磷脂双分子层、β-氧化以及在酶的作用下合成更长、更不饱和的ω-3 PUFAs[7]。与其他脊椎动物不同,家禽中因为极长链脂肪酸延伸酶(ELOVL)家族中的ELOVL2 和ELOVL5 基因在脂肪组织中高度表达,可提高ALA 合成EPA 和DHA 的能力,但合成能力有限,仍需依靠饲料补充[8-9]。鱼油是补充EPA和DHA最简单的方式,但补充剂量高会导致副产品产生不好的滋味,因此通常将植物源和海洋源ω-3 PUFAs配合使用,以降低过量添加产生的负面影响[10-11]。最近,微藻类产品由于其抗营养因子含量低、可持续性强、DHA 含量高(约为21.33%~28.76%),作为饲料中ω-3 PUFAs 添加越来越受到人们的关注和欢迎[12-14]。此外,微藻类产品没有鱼油特有的腥味,还能够更好地调节各组织及副产品中ω-3 PUFAs 的分布,特别是EPA 和DHA 水平[15]。通过对比蛋鸡饲料中添加相同剂量的鱼油和微藻(0.5%、1.0%和1.5%)发现,添加微藻的鸡蛋中DHA 含量更高,当添加量为1.5%时可使每个鸡蛋的DHA 含量增加到194.04 mg/100 g,并降低了ω-6/ω-3 PUFA 的比例[14]。Ao 等[16]在蛋鸡日粮中添加1%、2%和3%的微藻,发现4周后蛋黄中DHA含量呈线性增长,分别为5.09、7.17和7.76 mg/g。人食用富含ω-3 PUFA的鸡蛋后,血清甘油三酯(TG)水平显著下降[17]。
动物采食后,饲料中含ω-3 PUFAs的TG和磷脂在小肠中被脂肪酶和磷脂酶水解为1,3-甘油三酯、溶血磷脂和游离脂肪酸,之后在小肠上皮细胞中进行再酯化和再合成形成乳糜微粒,经门静脉运输至肝脏再进入血液循环,并在组织和器官中利用[18]。DHA是ω-3 PUFAs中最具生物活性的形式,而ALA 是ω-3 PUFAs 的前体脂肪酸,可在延伸酶和去饱和酶的作用下合成长链脂肪酸,最终形成DHA[19]。
2 ω-3 PUFAs对鸡脂肪沉积的调控
2.1 抑制早期脂肪组织发育
脂肪组织发育是间充质干细胞在众多调控因子作用下,向前脂肪细胞增殖、前脂肪细胞分化及细胞中脂滴沉积的过程。皮下脂肪是鸡最早发育的脂肪组织,在鸡胚胎期第12 d 时开始发育,此时皮下脂肪组织发育与蛋黄中脂肪酸含量增加一致,这些脂肪酸被用于合成TG储存,直到鸡胚胎期第19 d时,TG被分解并为雏鸡孵化提供能量。腹部是鸡储存脂肪的主要场所,鸡出壳7 d时清晰可见,随着前脂肪细胞的增殖和分化,雏鸡脂肪库通过脂肪细胞数量增加和成熟脂肪细胞中脂质沉积迅速增大[20]。皮下脂肪和腹部脂肪是鸡早期脂肪发育最活跃的组织,最后脂肪细胞增大是脂肪沉积的主要机制,而脂肪沉积能力取决于肝脏脂肪合成、血液极低密度脂蛋白(VLDL)水平和脂肪细胞数量和大小[21]。
ω-3 PUFAs,尤其是EPA和DHA可抑制前脂肪细胞分化过程中有丝分裂克隆扩增,诱导脂肪细胞凋亡,减少脂肪细胞中脂滴沉积和促进脂肪细胞脂肪动员,减少机体脂肪沉积[22]。体外脂肪细胞培养试验表明,EPA 和DHA 均可刺激脂肪细胞中脂肪分解,促进脂肪酸β-氧化,减小脂肪细胞大小[23]。在前脂肪细胞分化过程中,ω-3 PUFAs通过显著抑制过氧化物酶体增殖物激活受体γ(PPARγ)及过氧化物酶体增殖物激活受体γ 辅激活蛋白1β(PPARGC1B)表达抑制脂肪生成[23]。脂肪细胞中TG主要来源血液,ω-3 PUFAs 激活PPARα会增加鸡肝脏脂肪酸β-氧化和能量消耗,从而减少肝脏VLDL 输出,限制TG向脂肪组织供应[24]。在大鼠的研究中,ω-3 PUFAs可以减少白色脂肪祖细胞数量,抑制白色脂肪祖细胞向白色脂肪细胞分化,达到抑制肥胖的作用[25]。
2.2 从转录和转录后水平抑制脂肪沉积
饲料中脂肪酸的长度和不饱和程度对脂肪细胞脂质沉积具有调控作用。与其他类型脂肪酸相比,ω-3 PUFAs 更易激活PPARα,特别是EPA 和DHA 可以结合PPARα并刺激线粒体和过氧化物酶体β-氧化,调控脂肪储存和脂肪动员相关途径,促进脂肪细胞氧化代谢,减少脂肪沉积[26]。此外,EPA和DHA还可在转录水平下调肝脏中甾醇调控元件结合蛋白1(SREBP1)基因表达,进而抑制脂肪酸从头合成相关基因的表达[27]。通过比较SFA(C18∶0)、EPA 和MUFA(C18∶1n-9)对脂肪细胞脂中滴沉积及调控基因的影响发现,EPA 显著抑制脂肪细胞PPARγ、硬酯酰辅酶A 去饱和酶1(SCD1)基因表达,促进脂蛋白脂肪酶(LPL)和激素敏感性脂肪酶(HSL)基因表达,导致脂肪细胞脂质沉积量减少[28]。EPA和DHA还可调节脂肪细胞胰岛素敏感性和葡萄糖利用率,增加胰岛素增敏作用的脂肪因子脂联素合成,进一步激活腺苷酸活化蛋白激酶(AMPK)基因表达,从而增加脂肪细胞能量代谢[29-30]。DHA 还可通过激活PPARα和诱导白色脂肪中偶联蛋白2(UCP2)基因表达促进脂肪酸β-氧化和能量代谢[22]。Fouad 等[31]研究指出,ω-3 PUFAs 减少脂肪沉积的机制可能是通过抑制肝脏中脂肪酸合成酶(FAS)基因表达和促进肉碱棕榈酰转移酶1(CPT1)基因表达。CPT1 是肉碱转运系统中调控脂质代谢的关键酶,同时也是调节脂肪酸β-氧化的限速酶,可以改善机体脂肪沉积[32]。甘油-3-磷酸和合成TG所需脂肪酸的减少可能是限制脂肪细胞增大的原因。在TG合成过程中脂肪组织会优先利用SFA和MUFA参与酯化反应,ω-3 PUFAs 增加LPL基因的表达可促进脂肪酸摄取,但ω-3 PUFAs 可能通过抑制脂肪酸从头合成相关基因表达降低TG 合成的酯化反应和储存脂肪酸的能力,在一定程度上降低脂肪细胞的大小[24,33]。在脂肪动员过程中,脂肪组织优先分解EPA和DHA等不饱和脂肪酸可能是ω-3 PUFAs减少鸡脂肪沉积的一种机制。
褐色、灰褐色和米色脂肪细胞是前脂肪细胞分化成熟的标志[34]。虽然假定家禽中不存在哺乳动物中提供热量的米色脂肪细胞,但也有研究表明,经冷驯化后肉鸡颈部皮下脂肪组织中发现与哺乳动物UCP2 和UCP3 同源性较高的禽解偶联蛋白(avUCP)、诱导细胞死亡DNA片段化因子a 样效应因子(CIDEA)、T-box 转录因子1(TBX1)、跨膜蛋白26 (TMEM26)、碳酸酐酶4(CAR4)和肉碱棕榈酰基转移酶(CPT1b)等米色脂肪细胞标志物高度表达,表明米色脂肪细胞的发现可能是肉鸡除颤抖产热的另一种新的产热机制[35]。而EPA 和DHA能够促进白色脂肪细胞褐变,进一步增强脂肪组织的氧化代谢,控制脂肪生成[4]。
2.3 ω-3 PUFAs抑制脂肪沉积的其他途径
ω-3 PUFAs中EPA和DHA也被用于合成二十烷类脂化合物、溶胞分子以及抑制脂肪沉积的代谢物。通过抑制脂肪细胞中葡萄糖和脂肪酸代谢的级联反应,如抑制促炎和抗炎细胞脂质因子合成、增加脂肪促分解因子合成等途径抑制脂肪沉积[36]。
肠道微生物结构对脂肪沉积也具有调控作用。鸡肝脏是脂肪代谢的主要场所,由于缺乏淋巴系统,肝脏通过门静脉直接与肠道相连,形成“肠-肝轴”将大分子脂质直接运输至肝脏代谢。母鸡盲肠中拟杆菌门丰度随着饲料中ALA 和DHA 添加量增加而显著降低,并与肝脏TG沉积呈正相关,表明ω-3 PUFAs可能通过降低拟杆菌门丰度减少肝脏脂肪沉积[37]。
3 ω-3 PUFAs减少脂肪沉积的添加策略
3.1 增加ω-3/ω-6 PUFA比例策略
催化ω-3 和ω-6 PUFAs 延伸和去饱和的酶一样,因此长链ω-3 PUFAs 合成取决于ω-3/ω-6 PUFA 比例。鸡饲粮中通常添加2%~5%的脂肪以满足快速生长的能量需求,结合玉米-豆粕型日粮,导致饲料偏向于高ω-6/ω-3 PUFA 比例,而ω-6 PUFAs 倾向于促脂肪生成[38]。因此,用富含ω-3 PUFAs 的原料替代ω-6 PUFAs 可限制鸡脂肪沉积。不同来源ω-3 PUFAs 日粮对鸡脂肪沉积的影响见表3。
Newman等[44]在肉鸡等氮等能日粮中用鱼油和葵花籽油替代牛油(主要为饱和脂肪酸)发现,饲喂鱼油和葵花籽油使腹脂重分别下降57.82%和60.71%,血浆中TG含量分别下降42.86%和33.33%。Ibrahim 等[45]研究表明,使用不同配比的鱼油和亚麻籽油降低饲料ω-6/ω-3 PUFA比例,可显著增加肉鸡胸肌中ω-3 PUFAs 含量,并且ALA、EPA和DHA含量随着鱼油添加量的增加而显著增加。研究发现,ω-3 PUFAs 可显著降低肉鸡胸肌中IMF和血清总胆固醇(TCH)、TG、极低密度脂蛋白(VLDL)含量,提高肉鸡生产性能、免疫应答状态。Kumar等[46]研究表明,用100 g/kg亚麻籽粉替代饲料配方中豆粕饲喂肉鸡可降低肉鸡总脂肪和各组织中ω-6 PUFAs的含量,增加ω-3 PUFAs含量。
3.2 脂肪组织发育规划策略
考虑养鸡业的生产规模,用鱼油或亚麻籽油替代饲料配方中大豆油、玉米油等会带来更大的生产成本。研究表明,ω-3 PUFAs 可对生命早期的脂肪组织发育规划产生影响,进而影响发育后期的脂肪沉积和新陈代谢[47]。蛋黄约60%的干质量由脂质组成,这些TG和磷脂在孵化时几乎被全部利用,并且脂肪酸结合蛋白(FABP)基因高度表达和ω-3 PUFAs 优先利用在胚胎发育期已经被发现[48]。合成蛋黄脂质所需的脂肪酸由日粮提供,因此,推测增加肉鸡种鸡饲粮中ω-3 PUFAs 含量是减少后代肉仔鸡脂肪增加的潜在方法。Beckford 等[33]连续28 d 在母鸡日粮中分别添加2.8%的鱼油和玉米油,对母鸡进行受精和种蛋孵化,雏鸡出壳后饲喂相同日粮。结果发现,添加鱼油增加了母鸡脂肪组织中EPA和DHA含量;雏鸡出壳14 d 后,与玉米油组相比,鱼油组腹部脂肪重减少约38%,脂肪细胞数量显著增加但大小显著降低。通过对脂肪组织进行转录组-蛋白质组关联分析发现,饲喂鱼油和玉米油的雏鸡差异表达的蛋白质在糖代谢、脂滴运输和细胞骨架组织中显著富集,鱼油抑制了脂肪细胞增大、TG合成、脂肪酸合成和利用相关基因表达,表明母鸡日粮中脂肪酸水平影响后代脂肪组织的发育。Tompkins 等[49]研究表明,富含ω-3 PUFAs 的鱼油日粮可降低肉鸡后代的脂肪量,增加瘦肉率。
3.3 ω-3 PUFAs配合抗氧化剂添加策略
补充ω-3 PUFAs与机体脂质过氧化增加有关[50]。Mir等[51]研究发现,肉鸡日粮中添加10%亚麻籽可显著提高胸肌和腿肌中ALA和EPA形式存在的ω-3 PUFAs和ω-3/ω-6 PUFA比例,降低肌肉中饱和脂肪酸(SFA)、TC和IMF 含量。研究指出,饲喂亚麻籽油增加了肉鸡肌肉中不饱和脂肪酸含量,产生更多的自由基,对肉鸡抗氧化指标存在负面影响。研究表明,在改善ω-3 PUFAs 氧化稳定性方面,饲料中配合添加有机铬、有机硒和一些天然草本植物抗氧化剂(如姜黄素、大豆异黄酮等)除了改善脂肪氧化稳定性外,还可提高ALA 转化为EPA 和DHA 的效率[52]。Pappas 等[53]发现,在饲粮中添加硒,胸肌中ω-3 PUFAs 含量随添加硒含量(0.15、0.30、3.00 mg/kg)的增加呈线性增加。Gou等[54]研究发现,与未添加相比,含4%亚麻籽油的肉鸡饲粮中添加30 mg/kg大豆异黄酮能够显著降低血浆中TG、TCH、丙二醛(MDA)含量,显著增加总超氧化物歧化酶(T-SOD)活性和还原型谷胱甘肽/氧化性型谷胱甘肽(GSH/GSSG)比例,显著增加肌肉中EPA和DHA水平,并且上调肌肉中脂肪酸去饱和酶(FADS2)、ELOVL2、ELOVL5 基因表达。
4 ω-3 PUFAs的其他营养作用
ω-3 PUFAs 除调控脂肪代谢外,还具有促进动物生长发育、调节免疫活性、调节肠道微生物结构、降低血液黏稠度、改善血管功能等作用。随着对发育规划概念的认知,利用母鸡在蛋黄中沉积ω-3 PUFAs 以供胚胎利用,有机会应用于发育规划的概念中。如在母鸡产蛋期饲喂ω-3 PUFAs 可以通过调节子代胚胎期免疫活性,以及骨骼、大脑、肠道等重要器官的发育,产生跨代效应[48]。ω-3 PUFAs 构成胚胎发育中细胞膜的大部分结构磷脂,影响免疫细胞及肠上皮细胞脂肪酸组成。肠道中黏膜相关淋巴组织对细菌、病毒和寄生虫抗原产生反应,导致炎症反应和肠道屏障渗漏,ω-3 PUFAs 的增加可能有利于促进免疫活性,抵抗炎症,保持肠道完整性[55]。炎症反应为骨骼的充分发育产生负面影响,细菌性软骨坏死伴骨髓炎是由股骨头或胫骨头部的细菌感染导致跛足的常见原因,可以认为是肠道炎症在骨骼发育中发挥负面作用,ω-3 PUFAs 的增加可能预防鸡跛足[56]。ω-3 PUFAs 还具有抑制破骨细胞生长,增加骨形成,抑制骨再吸收,减少骨丢失,对骨质疏松症有良好的预防作用[57]。母鸡饲喂ω-3 PUFAs 对子代免疫活性、骨骼发育和肠道发育调控的可能途径见图1[48]。
5 展望
ω-3 PUFAs 是一种抑制鸡脂肪沉积的脂肪酸,特别EPA和DHA,可以调控脂肪组织发育、脂滴沉积、脂肪酸β-氧化、脂肪动员、能量代谢、糖代谢、炎症级联反应、肠道微生物结构等途径调控脂肪沉积。但目前ω-3 PUFAs 在鸡生产中的研究与利用仍然不足,植物源ALA在家禽体内转化为EPA 和DHA 的效率较低,而海洋源ω-3 PUFAs 生产成本较高,在规模化家禽养殖的饲粮中配合添加的比例及方式有待研究;饲粮中添加ω-3 PUFAs 的量越多,越容易导致脂质过氧化,如何与其他抗氧化剂合理配伍添加仍需深入研究;ω-3 PUFAs 调控脂肪沉积的机制研究尚浅。因此,深入研究ω-3 PUFAs对鸡脂肪沉积的调控作用和机制,可使ω-3 PUFAs 在畜禽养殖中得到更广泛的应用,还可为生产富含ω-3 PUFAs(特别是EPA和DHA)的畜禽副产品预防和控制人类肥胖疾病提供指导。

