METTL16、MAT2A在胃癌组织中的表达及其与胃癌患者临床病理参数、预后的关系*
秦豫培,杨 丽,胡阳黔
国药东风总医院/湖北医药学院附属东风医院消化内科,湖北十堰 442001
胃癌是常见的消化系统恶性肿瘤,全球每年发病例数达100万例,死亡例数达78万例,严重威胁人类健康[1]。胃癌早期无特异性临床表现,多数患者确诊时已进入中晚期,5年生存率较低[2]。寻找能够早期诊断及预测胃癌预后的分子标志物具有重要意义。甲基转移酶样蛋白16(METTL16)是一种N6甲基腺苷(m6A)RNA甲基转移酶,通过甲基化修饰U6小核RNA、长链非编码RNA MALAT1,调控下游基因表达,影响个体生长发育及细胞凋亡等生物学过程[3]。研究发现,METTL16在肝癌等恶性肿瘤中表达上调,其通过与真核生物起始因子3a相互作用,促进翻译起始复合物的组装,促进下游癌基因的表达,导致肿瘤进展[4]。甲硫氨酸腺苷转移酶2A(MAT2A)蛋白参与催化甲硫氨酸和ATP产生S-腺苷甲硫氨酸,是细胞内重要的甲基供体[5]。MAT2A在乳腺癌等肿瘤中表达上调,其通过促进肿瘤细胞的增殖、侵袭和干性转化,促进肿瘤的发生发展[6]。目前METTL16、MAT2A在胃癌中的表达水平及在预后判断中的价值尚不明确。本研究旨在通过分析胃癌中METTL16和MAT2A的表达,探讨两者的临床价值。
1 资料与方法
1.1一般资料 将本院2018年3月至2019年3月诊治的92例胃癌患者纳入研究。男56例,女36例;年龄33~77岁,平均(58.3±5.1)岁;分化程度:中、高分化49例,低分化43例;肿瘤TNM分期:Ⅰ~Ⅱ期40例,Ⅲ期52例;合并淋巴结转移者53例;肿瘤最大径:>5 cm者51例,≤5 cm者41例;病理类型:腺癌62例,腺鳞癌30例;肿瘤位置:胃窦部55例,贲门胃底部37例。纳入标准:(1)经病理组织学检查确诊为胃癌;(2)初次诊治,既往无手术、放化疗等治疗史;(3)患者及家属配合检查治疗,临床病理资料及随访资料完整。排除标准:(1)合并其他恶性肿瘤;(2)合并肝、肾等脏器功能衰竭;(3)妊娠及哺乳期女性。本研究经本院伦理委员会审核批准通过,纳入研究者均知情同意并签署知情同意书。
1.2仪器与试剂 METTL16、MAT2A单克隆抗体均购自美国Abcam公司,货号ab40850、ab209328。两步法免疫组织化学染色试剂盒购自北京中杉金桥公司,货号PV-6001。
1.3方法
1.3.1免疫组化检测METTL16、MAT2A表达 将术中获取的胃癌和癌旁组织用含10%甲醛的组织固定液固定过夜,常规石蜡包埋后用切片机切片,厚度4 μm,65 ℃烘箱放置2 h,用二甲苯Ⅰ、Ⅱ依次脱蜡两遍,每次10 min,梯度乙醇(100%、95%、80%、70%、50%乙醇)水化,每个梯度5 min。柠檬酸缓冲液(pH=6.0)中进行抗原热修复,热修复条件:水浴锅100 ℃ 15 min。3%的过氧化氢水溶液作用15 min,消除内源性过氧化物。3%山羊血清室温封闭2 h。滴加一抗,METTL16一抗稀释比例1∶1 000,MAT2A一抗稀释比例1∶2 000。4 ℃孵育过夜,辣根过氧化物酶标记羊抗兔二抗室温孵育2 h。癌组织DAB显色3 min,癌旁组织DAB显色5 min,苏木素染核10 s。50%、70%、80%、95%、100%梯度乙醇脱水,每个梯度5 min,最后中性树脂封片镜检。镜下观察染色情况,同时进行免疫组化染色评分。染色强度评分:不着色为0分,淡黄色1分,棕黄色2分,深褐色3分;染色面积评分:<25%为1分,25%~50%为2分,>50%为3分。染色强度评分与染色面积评分乘积为免疫组化染色评分,>2分为阳性,≤2分为阴性。
1.3.2随访 所有患者自病理确诊之日起开始进行定期门诊或电话随访,术后第1年每3个月随访1次,术后第2至3年每半年随访1次,总随访时间3年,随访内容为患者生存及肿瘤复发转移情况,随访截至2022年4月1日,随访终点为患者死亡或随访结束。

2 结 果
2.1胃癌和癌旁组织中METTL16、MAT2A蛋白的表达 癌组织中METTL16黄褐色阳性染色主要位于细胞质和细胞膜,MAT2A阳性染色主要分布于细胞核。胃癌组织中METTL16、MAT2A阳性率分别为73.91%(68/92)、71.74%(66/92),明显高于癌旁组织的METTL16、MAT2A阳性率[26.09%(24/92)、25.00%(23/92)],差异均有统计学意义(χ2=42.087、40.238,P<0.001),见图1。Spearman秩相关分析显示,胃癌组织中METTL16与MAT2A蛋白呈正相关(r=0.769,P<0.001)。
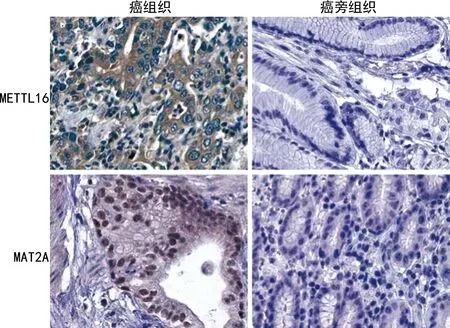
图1 胃癌和癌旁组织中METTL16、MAT2A蛋白表达情况(×200)
2.2METTL16、MAT2A表达与胃癌临床病理特征的关系 不同肿瘤TNM分期及淋巴结转移情况的患者癌组织中METTL16、MAT2A阳性率比较,差异均有统计学意义(P<0.05),肿瘤TNM分期Ⅲ期及伴淋巴结转移的患者癌组织中的METTL16、MAT2A阳性率分别高于肿瘤TNM分期Ⅰ~Ⅱ期及无淋巴结转移的患者癌组织(P<0.05)。不同年龄、性别、肿瘤最大径、肿瘤位置、病理类型、病理分级患者癌组织中METTL16、MAT2A阳性率比较,差异均无统计学意义(P>0.05)。见表1。

表1 METTL16、MAT2A表达情况与胃癌患者临床病理特征的关系
2.3METTL16、MAT2A表达与胃癌患者生存预后的关系 随访期间无失访,死亡患者例数28例,3年总体生存率为69.56%(64/92)。METTL16阳性组及阴性组3年总体生存率分别为63.24%(43/68)、87.50%(21/24),平均生存时间分别为(30.26±2.33)、(33.95±2.51)个月。METTL16阳性组的生存预后差于METTL16阴性组(Log-Rankχ2=3.913,P=0.011);MAT2A阳性组及阴性组3年总体生存率分别为60.61%(40/66)、92.31%(24/26),平均生存时间分别为(29.75±2.24)、(34.87±2.63)个月。MAT2A阳性组的生存预后差于阴性组(Log-Rankχ2=4.335,P=0.002)。见图2。

图2 Kaplan-Meier分析METTL16、MAT2A表达与胃癌患者生存预后的关系
2.4单因素及多因素COX回归分析影响胃癌预后的因素 以胃癌患者生存预后情况为因变量(1=死亡,0=存活),以年龄(1为≥60岁,0为<60岁)、性别(1=男,0=女)、肿瘤位置(1=胃窦部,0=胃底贲门部)、肿瘤最大径(1为>5 cm,0为≤5 cm)、病理分级(1=中、高分化,0=低分化)、病理类型(1=腺癌,0=腺鳞癌)、肿瘤TNM分期(1=Ⅲ期,0=Ⅰ~Ⅱ期)、淋巴结转移(1=有,0=无)、METTL16(1=阳性,0=阴性)、MAT2A(1=阳性,0=阴性)为自变量。单因素及多因素COX回归分析显示,胃癌组织中METTL16阳性、MAT2A阳性、肿瘤分期Ⅲ期及淋巴结转移是影响胃癌患者预后的独立危险因素。见表2、3。
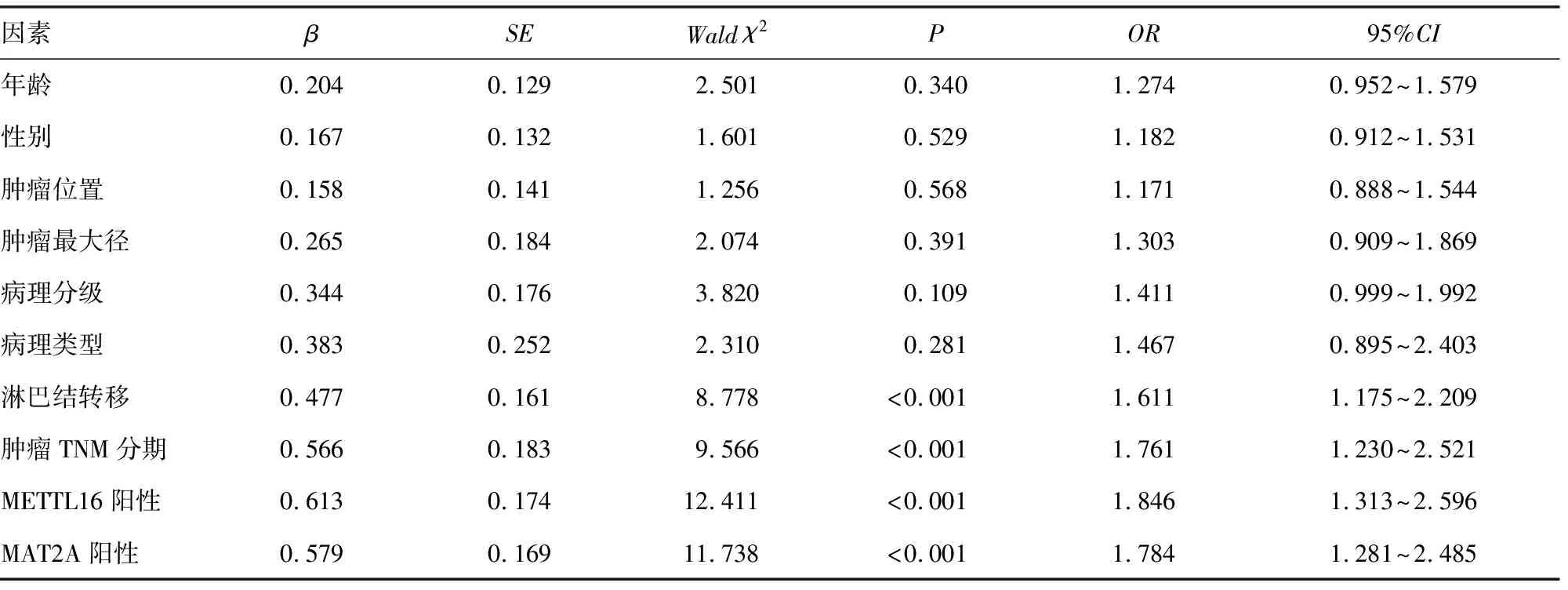
表2 单因素COX比例风险模型分析影响胃癌患者预后的危险因素
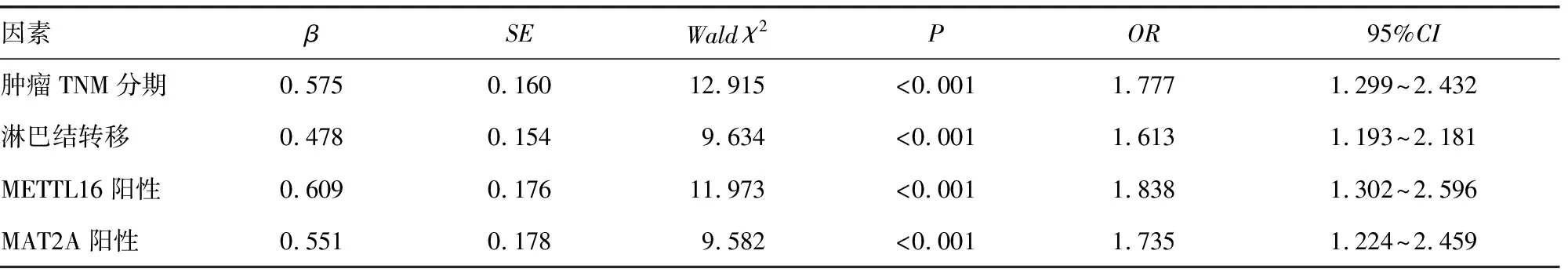
表3 多因素COX比例风险模型分析影响胃癌患者预后的独立危险因素
3 讨 论
胃癌是我国常见消化系统恶性肿瘤,每年新发病例42.4万例,死亡病例29.8万例[7]。目前胃癌的治疗以手术治疗及辅助放化疗治疗为主,但对于中晚期患者,即使经积极治疗,仍可发生肿瘤复发或转移,导致患者死亡[8]。因此,深入探索胃癌疾病机制,寻找能够评估胃癌预后的肿瘤标志物,具有重要意义。胃癌的发生、发展与遗传和环境因素有关,涉及癌基因过度激活,抑癌基因的失活及转录翻译过程的异常。肿瘤中存在RNA修饰异常的现象,如m6A RNA甲基转移酶的甲基化修饰可通过影响RNA的剪接、易位和稳定性,调节细胞发育、干细胞分化等过程[9]。
METTL16是一种m6A甲基转移酶,通过促进RNA的m6A修饰,甲基化小核糖核苷酸U6、长链非编码RNA多个靶点。METTL16在胰腺癌、乳腺癌等恶性肿瘤中过度表达,其通过促进肿瘤细胞的恶性增殖及转移,导致患者预后不良[10-11]。本研究中,胃癌组织中METTL16表达明显升高,提示METTL16可能参与胃癌的肿瘤发生。研究表明,肿瘤中存在METTL16基因启动子区扩增突变的现象,引起肿瘤细胞微卫星不稳定及肿瘤内异质性的发生,导致肿瘤的恶性进展[12]。本研究中,胃癌中METTL16的表达与肿瘤TNM分期及淋巴结转移有关,提示METTL16的表达升高参与促进胃癌的恶性增殖和转移。研究表明,胃癌中METTL16的表达升高能够促进细胞周期素激酶D1的表达,进而诱导胃癌肿瘤细胞G1期向S期转换,导致肿瘤细胞的过度增殖[13]。此外,METTL16能够通过甲基化修饰长链非编码RNA转移相关肺腺癌转录物1,激活β-连环蛋白及下游基质金属蛋白酶9的表达,促进肿瘤血管生成拟态及血管新生,导致肿瘤细胞的转移[14-15]。本研究发现,METTL16阳性表达的胃癌患者生存预后较差,是影响胃癌患者预后的独立危险因素,表明检测癌组织中METTL16的表达有助于评估患者的临床预后。METTL16的表达升高导致顺铂等化疗药物治疗敏感性降低,因而筛选能够抑制METTL16的小分子药物,有助于改善肿瘤患者化疗耐药的形成,这可能是新的肿瘤治疗策略[16]。
MAT2A是甲硫氨酸循环中的限速酶,催化甲硫氨酸和三磷酸腺苷合成S-腺苷蛋氨酸,S-腺苷蛋氨酸作为体内的重要甲基供体,参与多胺合成等细胞代谢过程[17]。近年来发现,肝癌中MAT2A的表达上调,其可通过激活磷脂酰肌醇3激酶,促进癌基因c-MYC的表达,导致肿瘤细胞的过度增殖[18]。本研究中,胃癌组织中MAT2A表达升高,提示MAT2A可能与胃癌的肿瘤发生有关。MAT2A表达上调的机制与转录后调控异常有关。研究发现,肿瘤发生时环状RNA_0044516表达异常升高,其作为分子海绵结合抑制微小RNA-361的表达及功能,导致微小RNA-361不能结合到MAT2A mRNA的3′非编码区,MAT2A mRNA的稳定性增加,促进MAT2A的表达[19]。本研究中,MAT2A表达与肿瘤TNM分期及淋巴结转移有关,提示MAT2A参与促进胃癌的进展,其机制与MAT2A参与肿瘤代谢重编程有关。研究表明,MAT2A通过增加受体相互作用蛋白1基因启动子区组蛋白H3K4甲基化水平,增加肿瘤细胞内甲硫氨酸循环活性,进而促进肿瘤相关巨噬细胞向M1型极化,促进肿瘤的免疫逃逸[20]。此外,肿瘤中MAT2A通过激活磷酸腺苷激活的蛋白激酶,促进程序性细胞死亡蛋白6的表达,进而促进肿瘤细胞的过度增殖[21]。本研究中,MAT2A阳性表达的胃癌患者生存预后较差,并且是胃癌患者不良预后的独立危险因素,提示MAT2A的表达有助于评估胃癌患者的预后。有研究报道,胃癌中MAT2A的表达升高促进长链脂酰辅酶A合成酶3基因启动子区组H3K4三甲基化,进而激活长链脂酰辅酶A合成酶3的表达,导致胃癌细胞铁死亡抗性的形成,降低肿瘤细胞对顺铂等化疗药的敏感性[21-22]。因此,胃癌中MAT2A的高表达在胃癌的恶性进展中发挥重要作用,可能是胃癌治疗的潜在的靶标。
本研究中,胃癌组织中METTL16与MAT2A表达呈显著正相关,提示两者在胃癌发生、发展过程中可能存在协同的作用。研究表明,METTL16作为甲基转移酶,能够与MAT2A mRNA结合,增加MAT2A mRNA的稳定性,促进MAT2A的表达[23]。但目前两者在胃癌中的具体作用机制有待深入研究。
综上所述,胃癌中METTL16、MAT2A表达升高,两者表达与肿瘤TNM分期及淋巴结转移有关,均参与胃癌的发生、发展。METTL16、MAT2A阳性表达是影响胃癌患者预后的危险因素,可作为新的反映胃癌预后的生物标志物。本研究也存在一定的不足,本研究样本量有限,随访时间较短,有待今后开展前瞻性、多中心大样本的临床实验来进一步完善,从而深入分析两者在胃癌中的临床意义。

