基于公共数据库筛选直肠癌免疫相关的预后基因
葛 楠,高 飞,杨国旺
首都医科大学附属北京中医医院肿瘤科,北京 100010
直肠癌是由多因素参与形成的疾病。目前免疫检查点抑制剂在多种实体肿瘤中显示出良好的效果,但是对于微卫星稳定/无错配修复缺陷的直肠癌患者,免疫疗法获益仍有限[1]。肿瘤微环境在直肠癌的发生、发展起重要作用,免疫细胞作为肿瘤微环境的重要组成部分,影响肿瘤的进展、预后及免疫药物的治疗效果。所以研究免疫微环境对于提高直肠癌患者的免疫治疗效果具有重要意义。本研究从基因表达汇编数据库(GEO)获取203例直肠癌转录组测序数据,通过ESTIMATE算法(一种使用表达数据估计恶性肿瘤组织中的基质细胞和免疫细胞的方法)对数据集进行基质评分及免疫评分,分析评分结果与直肠癌临床特征和预后的关联,筛选出影响直肠癌预后的重要基因,为直肠癌免疫相关新靶点的研究提供参考。
1 材料与方法
1.1数据来源及处理 从GEO公共数据库(https://www.ncbi.nlm.nih.gov/geo/)检索人源直肠癌基因表达数据,下载数据集GSE87211,平台信息:GPL13497。基因芯片信息:Agilent-026652 Whole Human Genome Microarray 4×44K v2。该数据集包含肿瘤组织203例。对下载的基因芯片表达数据进行预处理,包括将基因对应多个探针取均值,探针名称转化为标准基因名称,以及对基因芯片数据进行校正、标准化处理等。
1.2方法
1.2.1基质评分、免疫评分的计算及相关差异表达基因的筛选 利用ESTIMATE算法计算基质评分及免疫评分,以评分的中位数为界,将肿瘤组织分为高评分组及低评分组。以|log2FC|>0.5(FC表示差异倍数),校正后P值<0.05为差异表达基因的筛选条件,筛选差异表达基因并取交集。采用R软件(版本:4.2.1)进行分析及热图绘制。使用VennDiagram程序包分别对基于免疫分数和基质分数得到的差异表达基因取交集,获得共表达基因。
1.2.2基因功能分析 使用R软件的clusterProfiler、enrichplot程序包对取交集获得的差异表达基因进行基因本体论(GO)功能富集分析以及京都基因与基因组百科全书(KEGG)通路分析。GO分析主要用来揭示基因的生物学过程(BP)、细胞组分(CC)、分子功能(MF)。KEGG富集分析主要用来分析基因参与的信号通路。
1.2.3差异基因的预后分析 将差异基因与临床数据进行整合,以差异表达基因的中位值为界,将直肠癌分为高表达组和低表达组,使用R软件的survival程序包进行Kaplan-Meier生存分析,研究关键基因表达水平与直肠癌患者总生存期的相关性。
1.2.4关键基因的外部验证 使用UALCAN在线网站(http://ualcan.path.uab.edu/)验证筛选的关键基因与直肠癌生存的关系。
2 结 果
2.1直肠癌免疫和基质评分与预后、临床特征关系 删除了生存时间不详的样本,对剩余196例直肠癌肿瘤数据样本进行免疫和基质评分与总生存期、临床特征的关系分析。结果显示,高免疫评分与低免疫评分患者,高基质评分与低基质评分患者生存预后比较,差异无统计学意义(P>0.05),见图1。进一步将患者的临床特征(年龄、是否有KRAS基因突变、T分期、是否有淋巴结转移、是否存在远处转移)与免疫/基质评分进行联合分析,结果显示,KRAS基因突变型患者免疫评分低于野生型患者(P=0.033),KRAS基因状态可能在一定程度上影响机体免疫细胞浸润程度。存在远处转移患者基质评分高于无转移患者(P=0.002),基质评分可能反映直肠癌恶性程度。免疫/基质评分与患者年龄、T分期、是否有淋巴结转移无关(P>0.05)。见图1。

注:A为免疫高评分组和低评分组患者生存曲线图;B为基质高评分组和低评分组患者生存曲线图;C为不同KRAS基因状态患者的免疫评分;D为不同远处转移情况患者的基质评分。
2.2高、低免疫/基质评分组的差异表达基因筛选 高、低免疫评分组间共筛选得到1 632个差异基因,包括1 243个上调基因和389个下调基因。高、低基质评分组间共筛选得到2 446个差异基因,包括1 778个上调基因和668个下调基因。将两者表达上调的基因数据集和两者表达下调的基因数据集取交集绘制韦恩图,得到799个上调基因和146个下调基因,共945个共表达基因。
2.3共表达基因GO分析和KEGG通路分析 945个共表达基因主要富集于免疫细胞迁移、趋化、黏附、增殖、活化与调节等BP,细胞膜、细胞外基质、组织相容性复合体(MHC)Ⅱ类蛋白复合物等CC,受体配体活性、趋化因子活性、细胞因子和受体活性等MF。KEGG通路分析表明,基因主要在细胞因子间相互作用、白细胞介素(IL)-17信号通路,细胞黏附分子等方面富集。见图2。
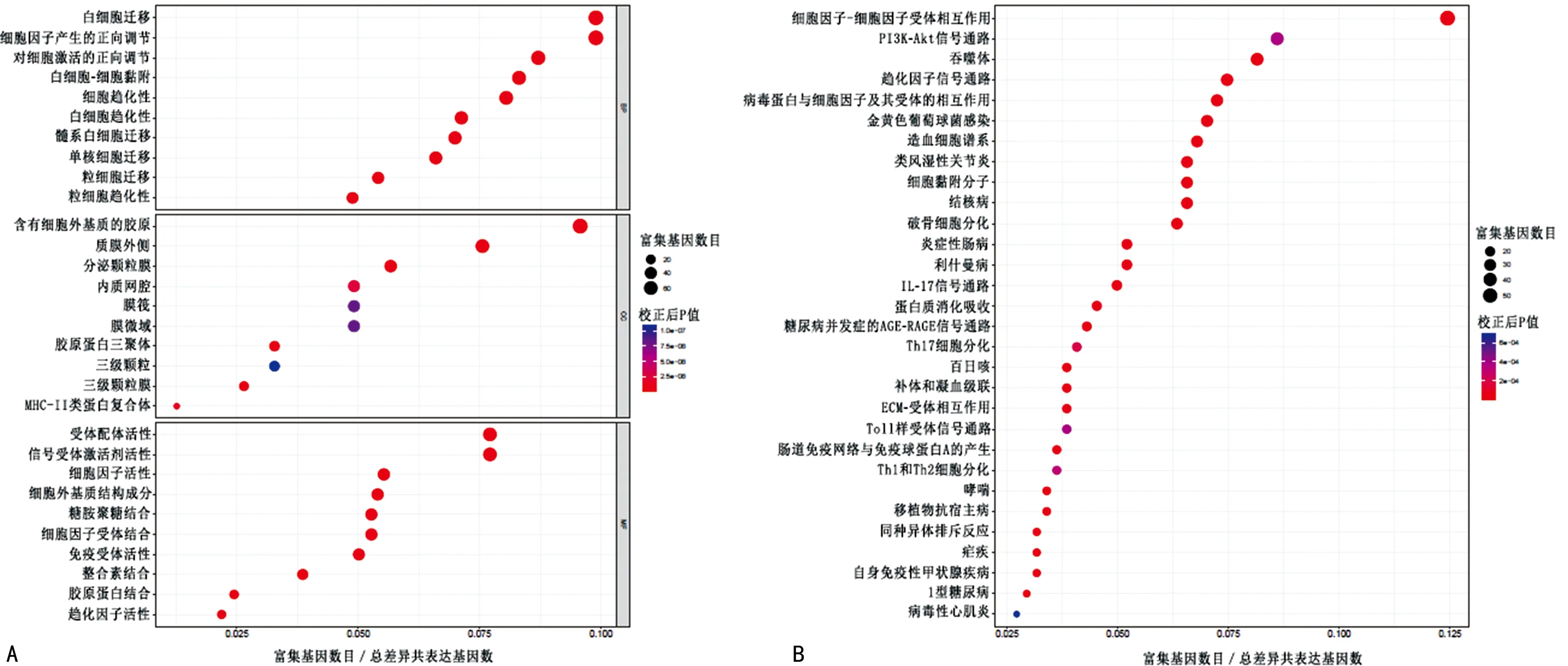
注:A为前10位差异性较大的共表达基因GO富集分析气泡图;B为前10位差异性较大的共表达基因KEGG富集分析气泡图。
2.4预后基因筛选及验证 为进一步筛选对直肠腺癌患者的预后具有影响的基因,对945个共表达基因和总体生存情况之间的关系进行了分析,结果显示148个基因与总体生存相关(P<0.05),筛选出以下4个基因:ERM样蛋白(ERMN)、受体活性修饰蛋白1(RAMP1)、鞘氨醇1磷酸酯受体3(S1PR3)、肿瘤坏死因子α诱导蛋白2(TNFAIP2)。直肠癌患者中,上述4个基因高表达组的总生存期显著短于低表达组(P<0.05)。通过UALCAN在线网站验证以上4个基因对直肠癌的预后影响,结果证实ERMN、RAMP1、S1PR3、TNFAIP2这4个基因低表达组有更多的生存获益。见图3。
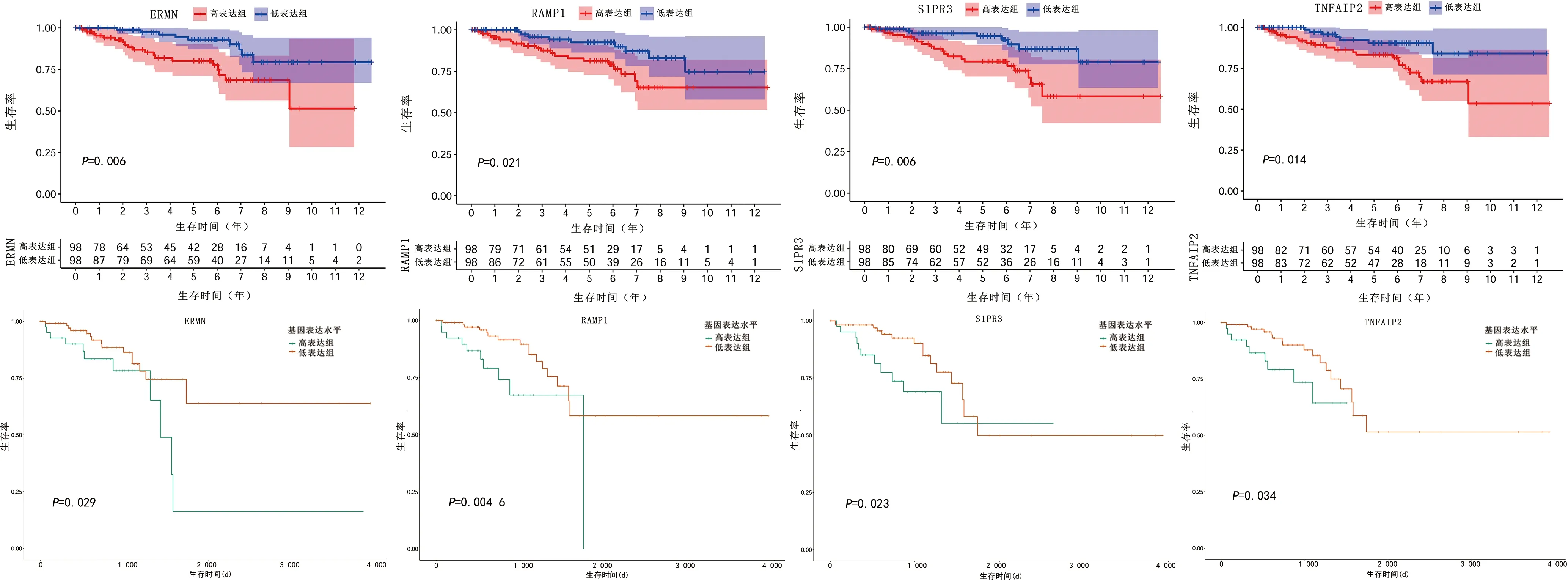
注:A—D分别为ERMN、RAMP1、S1PR3、TNFAIP2高、低表达组的生存分析图;E—H分别为UALCAN在线网站验证ERMN、RAMP1、S1PR3、TNFAIP2 4个基因表达与生存的关系。
3 讨 论
根据世界卫生组织国际癌症研究机构发布的全球癌症负担数据显示,结直肠癌已成为全球第三大常见癌症和第二大癌症死亡原因[2]。虽然根治性切除是治疗结直肠癌的首选可靠方法,但仍有70%患者发生术后转移[3]。20%~25%的患者在疾病初期即发现远处转移而丧失手术治疗机会[4],其中直肠癌占这些病例的1/3。晚期直肠癌患者的预后仍然很差[5]。
直肠癌细胞与肿瘤微环境相互作用促进直肠癌的发生、发展。肿瘤微环境的主要成分包括血管细胞、间充质干细胞、免疫细胞、炎性细胞、细胞外基质等[6-8],参与肿瘤细胞增殖的免疫调节、化学疗法耐药性的产生和生物免疫耐受的诱导形成等。在肿瘤微环境中,免疫细胞和基质细胞是两种主要的非肿瘤成分,并且对肿瘤的发生、发展和侵袭具有重要影响[9]。为了更好地研究肿瘤微环境,YOSHIHARA等[10]通过分析免疫和基质细胞的特定基因表达特征,创建了一种名为ESTIMATE的算法,此算法是一种基于表达数据估计肿瘤样本的免疫细胞和基质细胞的方法,以计算免疫评分和基质评分预测非肿瘤细胞在恶性肿瘤组织的渗透程度。
本研究结果显示免疫/基质评分的高低与直肠癌的生存预后之间无明显的关联,原因可能如下。一方面,影响直肠癌预后的因素不仅仅包含肿瘤微环境,也包括肿瘤分期、RAS基因情况、患者体能状态、治疗方式等,本课题组评估的是GSE87211数据集中所有直肠癌的患者,这些患者的临床特征存在差别,所以肿瘤微环境对于生存的影响会受到其他条件的影响;另一方面,不同免疫细胞及基质细胞在肿瘤预后中发挥的作用也有不同,所以结果未显示出免疫微环境评分与生存预后的关联。由于肿瘤微环境会影响肿瘤的生长和发展,于是本课题组又分析了肿瘤患者临床特征与肿瘤微环境的关系,结果显示,KRAS基因突变型患者免疫评分低于野生型患者,存在远处转移患者基质评分高于无转移患者,提示基质评分可能是反映直肠癌恶性程度的有用指标。在结直肠癌患者中,KRAS基因突变的发生率约为30%~50%,并与不良预后和转移有关[11]。LIU等[12]研究证实与KRAS野生型结直肠癌患者相比,NF-κB和T细胞受体信号通路在KRAS突变的结直肠癌患者中受到显著抑制,同时巨噬细胞M1和活化的CD4+记忆T细胞减少。提示KRAS基因突变会影响结直肠癌的免疫相关通路。
GO分析显示差异共表达基因富集于免疫细胞迁移、趋化、黏附、细胞因子增殖、活化与调节等BP,细胞膜、细胞外基质、MHCⅡ类蛋白复合物等CC,受体配体活性、趋化因子活性、细胞因子和受体活性等MF。KEGG通路分析表明,基因主要在细胞因子间相互作用、IL-17信号通路,细胞黏附分子等方面富集。
GO分析和KEGG分析显示,差异表达基因主要富集于免疫细胞及细胞因子的生物学功能,细胞膜、细胞外基质、MHCⅡ类蛋白复合物,以及IL-17信号通路等方面。细胞外基质作为细胞生存的内环境,其成分或结构变化都会影响肿瘤发生、发展[13]。细胞外基质可通过多种途径对结直肠癌细胞增殖、侵袭、凋亡及不同的信号通路产生影响[14-16]。有研究报道,MHCⅡ通过与MHCⅠ互补的方式限制了肿瘤相关基因的突变[17],MHCⅡ在抗肿瘤反应中具有关键功能。IL-17与受体IL-17R组成的异二聚体发出信号,可激活NF-κB、MAPKs等下游通路,已被证实参与多种肿瘤的形成、生长和转移。
ERMN是参与髓鞘形成过程的必需基因[18],是叶酸代谢紊乱的主要靶点[19],在神经系统疾病中表达失调[20],ERMN基因的表达改变与胶质瘤预后有关[21]。ERMN在前列腺癌的微环境中高度表达,并具有调节肿瘤免疫反应的潜力[22]。ERMN基因与Wnt途径有关,可能是驱动肝母细胞瘤的候选基因[23]。关于ERMN基因在直肠癌报道中较少,本研究结果显示,ERMN基因的高表达与直肠癌的不良预后有关,提示ERMN在直肠癌发展中起到促进作用。
RAMP1与G蛋白偶联受体相互作用,调节血管活性肠肽受体、降钙素受体等信号传递能力[24]。DALLMAYER等[25]发现,RAMP1的敲除降低了尤文肉瘤克隆形成,针对RAMP1受体的小分子抑制剂减少了尤文肉瘤的生长。LOGAN等[26]的研究显示,RAMP1缺失会降低前列腺癌细胞的增殖和致瘤性。在直肠癌方面,研究显示高表达的RAMP1预示着直肠癌患者更短的生存期,RAMP1可能是一个参与直肠癌发生的靶基因。
YAN等[27]对癌症基因组图谱(TCGA)数据库的分析表明,S1PR3高表达的患者生存预后比低表达的患者更差,动物实验结果也表明,S1PR3可促进肾细胞癌的发生和转移。在乳腺癌的患者中S1PR3高表达,敲除乳腺癌肿瘤细胞中的S1PR3可有效延缓体内肿瘤生长和降低肺转移概率[28]。张佳等[29]的研究显示,S1PR3在急性T淋巴细胞性白血病(T-ALL)中发挥癌基因的作用,抑制S1PR3可抑制T-ALL异种移植小鼠模型疾病进展。本研究结果也显示,在直肠癌中,S1PR3高表达的患者预后更差,提示S1PR3作为机体的癌基因在肿瘤发生、发展中起到促进作用,未来也许可以针对S1PR3基因靶点开发抗肿瘤药物。
TNFAIP2基因通过调节肿瘤细胞活力和分化,参与肿瘤的发生和发展。有研究报道,TNFAIP2在肾癌组织中异常高表达,且TNFAIP2的高表达与肿瘤的分期、分级、淋巴结转移、免疫细胞丰度密切相关,TNFAIP2高表达提示病情恶化及总生存期缩短[30]。TNFAIP2还参与幽门螺杆菌感染后胃癌发病过程,并且会促进肿瘤的侵袭和转移[31]。此外,TNFAIP2在其他实体瘤如宫颈癌、肺癌、尿路上皮癌中也高表达[32-34]。本研究结果证实TNFAIP2基因可能是直肠癌患者的一个风险因素,高水平的TNFAIP2预示着更差的临床结局及更短的生存期。
综上所述,本研究通过生物信息学分析方法对GEO数据库中的GSE87211数据集进行分析,发现在直肠癌患者中KRAS基因状态及远处转移影响机体免疫微环境状态。在免疫/基质评分高、低组间筛选出945个差异表达基因,其中148个基因与预后相关,通过外部数据库验证,确定ERMN、RAMP1、S1PR3、TNFAIP2这4个基因的高表达可能与直肠癌的不良预后有关,为直肠癌可能的药物治疗靶点研究提供了参考。然而,本研究筛选出的4个基因在直肠癌中的作用还需要进一步的实验和临床大样本研究来验证,其具体的作用机制还需要进行更深入的探讨。

