灯盏花素对大鼠膝骨关节炎膝关节软骨的影响
李金磊,殷 红,刘维统,杨景帆*
(1. 昆明市中医医院,云南 昆明 650011;2. 昆明理工大学,云南 昆明 650500)
膝骨关节炎(osteoarthritis,OA)是1 种普遍的慢性关节疾病,是由关节软骨退行性增生引起的骨骼疾病。临床上表现为关节肿胀或疼痛以及运动障碍。膝OA 病程长,发病率随着年龄增长而增加,在老年人群中发病率较高[1-2]。炎症被认为是促进OA 发展的危险因素,软骨损伤与OA 的临床症状发展密切。目前,非甾体类抗炎药是膝OA 的临床一线治疗药物[3]。塞来昔布(celecoxib,Cel)是常用非甾体类抗炎药之一,在缓解疼痛和延缓疾病进程中具有良好的效果[3]。但由于Cel 具有胃肠道、心血管疾病副作用以及过敏反应,不可长期服用。灯盏花素(breviscapine,BE)是传统中草药灯盏花的类黄酮粗提物,主要活性成分是灯盏花乙素(4,5,6-三羟基黄铜-7-葡萄糖醛酸苷)[4]。最近的研究结果表明,BE 具有抗氧化应激[5]、抗细胞凋亡、神经功能改善[6]和抗炎等作用[7]。但关于BE 对OA 的作用尚不清楚。因此,本研究将探索BE 对膝OA 软骨损伤的调控作用。
1 材料和方法
1.1 实验动物 180~240 g(5 周龄,共32 只)雄性Sprague Dawley(SD)大鼠购自北京维通利华。大鼠适应性饲养1 周,饲养温度为(25±1)℃,相对湿度为50%左右,12 h 明暗交替。
1.2 主要试剂 HE 染色试剂盒(货号:G1120)、改良番红O-固绿软骨染色液(货号:G1371)、甲苯胺蓝染色液(货号:G2543)购自北京索莱宝生物科技有限公司;Collagen-Ⅱ(货号:ab34712)和p-JNK(货号:ab124956) 抗体购自Abcam;大鼠IL-1β(货号:ml037361)、TNF-α(货号:ml002953)、IL-6(货号:ml102828)ELISA 检测试剂盒购自上海酶联生物科技有限公司。氯化钠购自上海阿拉丁生化科技股份有限公司。BE(编号:14002000884,规格:20 mg×24 s)购自广州彼迪药业有限公司。Cel(编号:14201843485,规格:0.2 g×6 s)购自辉瑞制药有限公司。
1.3 动物模型 32 只雄性大鼠随机分为4 组:sham组、OA 组、OA+BE 组、OA+Cel 组,8 只/组。采用内侧半月板切除手术构建OA 大鼠模型。大鼠购买后饲养4 周,用(2.5±3)%的异氟醚麻醉大鼠。OA 大鼠模型构建方法:1 mL/100 g 的戊巴比妥那麻醉大鼠,在髌骨远端至胫骨近端平台上剪1 个3 cm 的纵向切口,切开紧靠膑腱内侧的关节囊,用显微外科剪刀切开关节囊。髁间区脂肪垫的钝性解剖用于暴露髁间区,手术切除内侧半月板,用可吸收缝线缝合手术切口。Sham 组大鼠除不进行内侧半月板切除外,其余操作均与OA 组相同。手术后,OA+BE 组大鼠每天灌胃40 mg/kg BE,OA+Cel 组 大 鼠 每 天 灌 胃30 mg/kg Cel,OA 组 和sham 组同等剂量的生理盐水灌胃。灌胃6 周后取材。该研究获得昆明市中医医院实验动物伦理委员会批准。
1.4 苏木精-伊红(hematoxylin & eosin,HE)染色取各组大鼠的膝关节组织,4%多聚甲醛用于固定各组大鼠膝关节组织,48 h 后脱钙21 d,经脱水、石蜡包埋后切片。放入二甲苯中脱蜡以及浓度依次升高的乙醇中复水,再用蒸馏水浸润5 min。利用苏木精染液染色,5 min 后通过流水洗去部分苏木精染液。0.5%盐酸乙醇分色至细胞核和核内染色染色质清晰。流水洗涤15 min 至细胞核呈蓝色。蒸馏水冲洗后用0.5%伊红染色5 min,经浓度依次升高的梯度乙醇脱水后用二甲苯透明,滴加中性树胶封片。显微镜观察染色结果。
1.5 番红O 固绿染色 各组骨组织固定后,经脱钙、脱水和石蜡包埋处理并切片,再用二甲苯Ⅰ和Ⅱ脱蜡以及梯度乙醇复水。经流水洗涤后用番红染液染色1 h,自来水洗去多余染料,用乙醇脱色。随后用固绿染液染色60 s,无水乙醇脱水,二甲苯溶液透明5 min,封片。显微镜采集图像后进行分析。
1.6 甲苯胺蓝染色 骨组织经脱钙处理,石蜡包埋后切片。用二甲苯脱蜡两次,梯度乙醇脱蜡至水。切片用甲苯胺蓝染色液染色30 min,随后经自来水洗涤2 min,滤纸吸去切片表面的水分。加入丙酮分化至切片中的软骨细胞呈紫蓝色且清晰可见,再用乙醇逐级脱水。在切片上滴加二甲苯使切片透明,最后加入中性树胶用于封片。显微镜观察各组大鼠膝关节骨组织软骨损伤情况。
1.7 免疫组织化学(immunohistochemistry,IHC)染色4%多聚甲醛固定后的大鼠膝关节骨组织经脱钙、脱水、石蜡包埋处理后,采用连续矢状切片将膝关节组织切成4 μm 厚的切片。切片脱蜡、复水,用PBS洗涤3 次×5 min。将载玻片浸入修复液中修复抗原,10% H2O2用于去除内源性过氧化物,经PBS 洗涤后放入10%胎牛血清在室温中封闭1 h。随后将切片与一抗在4 ℃条件下孵育过夜,洗涤后与二抗在室温中孵育2 h。切片洗涤后将DAB 溶液滴至切片上进行显色反应,10 min 后滴加去离子水终止反应。为有助于检测结果的判读用苏木精对细胞核进行复染,切片经脱水、中性胶封片后,利用显微镜观察染色结果。
1.8 酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA) 灌胃后的第6 周,通过心内穿刺收集各组大鼠的血液,置于不含EDTA 的离心管中。在室温中静置1 h 后离心机离心10 min,将血清转移至新的离心管中,并置于-80℃冰箱中保存备用。大鼠IL-1β、TNF-α 和IL-6 检测试剂盒分别用于测定大鼠血清中IL-1β、TNF-α 和IL-6 的浓度。参照试剂盒说明书,分别检测各组大鼠血清中IL-1β、TNF-α 和IL-6 水平。
1.9 统计学分析 通过GraphPad Prism 8.0 软件对实验数据进行统计并作图,数据采用均数±标准差(±s)表示,采用t 检验,组间比较采用单因素方差分析(ANOVA)统计。统计结果P<0.05 为差异有统计学意义。
2 结果
2.1 BE 对OA 模型大鼠软骨损伤和细胞免疫浸润的影响 取各组大鼠膝关节软骨组织进行HE 染色(图1),染色显示sham 组大鼠膝关节软骨清晰,表面光滑、完整。OA 组中,软骨表面粗糙,出现滑膜增生和炎性细胞浸润,软骨层与sham 组相比变薄,表明OA大鼠模型成功构建。相比较于OA 组,OA+BE 组和OA+Cel 组大鼠软骨组织中炎性细胞浸润减少,软骨层增厚,表明BE 可缓解大鼠膝骨关节炎的软骨损伤。见图1。
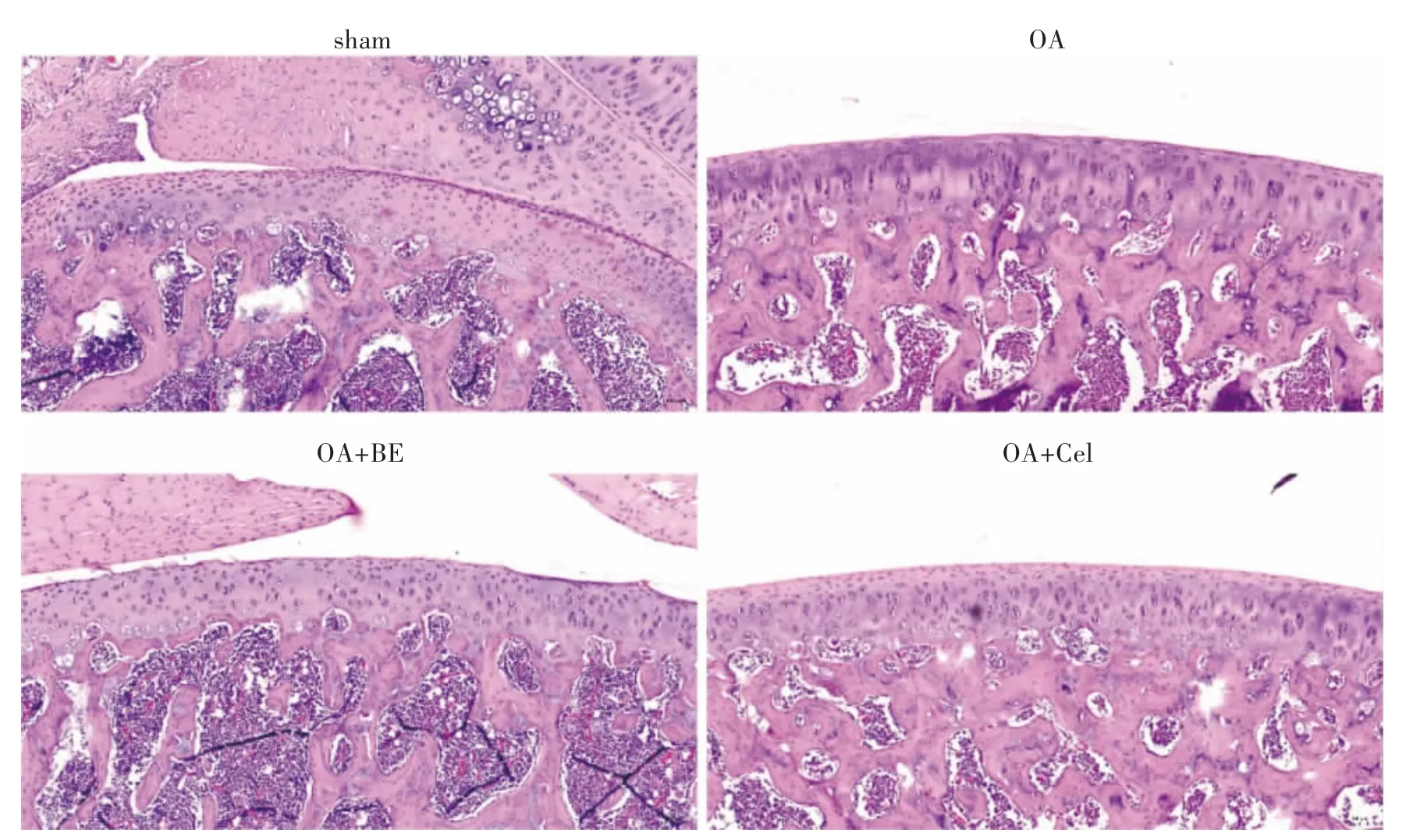
图1 HE 染色观察OA 大鼠膝关节软骨损伤情况(10×)
2.2 番红O-固绿染色观察大鼠软骨损伤的情况
番红O-固绿染色中,嗜酸性的软骨与碱性染料番红O 结合呈红色,嗜碱性的骨组织与酸性染料固绿结合被染成绿色或蓝色。染色结果和Mankin’s 评分表明,相比较于sham 组,OA 组中大鼠关节红色染色较浅,软骨减少(P<0.0001),软骨下骨增厚,结构紊乱。OA+BE 组和OA+Cel 组中红色软骨层明显厚于OA 组(P<0.0001),说明BE 可一定程度缓解DMM 诱导的大鼠膝OA。见图2。
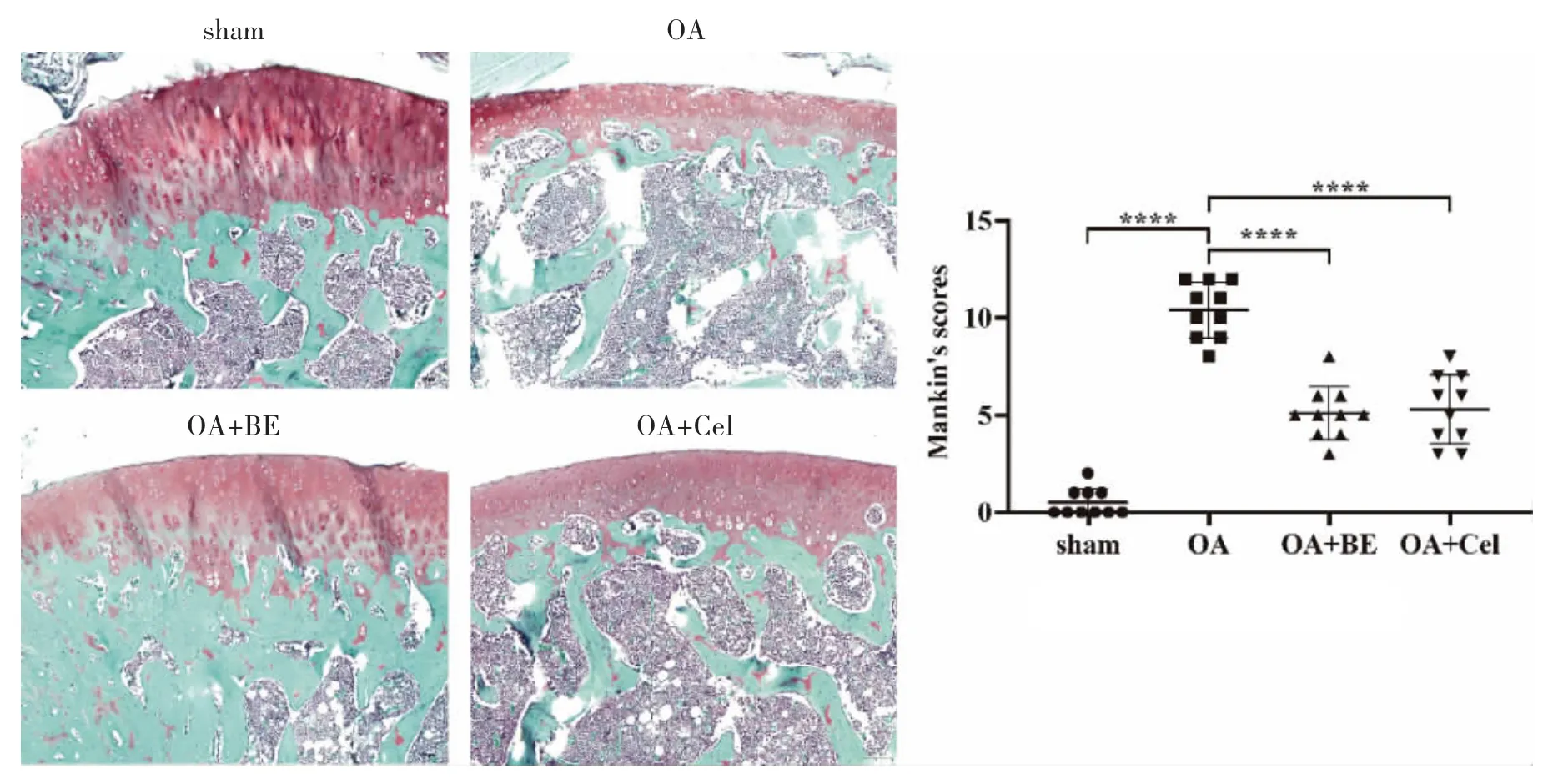
图2 番红O 固绿染色观察软骨损伤情况(10×)
2.3 甲苯胺蓝染色观察BE 对OA 模型大鼠的软骨损伤情况的影响 甲苯胺蓝染色可使软骨呈紫色,其他为浅蓝色。染色结果表示,OA 组中大鼠膝关节软骨层厚度与sham 组相比明显变薄(P<0.0001)。OA+BE 组和OA+Cel 组中的软骨层厚度比OA 组相比增厚(P<0.05)。由此表明,BE可显著改善OA 大鼠的软骨损伤。见图3。
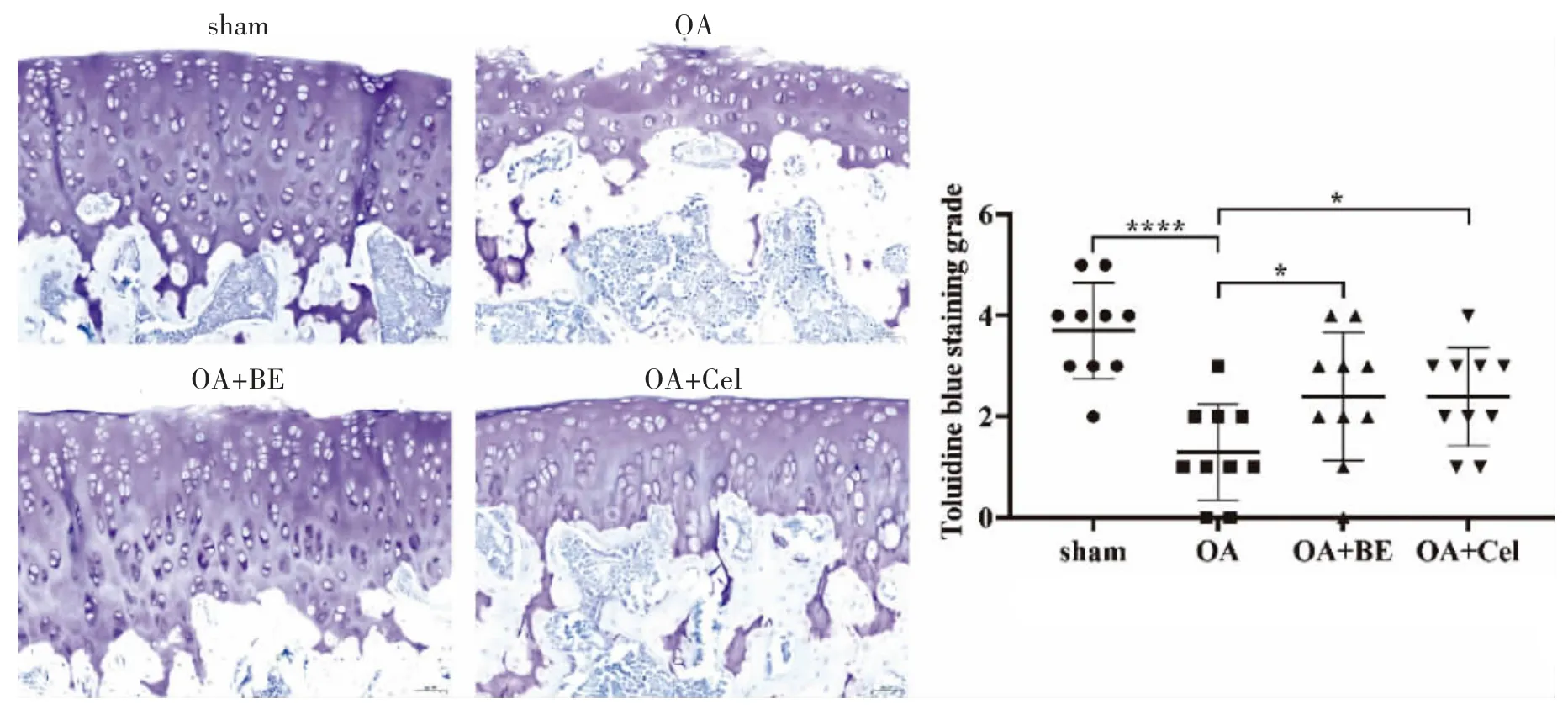
图3 甲苯胺蓝染色观察大鼠软骨损伤(20×)
2.4 BE 可促进OA 大鼠软骨组织中Collagen-Ⅱ和p-JNK 的阳性率的影响 IHC 染色结果显示,相比较于sham 组,OA 组中Collagen-Ⅱ的阳性率降低而p-JNK 的阳性率升高。OA+BE 组和OA+Cel 组中Collagen-Ⅱ的阳性率高于OA 组,p-JNK 的阳性率与OA 组相比降低。由此可知,BE 可逆转DMM 诱导的OA 大鼠膝关节中Collagen-Ⅱ减少以及p-JNK 阳性率的增多,我们推测BE 可能通过调控JNK 信号通路参与DMM 诱导的膝OA 的发展进程。见图4。
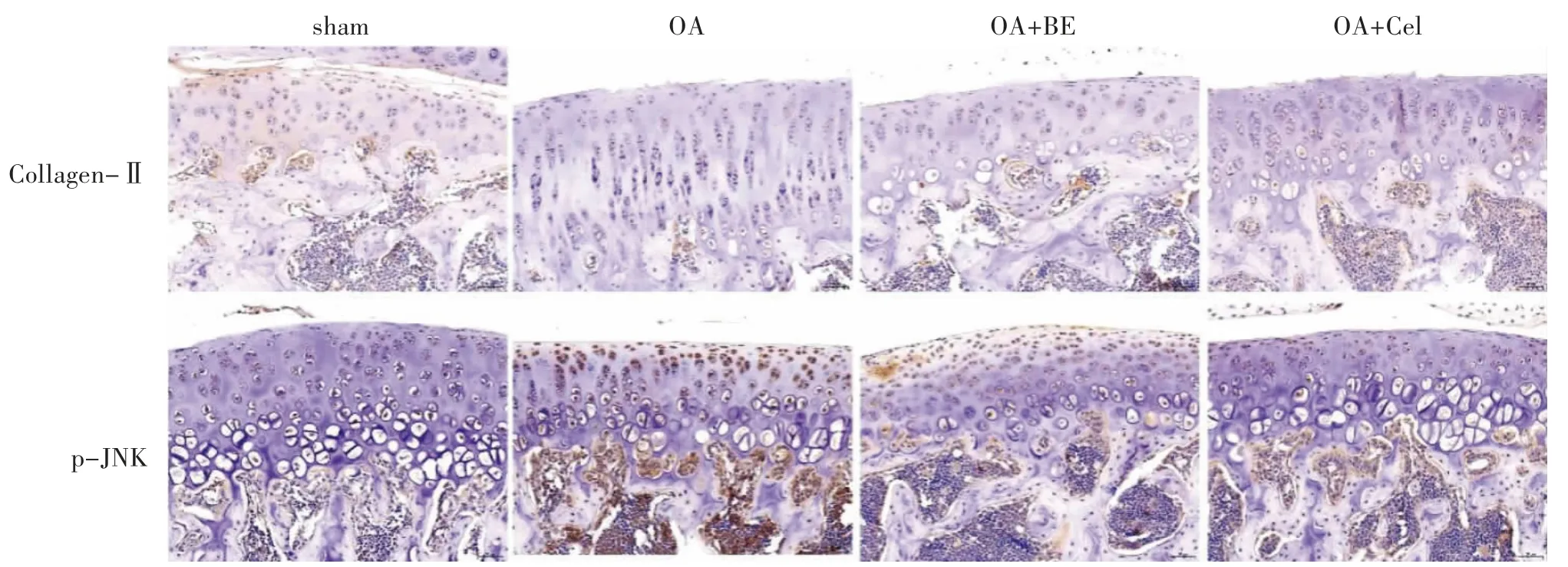
图4 IHC 检测Collagen-Ⅱ和p-JNK 阳性率(20×)
2.5 ELISA 试剂盒检测OA 大鼠血清中炎性细胞因子IL-1β、TNF-α 和IL-6 浓度 收集各组大鼠的血清,通过ELISA 试剂盒检测炎性细胞因子IL-1β、TNF-α 和IL-6 的浓度。实验表明,相比较于sham组,OA 组中促炎细胞因子IL-1β、IL-6 和TNF-α 浓度明显增多。OA+BE 组和OA+Cel 组中促炎细胞因子IL-1β、IL-6 和TNF-α 浓度显著低于OA 组。由此可知,BE 可下调DMM 诱导的大鼠血清中促炎细胞因子浓度的增加。见图5。
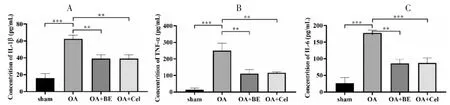
图5 ELISA 试剂盒检测血清中IL-1β、TNF-α 和IL-6 的浓度
3 讨论
膝OA 不仅是关节软骨的退行性疾病,在炎症作用下软骨细胞合成的蛋白多糖减少,会导致免疫功能受损,进一步破坏关节软骨,加重炎症反应。骨性关节炎的特征是伴随软骨下骨的硬化改变以及骨赘进展的透明关节软骨的逐渐丧失,表现为患者膝关节经常疼痛、肿胀以及活动受限,严重影响患者的生活和学习[8-9]。膝OA 可由性别、肥胖、衰老、退化、劳损感染以及外伤等因素引起。目前,临床上使用的药物可在一定程度上缓解疾病,但一般维持时间较短,仍无法治愈疾病。因此,寻找OA 的有效治疗药物仍然迫在眉睫。
BE 是类黄酮苷的混合物,具有抗炎、抗氧化、抗凋亡、抗血小板、抗凝以及心肌保护等多种生物活性,已在临床上用于治疗动脉粥样硬化、冠心病、脑供血不足等心脑血管疾病[10-11]。Lan 等报道,BE 可在多种动物模型中抑制代谢应激下的肝脏炎症和纤维化以及小鼠肝脏中的脂质积累[12]。在Yang 等人的报道中,BE 可通过上调miR-129-5p,靶向抑制ZFP91 的表达,从而抑制前列腺癌细胞的增殖和迁移,抑制疾病的发展进程[13]。在大鼠冠状动脉栓塞中,BE 可通过激活PI3K/AKT/GSK-3β 信号通路,改善大鼠心功能障碍、降低血清心肌损伤标志物水平、缩小心肌微梗死面积和降低心肌细胞凋亡指数以及心肌组织中的炎症细胞因子[14]。Peng 等[15]研究发现,BE 通过抑制NF-κB/NLRP3 通路的激活,抑制博来霉素诱导的小鼠肺纤维化的炎症反应和上皮间质转化。在本研究中,我们发现DMM 诱导的大鼠膝OA 关节软骨层厚度变薄,软骨细胞受损,炎性细胞因子增多,p-JNK 阳性率增高;大鼠经BE 灌胃后,关节软骨损伤得到缓解,软骨层增厚,炎性细胞因子减少,p-JNK 阳性率降低。
c-Jun N 末端激酶JNK(c-Jun N terminal kinase,JNK)又称应激激活蛋白激酶(stress-activated protein kinase),是MAPK 超家族的成员之一,参与炎症反应、氧化应激、细胞凋亡、细胞分化和细胞生长等多种生物过程[16-19]。同时,JNK 信号通路也被报道参与OA 的发展进程。例如,Li 等[16]研究发现,氢通过抑制JNK 信号的激活,减轻人OA 软骨细胞凋亡和炎症因子。抑制巨噬细胞中JNK-ERK-P38 的磷酸化水平可降低促炎细胞因子的水平和软骨细胞的凋亡,减弱小鼠OA[20]。JNK-JUN 信号依赖式上调NCOA4 的表达,促进软骨细胞的铁死亡,通过铁蛋白吞噬加重OA[21]。然而,Tong 等报道激活JNK-mTORC1-PTHrP信号通路可抑制OA 的发展进程[22]。本研究发现,DMM 诱导的OA 大鼠膝关节组织中p-JNK 阳性率增强,BE 可抑制p-JNK 的阳性率,我们推测JNK 信号通路参与BE 调控膝OA 的软骨损伤进程。
综上所述,本研究中我们证明BE 可通过抑制JNK 信号通路的激活,抑制OA 大鼠膝关节软骨损伤以及血清中炎症因子的水平。

