去氢木香内酯在内生真菌Y0 液体发酵中的生物转化研究
郭 晶,陈 帅,邹秋萍,刘明秀,李宝晶,何红平,汪伟光,李艳平*
(1. 云南中医药大学中药学院暨云南省南药可持续利用重点实验室,云南 昆明 650500;2. 云南中医药大学云南省傣医药与彝医药重点实验室,云南 昆明 650500;3. 云南民族大学国家民委民族药内生菌天然产物合成生物学重点实验室,云南 昆明 650500)
微生物转化(microbial transformation,MT)是通过微生物细胞将复杂的底物进行结构修饰,也就是利用微生物代谢过程中产生的某个或某一系列的酶对底物特定部位进行的催化反应[1]。近年来,微生物转化技术因具有反应类型广、特异性强、副产物少、反应条件温和可控、环保无污染等优点,已逐渐成为开发高活性、低毒性新药的一条高效途径[2-3]。利用微生物独特而多样的酶系统,以中药活性成分作为底物,将微生物转化技术应用于中药活性成分的结构修饰,可获得更多结构新颖活性显著的天然产物,可为现代中药研发提供一种新的有效路径。Ma 等[4]报道了Mucor polymorphosporus AS 3.3443 能够通过有效催化脱氢,使广木香内酯的C11-C13双键专一性还原转化为11α,13-二氢脱氢广木香内酯(11α,13-dihydrodehydrocostuslactone)。刘伟[5]发现Cunninghamella elegans AS 3.2028 能够转化莪术二酮为环氧化产物8,9-环氧化莪术二酮。Arakawa 等[6]报道了土曲霉和黑曲霉(Aspergillus terreus)(A. niger)对芽孢素A 的生物转化,获得了三种具有新颖结构骨架的倍半萜衍生物。与原始天然产物相比,真菌转化产物对HL-60细胞的细胞毒性更低。
木香(Aucklandia lappa)具有解痉、降压及抗菌作用[7],是多种中成药的组方之一,例如香砂养胃片,其中主要活性成分是木香烃内酯和去氢木香内酯,其中木香烃内酯0.400~1.463 mg/片,去氢木香烃内酯0.512~0.983 mg/片[8]。木香烃内酯为倍半萜内酯类化合物,结构中α-亚甲基-γ-内酯是其具有抗肿瘤活性的必要基团,天然存在的倍半萜内酯类化合物虽然种类多,但含量较少,相关研究也较少。去氢木香内酯具有愈创木烷骨架[9],被认为是生物合成倍半萜内酯的重要中间体,但因其较低的水溶性限制了它在临床上的应用,而通过具有立体和区域专一性的生物转化作用能够有效改善其溶解性和生物活性[10]。Choi 等[11]研究了去氢木香内酯的抗肿瘤活性,考察了其对人类乳腺癌细胞和卵巢癌细胞的作用,发现去氢木香内酯具有潜在的抗肿瘤活性。Park 等[12]的研究也表明去氢木香内酯和木香烃内酯还具有显著抑制人类乳腺癌细胞MCF-7 和MDA-MB-453 的活性。Liu 等[13-14]主要研究了木香烃内酯对人类肝癌细胞(Hepatic Cell Carcinoma)有丝分裂时细胞活力的影响,表明木香烃内酯可以降低人类肝癌细胞(HCC)有丝分裂时细胞活力,抑制细胞周期。以上研究表明木香中以木香烃内酯和去氢木香内酯为主的衍生物具有较好的生物活性和开发利用前景,而通过生物转化的方式利用富含丰富酶系的真菌对木香烃内酯和去氢木香内酯进行转化,有可能获得毒性较低,生物活性好的结构修饰产物[15]。本研究将探索木香烃内酯和去氢木香内酯在真菌Y0 中生物转化的情况。同时通过MTT 法检测转化产物对结肠癌细胞SW620 的细胞毒性,并根据网络药理学预测转化产物的作用靶点。
1 材料与方法
1.1 仪器和试剂 立式压力蒸汽灭菌器(上海博迅实业有限公司医疗设备厂);恒温振荡培养箱(常州国华电器有限公司);霉菌培养箱(上海一恒科学仪器有限公司);超净工作台(苏州安泰空气技术有限公司);分析天平;高效液相色谱仪(安捷伦公司);AV-600 Hz 核磁共振仪(德国Bruker 公司)。
乙酸乙酯(分析纯)、甲醇(色谱纯)、葡萄糖(分析纯);木香烃内酯、去氢木香内酯;PDA(Potato Dextrose Agar 马铃薯葡萄糖琼脂)培养基(上海博微生物科技有限公司);PDB 培养基(新鲜去皮马铃薯:葡萄糖:蒸馏水,比例为10 ∶1 ∶50);正相硅胶柱色谱(100~200 目)。
1.2 菌株培养鉴定和生物转化 去氢木香内酯和木香烃内酯分别在内生真菌Y0(Coniothyrium pyrinum)发酵液进行生物转化研究。用PDA 培养基活化菌株Y0,倒置于28 ℃恒温培养箱中培养,无菌条件下,挑取长势良好的新鲜菌落放入装有PDB 培养基离心管,恒温振荡培养箱28 ℃、120 rpm 培养。
分别称取50 mg 去氢木香内酯和木香烃内酯置于离心管中,加DMSO 溶解,用PTFE 膜过滤,制成25 mg/mL 的化合物溶液。取80 μL 化合物溶液至培养液(50 mL)中,混匀并做好标记,设置仅含培养基不含化合物溶液的菌液做为空白对照,恒温振荡培养箱28 ℃、120 rpm 培养。第1、3、5、7 天分别取发酵液(2 mL)用等体积乙酸乙酯超声提取,离心,取上清液旋干,用色谱甲醇溶解后用高效液相检测,在第3 天有转化产物生成。
1.3 提取、分离纯化及鉴定 培养液加入等体积乙酸乙酯超声提取30 min,离心,取上清液蒸干,浓缩。将浓缩液用硅胶柱色谱分离,用石油醚-乙酸乙酯(15 ∶1~1 ∶1 梯度洗脱),得到Fr 1~Fr 4,Fr 2 用高效液相色谱检测。采用色谱柱Zorbax SB-C18(250 mm×9.4 mm,5 μm);检测波长:210 nm;柱温:30 ℃;以乙腈为流动相A,水为流动相B,乙腈/水=40 ∶60(v/v);流速:流速3 mL/min 等度洗脱,得到化合物1(5 mg,tR=16.16 min)和化合物2(0.7 mg,tR=15.57 min)。通过薄层色谱GF254 硅胶板,以10%浓硫酸-乙醇显色检识转化产物,根据化合物波谱数据对化合物结构进行解析(1H NMR 和13C NMR)。
1.4 细胞毒检测方法 收集对数生长期的结肠癌SW620 细胞,以5×104个/mL 的密度接种于96 孔板(100 μL/孔),培养24 h 后去除旧培养基,加入含化合物1、化合物2,且浓度为10~50 μg/mL 的新培养基,并孵育24 h,丢弃上清,每孔加入10 μL 5mg/mL MTT 溶液,4 h 后,去除MTT 溶液,加入200 μL 二甲基亚砜(DMSO)。在波长为490 nm 的酶标仪下测定OD 值。根据以下公式计算细胞存活率:细胞存活率=(A 化合物组-A 调零组)/(A 对照组-A 调零组)×100%。
1.5 化合物1 和2 与结肠癌SW620 细胞靶点预测与分子对接 使用GeneCards(www.genecards.org)数据库和OMIM(omim.org)数据库获取结肠癌SW620细胞相关靶点;使用Swiss Target Prediction(www.swisstargetprediction.ch)数据库对化合物1 和化合物2 的靶点进行预测;使用Origin 2021 软件对两个化合物的靶点与疾病的靶点做交集维恩图;使用UniProt(www.uniprot.org)数据库和PDB(www1.rcsb.org)数据库获取两个化合物与疾病各自的交集靶点;使用PyMOL2.3.0 软件和ChemDraw 2020 软件对靶点蛋白和两个化合物分别进行分子对接前处理;使用Auto Dock Tools1.5.6 和Auto Dock Vina1.2.0 软件对两个化合物和各自的交集靶点蛋白进行分子对接;使用PyMOL 软件对对接结果进行可视化处理。
2 结果
2.1 高效液相色谱检测图 去氢木香内酯、木香烃内酯、Y0 菌液以及去氢木香内酯+Y0 菌液和木香烃内酯+Y0 菌液制成检测液,用乙腈-水(10%~100%)梯度分析30 min,检测结果如图1、图2 所示。
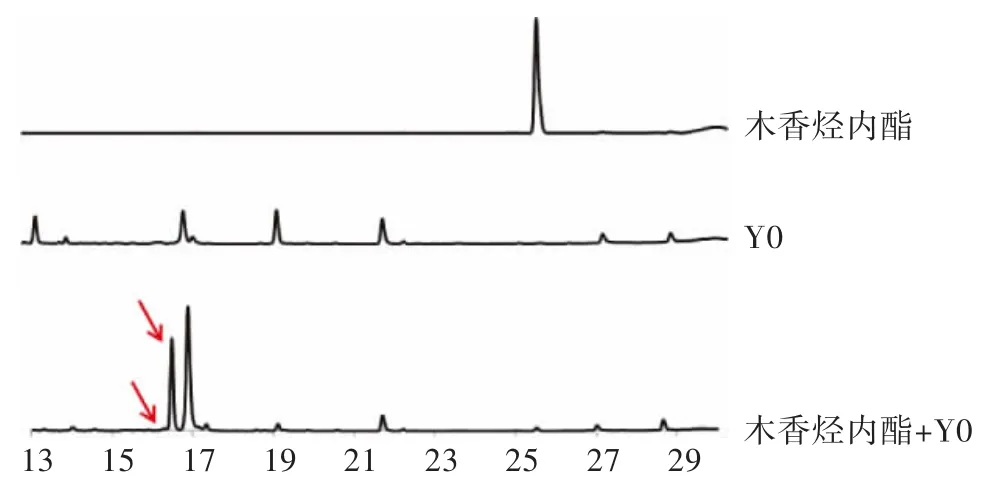
图1 去氢木香内酯、Y0 菌液、去氢木香内酯+Y0 菌液高效液相检测图
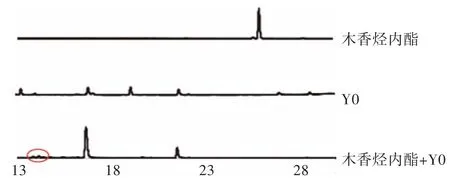
图2 木香烃内酯、Y0 菌液、木香烃内酯+Y0 菌液高效液相检测图
2.2 去氢木香内酯在Y0 液体发酵液中转化过程图
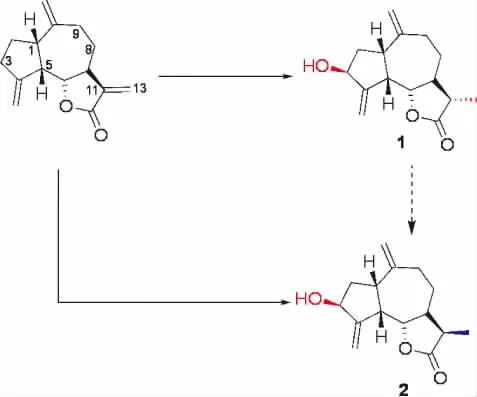
图3 去氢木香内酯在Y0 液体发酵液中转化过程图
2.3 结构鉴定
2.3.1 化合物1 黄色油状,C15H20O3,1H-NMR(600 MHz,acetone-d6)δH:2.81(1H,m,H-1),2.11(1H,m,H-2a),2.09(1H,m,H-2b),2.50(1H,m,H-5),3.83(1H,t,J = 9.5 Hz,H-6),1.78 (1H,dd,J = 10.4,9.5 Hz,H-7),2.03(2H,m,H-8),2.50(1H,m,H-9a),1.78(1H,m,H-9b),2.27(1H,m,H-11),1.13(3H,d,J=7.0 Hz,H-13),5.22(1H,m,H-14a),5.21(1H,m,H-14b),4.87(1H,m,H-15a),4.71(1H,m,H-15b).13CNMR(150 MHz,acetone-d6)δC:44.3(C-1),40.7(C-2),74.5(C-3),156.7(C-4),50.5(C-5),85.8(C-6),50.6(C-7),33.2(C-8),39.0(C-9),151.3(C-10),42.2(C-11),178.5(C-12),13.5(C-13),111.0(C-14),112.0(C-15). 以上波谱数据与文献报道基本一致[16],故鉴定化合物1 为(1S,3S,5S,6S,7S,11S)-3- hydroxyl-11,13-dihydrodehydrocostuslactone。
2.3.2 化合物2 无色针晶,C15H20O3,1H-NMR(600 MHz,acetone-d6)δH:2.81(1H,m,H-1),1.92(2H,m,H-2),4.60(1H,m,H-3),2.81(1H,m,H-5),3.96(1H,m,H-6),2.11(1H,m,H-7),1.36(1H,dd,J =12.6,4.6 Hz,H-8a),1.79 (1H,m,H-8b),2.00(1H,dd,J=12.6,4.6 Hz,H-9a),1.92(1H,m,H-9b),2.63(1H,m,H-11),1.10(3H,d,J = 7.8 Hz,H-13),5.24(1H,m,H-14a),5.22(1H,m,H-14b),4.87(1H,s,H-15a),4.73(1H,s,H-15b).13C-NMR(150 MHz,acetone-d6)δC:44.2(C-1),39.8(C-2),74.4(C-3),156.7(C-4),45.4(C-5),85.8(C-6),51.0(C-7),29.6(C-8),38.8(C-9),151.3(C-10),41.0(C-11),179.7(C-12),11.6(C-13),111.1(C-14),111.9(C-15). 以上波谱数据与文献报道基本一致[16],故鉴定化合物2 为(1S,3S,5S,6S,7S,11R)- 3-hydroxyl-11,13-dihydrodehydrocostuslactone.
2.4 化合物1 和2 对结肠癌SW620 细胞的细胞毒性结果显示,化合物1 和2 对结肠癌SW620 细胞表现出温和的细胞毒性(表1)。

表1 转化产物1 和2 对结肠癌细胞SW620 的细胞毒性
2.5 化合物和结肠癌SW620 细胞靶点预测与分子对接结果 使用GeneCards 数据库和OMIM 数据库获取到结肠癌SW620 细胞相关靶点共960 个;使用Swiss Target Prediction 数据库预测到化合物1 的靶点有100 个,化合物2 的靶点有57 个;化合物与疾病靶点交集图如下图4。分子对接结果如下表2、3,一般来说结合能小于-7 kcal/mol 代表结合作用强烈。取各自结合能最好的对接组进行对接情况可视化,如下图5、6。化合物1 与结肠癌细胞SW620 的交集靶点有26 个,化合物2 与结肠癌细胞SW620 的交集靶点有16 个。其中化合物1 与靶点蛋白VDR 中的LEU-230、LEU-233 和VAL-234 等多个氨基酸残基形成多条疏水作用键,化合物2 与靶点蛋白CDK1 中的ILE-10、VAL-18 和ALA-31 等多个氨基酸残基形成多条疏水作用键,且两组结合能分别为-9.7 kcal/mol 和-8.5 kcal/mol,结合能优异且结合作用强烈。推断化合物1 和化合物2 具有抑制结肠癌细胞SW620的作用。
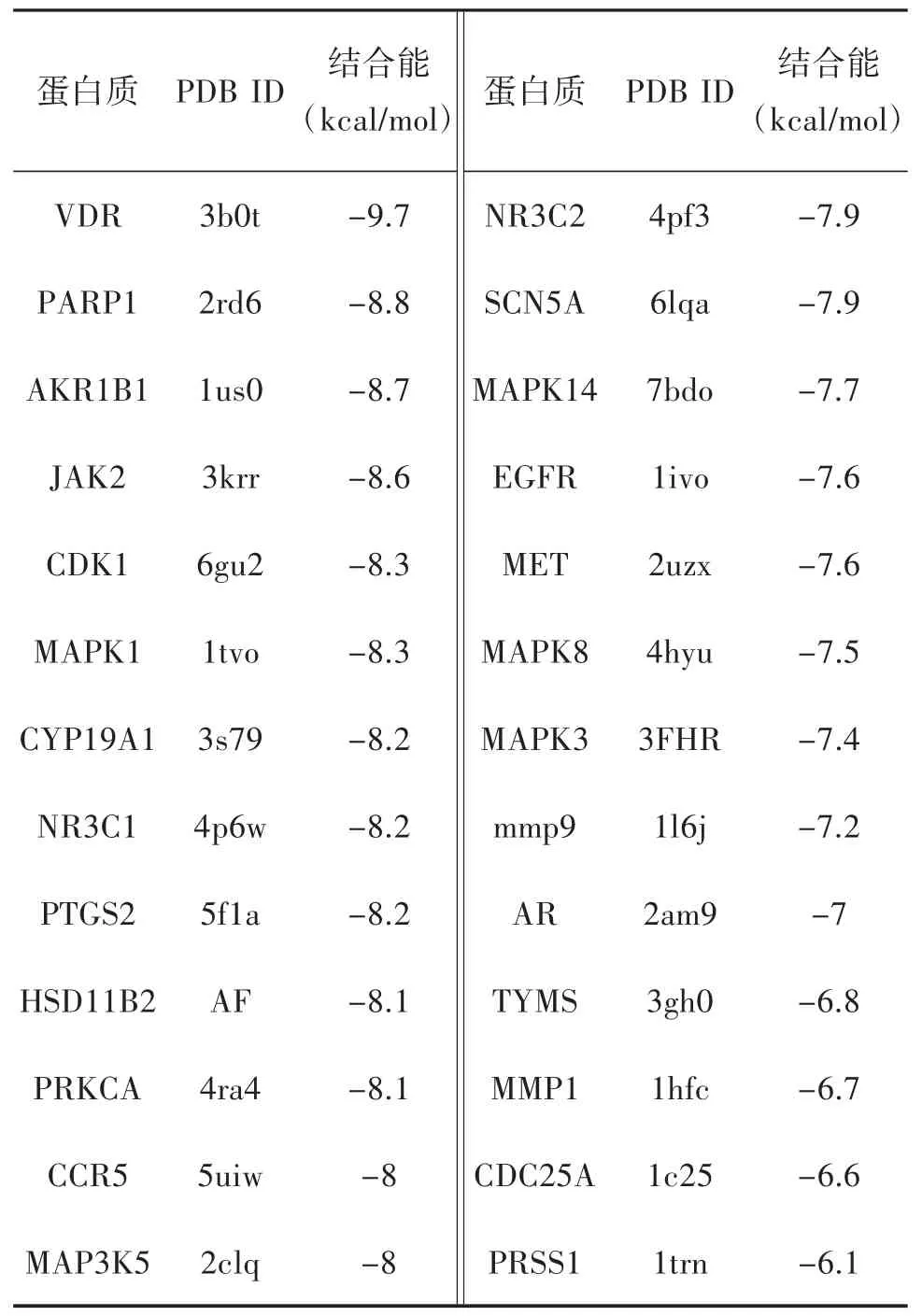
表2 化合物1 与交集靶点结合能数据
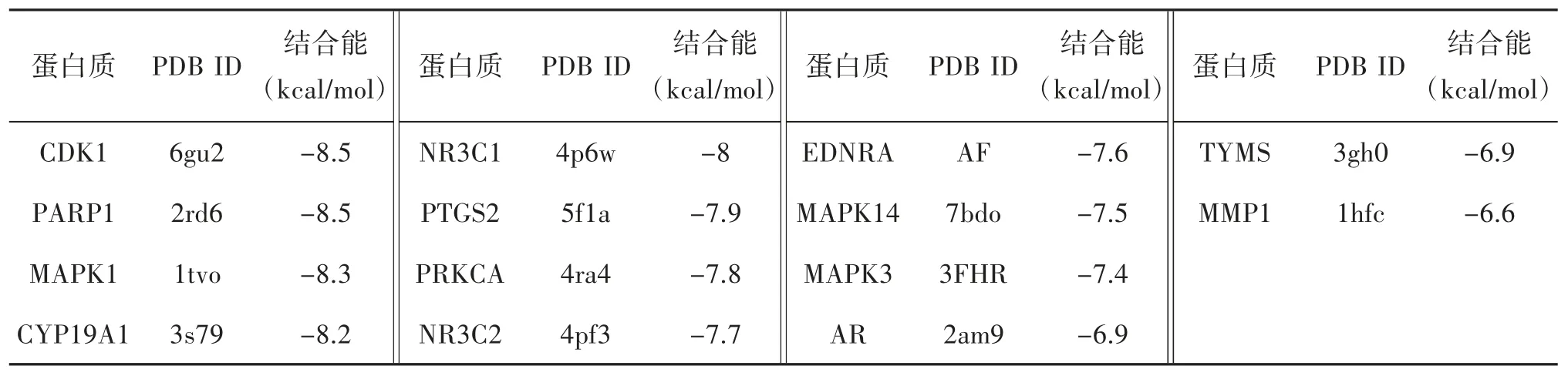
表3 化合物2 与交集靶点结合能数据
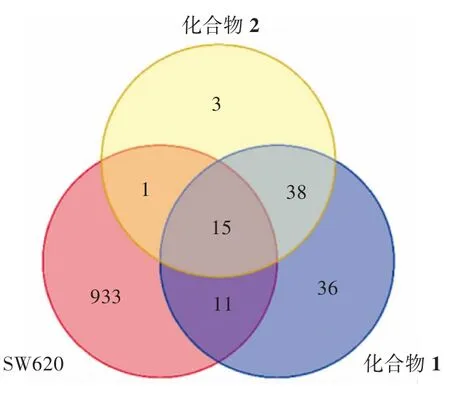
图4 化合物1、化合物2 靶点与疾病靶点交集图
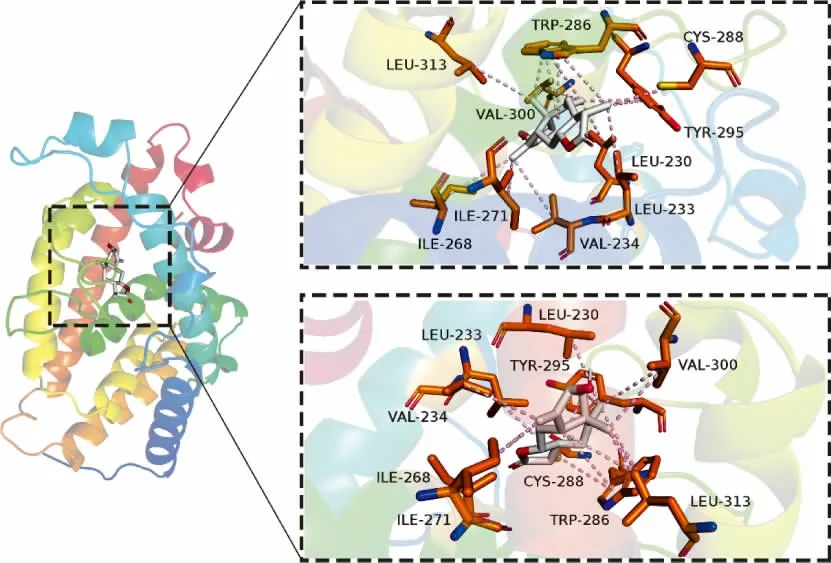
图5 化合物1 与结肠癌SW620 细胞的蛋白结合图
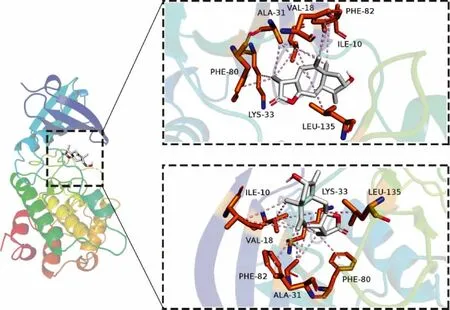
图6 化合物2 与结肠癌SW620 细胞的蛋白结合图
3 讨论
前期研究了木香烃内酯与去氢木香烃内酯在Y0液体菌液中的生物转化,第1、3、5、7 天分别对菌液检测,在第3 天检测有转化产物生成,但由于木香烃内酯的生物转化产率低,未能分离得到转化产物,后期将会继续优化生物转化条件,以期分离得到转化产物。去氢木香内酯在Y0 菌液中转化得到2 个产物,产物1 转化产率为10%,产物2 转化产率为1.4%。作为分子转化的工具,微生物能够利用酶对传统化学合成中的惰性位点进行结构修饰,具有空间选择性和立体选择性的特点,能够实现化学合成难以实现的反应,解决化学合成过程繁琐、污染、成本过高等问题。羟化酶、还原酶及异构酶是微生物中常见酶[18],本实验中通过微生物转化获得到的2 个产物1 和2 均是去氢木香内酯C-3 位发生羟基化,C-11 发生还原所得,这表明发生在C-11 的还原反应可能没有立体选择的特异性,因此获得了S、R 两种构型的产物。
转化产物1 和2 对结肠癌细胞SW620 具有一定的细胞毒性,通过网络药理学对化合物1、2 靶点预测,并从GeneCards 数据库和OMIM 数据库获取结肠癌SW620 细胞相关靶点。化合物1 与结肠癌细胞SW620 的交集靶点有26 个,化合物1 与靶点蛋白维生素D 受体(vitam in D receptor,VDR)结合能为-9.7 kcal/mol,且 与VDR 中 的LEU-230、LEU-233 和VAL-234 等多个氨基酸残基形成多条疏水作用键,结合作用强烈。VDR 是一种核转录因子通过与配体特异结合调控多种基因的表达,从而调节多种生命活动的进行,在人体各组织细胞中广泛存在,在结肠、肾上腺皮质、肺等部位的细胞及淋巴细胞中表达量较高[19-20]。Cross 等[21]研究证实,1,25-二羟基维生素D3能有效降低直肠癌、乳腺癌、卵巢癌等多种癌症的死亡率。近年来大量研究表明:1,25-二羟基维生素D3主要通过依赖VDR 途径调节肿瘤细胞的增殖分化,诱导肿瘤细胞凋亡等,从而抑制肿瘤细胞生长。网络药理与分子对接结果显示化合物1 与VDR 有很好的结合,因此化合物1 有可能通过抑制VDR 发挥潜在治疗结肠癌的作用。化合物2 与结肠癌细胞SW620 的交集靶点有16 个,其中与靶点蛋白CDK1 中的ILE-10、VAL-18 和ALA-31 等多个氨基酸残基形成多条疏水作用键,结合能为-8.5 kcal/mol,结合作用强烈。细胞周期蛋白依赖性激酶1(cyclin-dependent protein kinase 1,CDK1)是一种高度保守的丝氨酸/苏氨酸激酶,作为控制细胞周期的起始、进展和终止的主要角色,于细胞周期多个环节中均可作为抗癌天然靶标。由于CDK1 在有丝分裂过程的调控中具有重要作用,已有较多的关于降低CDK1 活性的物质被开发为抗癌药物。其中,一些药物可以通过抑制CDK1 的活性阻滞G2/M 期以达到治疗结直肠癌的目的。例如斑蝥素就是通过抑制CDK1 活性导致结直肠癌colo 205 细胞中的G2/M 期阻滞和细胞凋亡的[22]。但化合物1、2 抗结肠癌的活性与可能的作用机制有待进一步的体内外实验来探讨。

