活血荣络方含药血清对氧糖剥夺/复氧糖损伤PC12细胞线粒体自噬的影响及机制研究
颜思阳 ,杨仁义 ,陈瑶 ,刘利娟 ,高晓峰 ,周德生
1.湖南中医药大学第一附属医院,湖南 长沙 410007;
2.湖南中医药大学,湖南 长沙 410208
缺血性脑卒中是世界范围内致死和致残的主要原因,是中国第一大死亡因素[1-3]。目前治疗缺血性脑卒中主要在早期疏通血管,恢复灌注,但可能造成不可逆的神经功能损伤,即脑缺血再灌注损伤(CIRI)。线粒体自噬可选择性识别和清除功能紊乱的线粒体。在这一过程中,线粒体被PTEN 诱导假定激酶1(PINK1)、Parkin、Bcl-2、Bcl-2/腺病毒E1B相互作用蛋白3(BNIP3)等相关因子识别,进行选择性自噬[4]。通过自噬进行线粒体质量控制成为干预CIRI可能的靶点,但线粒体自噬在CIRI中的作用一直存在争议,受损线粒体清除不足或必要线粒体降解过度都将导致细胞死亡[5]。
课题组前期从荣气虚滞角度探讨了荣气部分功能与线粒体功能的相关性[6],并对基于荣气虚滞理论立方的活血荣络方进行了体内实验研究,结果表明,其可通过激活PINK1/Parkin信号通路上调线粒体自噬,减轻大鼠神经功能损害[7]。本研究建立氧糖剥夺/复氧糖(OGD/R)损伤的PC12细胞模型,以PINK1/Parkin通路为切入点,从线粒体自噬角度探讨活血荣络方改善CIRI神经元损伤的机制。
1 实验材料
1.1 动物及细胞
12~15 周龄SPF 级SD 雄性大鼠20 只,体质量250~280 g,购自湖南斯莱克景达实验动物有限公司,动物生产许可证号SCXK(湘)2016-0002。饲养于湖南中医药大学第一附属医院实验动物中心,使用许可证号SYXK(湘)2015-0003,依照实验动物中心管理办法,饲养温度21~26 ℃,湿度40%~50%,通风良好,自然昼夜交替,标准饲料分笼饲养,自由饮水。适应性饲养7 d后用于实验。本研究经湖南中医药大学第一附属医院伦理委员会批准(20201010-13)。PC12细胞株(货号TCR9),购自中国科学院上海细胞库。
1.2 药物及制备
活血荣络方(鸡血藤30 g,石楠藤30 g,生地黄15 g,玄参10 g,黄精15 g,乳香10 g,没药10 g,川芎10 g),饮片购自湖南中医药大学第一附属医院中药房,经湖南中医药大学第一附属医院张裕民主任药师鉴定。活血荣络方浸膏参照课题组前期研究方法制备[8]。雷帕霉素(货号S1039,美国Selleck公司)。
1.3 主要试剂及仪器
胎牛血清(货号10270-106)、100×青霉素-链霉素混合液(货号15140122),美国Gibco公司;DMEM高糖培养基(货号SH30022.01),美国Hyclone 公司;DMEM无糖培养基(货号PM150270),武汉Procell公司;JC-1 线粒体膜电位(MMP)检测试剂盒(货号C2006)、Mito-Tracker Red CMXRos(货号C1035-50),上海碧云天生物;BCA 蛋白定量试剂盒(货号70-PQ0012),杭州联科生物;微管蛋白1 轻链3B 一抗(LC3B,货号ab48394)、p62 一抗(货号ab91526)、线粒体外膜转位酶20 一抗(TOMM20,货号ab186735)、PINK1一抗(货号ab23707)、Parkin一抗(货号ab77924)、HRP 标记山羊抗兔IgG(货号ab6721)、HRP 标记山羊抗小鼠IgG(货号ab6789),英国Abcam 公司;β-actin 抗体(货号20536-1-AP)、FITC标记山羊抗兔IgG(货号SA00003-2),武汉三鹰生物;Alexa Fluor 647 标记山羊抗小鼠IgG(货号A0473),上海碧云天生物。3427普通培养箱、3131三气培养箱、900Series超低温冰箱、Fresco17低温高速离心机,美国Thermo Scientific公司;SYG-1210恒温水浴锅,美国Crystal仪器公司;SW-CJ-1F超净工作台,苏州安泰空气技术有限公司;Delta Vision高分辨活细胞成像系统,英国Cytiva公司;Milli-Q IQ-7000超纯水仪,美国Meck Millipore;1658001小型垂直电泳槽、1703930小型转印槽、1645050基础电泳仪,美国Bio-Rad公司;Chemi DocTMXRS+化学发光凝胶成像分析仪,美国Bio-Rad公司。
2 实验方法
2.1 含药血清制备
20只大鼠按随机数字表法分为正常对照组和给药组,给药组予活血荣络方浸膏稀释液(浓度2.34 g/mL)23.4 g/kg灌胃,正常对照组予等体积蒸馏水灌胃,连续7 d。末次灌胃1 h后以10%水合氯醛3 mL/kg麻醉大鼠,暴露腹主动脉,使用负压采血管采集全血5 mL至无抗凝剂的普通采血管中,静置1 h,3 000 r/min离心10 min,收集上清液,56 ℃水浴灭活30 min,0.22 μm滤膜过滤除菌,即为活血荣络方含药血清和空白血清,于-80 ℃冰箱保存备用。
2.2 细胞培养、分组及处理
复苏PC12细胞,用含5%胎牛血清的DMEM 高糖培养基(完全培养基)于37 ℃、5%CO2培养箱中培养,1~2 d更换培养基1次,取对数生长期细胞用于实验。将细胞分为正常对照组、模型组、空白血清组(KBXQ 组)、活血荣络方含药血清组(H-HYXQ组)和雷帕霉素组(RAP组)。正常对照组常规培养,其余各组细胞贴壁24 h后,将培养基更换为DMEM无糖培养基,并将细胞转移至37 ℃、5%CO2、95%N2、1%O2培养箱中培养2 h,随后更换为相应培养基于常规培养箱中培养24 h,建立OGD/R损伤细胞模型[9]。其中模型组更换为完全培养基,KBXQ组为10%空白血清完全培养基,H-HYXQ组为10%活血荣络方含药血清完全培养基[10-11],RAP组为含200 nmol/L雷帕霉素的完全培养基[9]。
2.3 JC-1荧光探针检测线粒体膜电位
细胞按以上方法处理后,吸弃培养液,PBS洗涤细胞1次,每孔分别加入完全培养基1 mL和JC-1染色液1 mL,充分混匀,置于常规养箱孵育20 min,吸去上清液,JC-1染色缓冲液洗涤2次,加入完全培养基2 mL,荧光显微镜下观察。当MMP较高时,JC-1在线粒体基质中形成聚合物,呈红色荧光;当MMP下降时,JC-1转变为单体,呈绿色荧光。以红色荧光/绿色荧光比值表示MMP。
2.4 免疫荧光染色分析线粒体-LC3B共定位
OGD/R诱导及药物处理同“2.2”项下,预定时间点前15~30 min,去除细胞培养基,加入Mito-Tracker Red CMXRos工作液染线粒体,常规培养箱培养至24 h,去除Mito-Tracker Red CMXRos工作液,加入37 ℃温育的完全培养基洗涤细胞,进行固定、破膜、封闭、一抗孵育(LC3B 1∶100)、二抗孵育(FITC 1∶100)、染核、封片等步骤,使用Delta Vision高分辨活细胞成像系统拍照,使用Image J软件Colocalization Finder插件对各组细胞线粒体-LC3B 共定位进行分析,通过ScatterPlot散点图、Pearson相关系数(Rr)、Maders重叠系数(R)对线粒体-LC3B共定位关系进行描述[12],定量数据解释见表1[13]。
2.5 免疫荧光染色分析线粒体-PINK1-Parkin共定位
OGD/R 诱导及药物处理同“2.2”项下,加入Mito-Tracker Red CMXRos 工作液染线粒体,进行固定、破膜、封闭、一抗孵育(PINK1 1∶100、Parkin 1∶200)、二抗孵育(FITC 1∶100)、染核、封片等操作,使用Delta Vision高分辨活细胞成像系统拍照,分别对线粒体-PINK1、线粒体-Parkin、PINK1-Parkin进行共定位分析,共定位分析方法及描述同“2.4”项下,进一步绘制Rr、R相关系数图,以颜色深浅表示相关性强弱(颜色越深表示相关性越强)。
2.6 Western blot检测
OGD/R诱导及药物处理同“2.2”项下,裂解并提取蛋白,12 000 r/min 离心10 min,取上清液,采用BCA蛋白定量法测定蛋白浓度,配制成2 μg/μL蛋白溶液,金属浴100 ℃加热10 min使蛋白变性。SDS-PAGE分离,湿转法转膜,5%脱脂奶粉室温封闭1 h,加LC3B 一 抗(1∶1 000)、p62 一 抗(1∶2 000)、TOMM20一抗(1∶2 000)、PINK1一抗(1∶1 000)、Parkin 一抗(1∶1 000)、β-actin 一抗(1∶4 000),4 ℃孵育过夜;TBST洗涤后加对应二抗(山羊抗兔IgG 1∶8 000、山羊抗小鼠IgG 1∶8 000)孵育,TBST洗涤后化学发光法显影。使用Image J软件检测图像灰度值并进行分析,以目的蛋白与β-actin灰度值比值表示蛋白相对表达量。
3 统计学方法
采用SPSS25.0 统计软件进行分析。计量资料以±s表示,多组间比较用方差分析,组间两两比较方差齐用LSD检验,方差不齐用Kruskal-WallisH检验。P<0.05表示差异有统计学意义。
4 结果
4.1 含药血清对PC12细胞线粒体膜电位的影响
与正常对照组比较,模型组PC12细胞MMP明显降低(P<0.01);与模型组比较,KBXQ组、H-HYXQ组和RAP组PC12细胞MMP明显升高(P<0.01);与KBXQ组比较,H-HYXQ组PC12细胞MMP明显升高(P<0.05);与H-HYXQ 组比较,RAP 组PC12 细胞MMP明显升高(P<0.05)。见表2。
表2 各组PC12细胞MMP比较(±s,%)
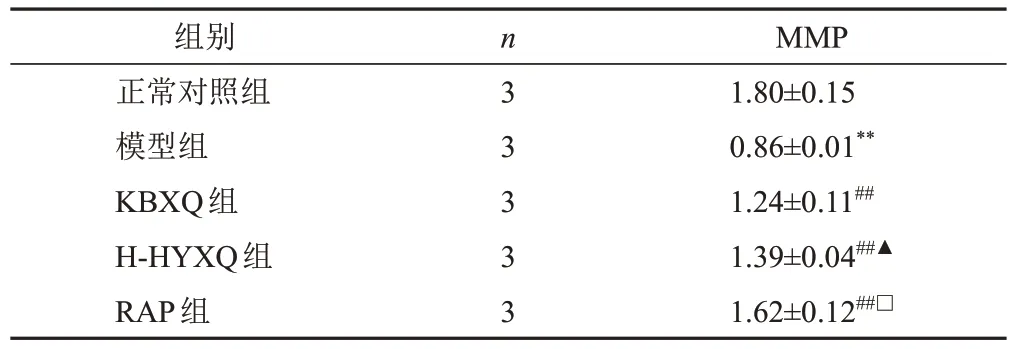
表2 各组PC12细胞MMP比较(±s,%)
注:与正常对照组比较,**P<0.01;与模型组比较,##P<0.01;与KBXQ组比较,▲P<0.05;与H-HYXQ组比较,□P<0.05
MMP 1.80±0.15 0.86±0.01**1.24±0.11##1.39±0.04##▲1.62±0.12##□组别正常对照组模型组KBXQ组H-HYXQ组RAP组n 3 3 3 3 3
4.2 含药血清对PC12细胞线粒体-LC3B共定位的影响
荧光显微镜下可见红色荧光标记的线粒体(Mito)和绿色荧光标记的LC3B,结合Rr、R结果分析表明,正常对照组、模型组和KBXQ组PC12细胞Mito-LC3B共定位关系Rr 为强,R 为弱或中等;H-HYXQ 组和RAP组PC12细胞Mito-LC3B共定位关系Rr为非常强,R为强或中等,提示H-HYXQ、RAP能增强Mito-LC3B共定位,激活线粒体自噬。见图1、表3。
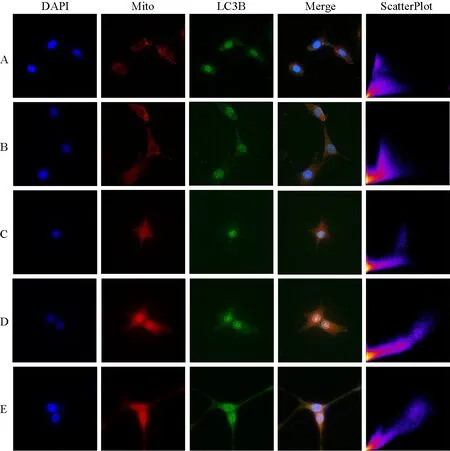
图1 各组PC12细胞Mito-LC3B共定位分析(免疫荧光染色,×600)

表3 各组PC12细胞Mito-LC3B共定位Rr、R比较
4.3 含药血清对PC12 细胞线粒体-PINK1-Parkin 共定位的影响
PINK1/Parkin通路介导线粒体自噬,需要线粒体亚定位,故在标记Mito的基础上进行PINK1、Parkin蛋白荧光染色。各组细胞Mito、PINK1、Parkin荧光染色及共定位分析见图2,Mito、PINK1、Parkin的相关性分析见图3。

图2 各组PC12细胞Mito-PINK1-Parkin共定位分析(免疫荧光染色,×600)
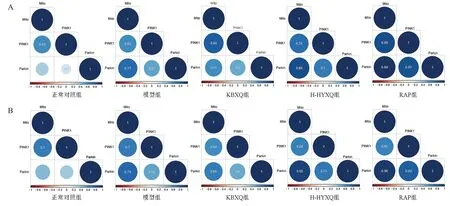
图3 各组PC12细胞Mito、PINK1、Parkin相关性分析
各组细胞Mito-PINK1 Rr、R 均显示存在共定位(0.62≤Rr≤0.89,0.64≤R≤0.7)。正常对照组细胞Mito-Parkin无共定位(Rr<0.5,R<0.6),模型组细胞Mito-Parkin 存在共定位,但相关性较低(Rr=0.77,R=0.79);与模型组比较,KBXQ组细胞Mito-Parkin共定位降低(Rr=0.61,R=0.69),H-HYXQ组和RAP组细胞Mito-Parkin共定位增强。正常对照组细胞PINK1-Parkin蛋白无明显共定位(Rr=0.2,R=0.36),模型组细胞PINK1-Parkin 共定位增强(Rr=0.53,R=0.52),H-HYXQ组和RAP组细胞共定位进一步增强(Rr≥0.7,R≥0.82)。
4.4 含药血清对PC12 细胞自噬相关蛋白及PINK1/Parkin通路蛋白表达的影响
与正常对照组比较,模型组细胞LC3B蛋白表达升高,p62、TOMM20蛋白表达降低,差异均有统计学意义(P<0.05);与模型组比较,H-HYXQ组和RAP组细胞LC3B蛋白表达升高(P<0.01),p62、TOMM20蛋白表达明显降低(P<0.05,P<0.01);与KBXQ组比较,H-HYXQ组和RAP组细胞LC3B蛋白表达明显升高(P<0.05),p62、TOMM20蛋白表达明显降低(P<0.05)。见图4、图5。
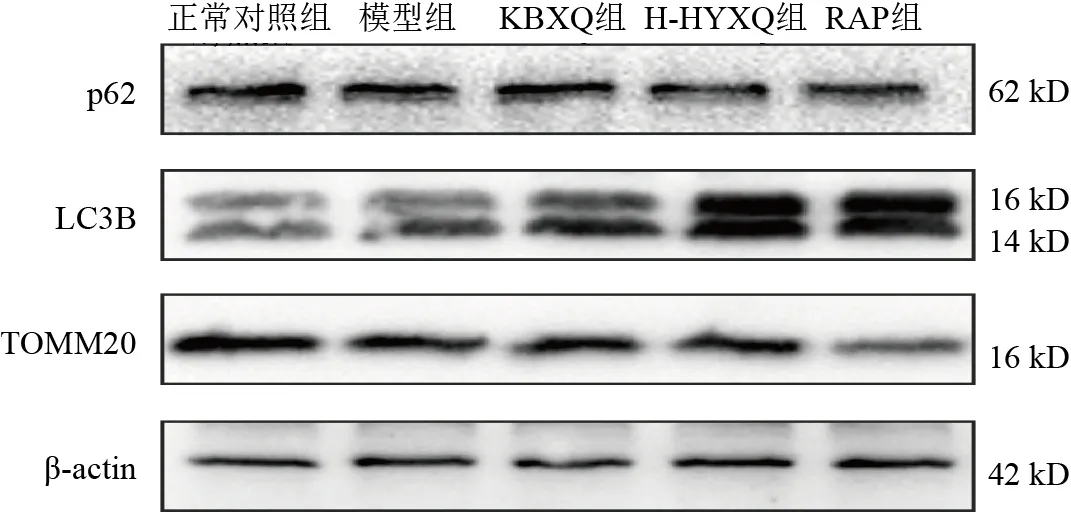
图4 各组PC12细胞LC3B、p62、TOMM20蛋白免疫印迹

图5 各组PC12细胞p62、LC3B、TOMM20蛋白表达比较(±s,n=3)
与正常对照组比较,模型组细胞PINK1、Parkin蛋白表达明显升高(P<0.05,P<0.01);与模型组比较,H-HYXQ组和RAP组细胞PINK1、Parkin蛋白表达明显升高(P<0.05);与KBXQ组比较,H-HYXQ组和RAP组细胞PINK1、Parkin蛋白表达明显升高(P<0.05)。见图6、图7。

图6 各组PC12细胞PINK1、Parkin蛋白免疫印迹

图7 各组PC12细胞PINK1、Parkin蛋白表达比较(±s,n=3)
5 讨论
脑缺血再灌注是极为复杂的病理生理过程,呈快速级联反应,包括神经细胞内钙离子超载、脂质过氧化、氧自由基损伤、细胞毒性作用、炎症因子损害等[14-16]。研究表明,脑缺血再灌注中线粒体损伤及功能紊乱是造成神经细胞死亡的重要原因[17]。线粒体自噬作为一种清除受损线粒体的途径,在脑缺血再灌注中起重要作用,但目前尚有争议[17]。自噬可以在缺血期起保护作用,一旦发生缺血/再灌注就会产生不同的作用[18-19]。脑卒中后重度高血糖可通过抑制线粒体自噬激活,阻碍急性缺血早期内源性受损线粒体的清除,导致受损线粒体堆积,进而扩大线粒体介导的下游凋亡损伤,加重大鼠脑梗死损伤程度[20]。但也有研究发现,脑缺血再灌注后BNIP3表达升高造成线粒体自噬过度激活,引起迟发性细胞死亡,加重CIRI[21]。虽然线粒体自噬在CIRI中所起的作用一直存在争议,但能够确定,受损线粒体的过度清除和清除不足均导致细胞死亡[22]。
PINK1/Parkin 通路调控的线粒体自噬最为典型。其中,PINK1在脑内高表达,能作为受损线粒体的分子感受器,Parkin主要介导底物泛素化,调节蛋白降解和信号转导等。PINK1和Parkin广泛表达于组织器官,尤以脑、心肌、骨骼肌等高耗能器官含量丰富,可作为线粒体受损时的第一道防线。有研究表明,PINK1和Parkin参与CIRI病理过程,PINK1以稳定的形式存在于正常细胞的线粒体外膜上,当MMP 下降时,PARK2/Parkin被招募至线粒体并被PINK1磷酸化[23],线粒体外膜蛋白在Parkin的作用下被泛素化,受体蛋白p62 识别并标记到被泛素化的线粒体外膜蛋白上,LC3B通过识别p62蛋白,结合定位于去极化的线粒体上,进一步诱导功能失调的线粒体通过自噬降解[24-25]。体内实验表明,脑缺血再灌注后出现LC3B、Beclin1和LAMP-1表达上调及线粒体自噬激活,并在24 h后达到峰值,且再灌注24 h后线粒体外膜PINK1积累显著增加,Parkin/p62 线粒体易位增加,表明PINK1/Parkin/p62信号通路参与缺血和再灌注后的病理生理过程[26]。课题组前期研究表明,基于荣气虚滞理论立方的活血荣络方能通过调控PINK/Parkin信号通路,减轻CIRI模型大鼠神经功能缺损[7]。本研究以雷帕霉素为阳性对照,检测MMP,结果表明OGD/R诱导的PC12损伤可使MMP下降,而活血荣络方含药血清及雷帕霉素可上调MMP以减轻细胞损伤。同时通过免疫荧光染色、Western blot检测表明,活血荣络方含药血清可促进Mito-LC3B 共定位,上调LC3B,下调p62、TOMM20蛋白表达,同时增强Mito-PINK1-Parkin共定位,激活PINK1/Parkin通路,发挥调节OGD/R损伤相关的线粒体自噬的作用。
综上,活血荣络方可能通过调控PINK1/Parkin通路增加Parkin蛋白的线粒体转位,上调LC3B,下调p62、TOMM20 蛋白表达,激活线粒体自噬,减轻OGD/R诱导的PC12细胞损伤。本研究可为阐明活血荣络方干预CIRI的机制提供实验依据。

