微波法原位制备缓释型葛根粉末饮片及其体外葛根素溶出行为评价
庄绪镇 ,郑玉玉 ,伍寒玉 ,陈亚楠 ,尹登科 ,杨晔 ,
1.安徽中医药大学药学院,安徽 合肥 230012; 2.药物制剂技术与应用安徽省重点实验室,安徽 合肥 230012;3.安徽省教育厅现代药物制剂工程技术研究中心,安徽 合肥 230012
葛根为豆科植物野葛Pueraria lobata(Willd.)Ohwi的干燥根,性凉,味辛、甘,归脾、胃经,具有解肌退热、生津止渴、升阳止泻功效[1]。葛根具有悠久的药用史和食用史,广泛应用于医疗、保健等领域。葛根含有葛根素、大豆苷和大豆苷元等多种活性成分[2-3]。葛根素是葛根的主要活性成分,具有降血糖、降血脂、抗炎和抗氧化等药理活性[4]。葛根通过物理粉碎后可进一步加工为葛根粉[5],既可内服也可外用。多项研究表明,葛根素的起效机制与肠道菌群有关,特别在治疗糖尿病、肥胖症、炎症性肠病及抑郁症等方面[6-10]。目前大量实验研究主要是以增加葛根粉中葛根素成分在水中或人工胃液中的溶出量,提高其体内生物利用度为目的[11-14],可能导致葛根素难以直接到达结肠部位,不利于其在结肠被肠道菌群利用而发挥药理作用。淀粉是葛根粉的主要成分,含量约为35%~60%[15],其作为一种天然的高分子聚合物,由直链淀粉和支链淀粉组成,因无毒、来源广泛、可生物降解性及易改性等特点而被人们高度关注[16]。淀粉经改性后,其溶解性、透明度、冻融稳定性及酶解性等天然特性发生改变,可进一步扩大其应用范围[17]。例如,采用物理加热、化学交联、酶解等方法制备的改性淀粉,可作为靶向制剂的新型释药载体,特别是结肠靶向制剂[18-19]。微波可以破坏淀粉的晶体结构,加速结晶区重排,并影响淀粉的吸水能力、黏度、膨胀力、相对结晶度和消化率等[20]。因此,本研究采用微波法对葛根粉末饮片中的淀粉成分进行改性处理,通过影响淀粉的颗粒结构和理化性质,改变葛根素成分的溶出行为,减少其在上消化道的溶出量,开发一种具有结肠靶向性的葛根类保健制剂。
1 仪器与试药
D2F-6050型真空冷冻干燥箱(上海博迅实业有限公司),FA-1604型电子分析天平(上海舜宇恒平科学仪器有限公司),WBFY-201 微电脑微波化学反应器(上海牧佐科学仪器有限公司),Waters-2695型高效液相色谱仪(美国Waters公司),BT-9300H型激光粒度仪(广东百特仪器有限公司),SU-8100型扫描电子显微镜(日本Hitachi公司),XP-330C型偏光显微镜(上海蔡康光学仪器有限公司),SmartLab型X射线衍射仪(日本Gigaku公司),Nicolet-5700型傅里叶变换红外光谱仪(美国ThermoFisher公司)。
葛根药材由安徽康美药业有限公司提供,经安徽中医药大学药学院刘守金教授鉴定为豆科植物野葛Pueraria lobata(Willd.)Ohwi的干燥根。葛根素标准品(批号S157424,纯度≥98%,上海源叶生物有限公司)。总淀粉测定试剂盒(批号N20220107,北京索莱宝生物科技有限公司),直链淀粉测定试剂盒(批号N20220628,北京索莱宝生物科技有限公司),支链淀粉测定试剂盒(批号N20220509,北京索莱宝生物科技有限公司),葡萄糖测定试剂盒(批号A2206027,南京建成生物科技有限公司),胃蛋白酶(批号S2111290,酶活性≥6 000 U/g,上海源叶生物有限公司),胰酶(批号S2112310,胰蛋白酶活性≥4 000 U/g、胰淀粉酶活性≥7 000 U/g、胰脂肪酶活性≥4 000 U/g,上海源叶生物有限公司),甲醇(色谱纯,批号T2109515,南京建成生物科技有限公司),其他试剂均为分析纯。
2 方法与结果
2.1 缓释型葛根粉末饮片制备
称取适量葛根粉末(过70目筛且不过200目筛),按葛根粉末与水分别为7∶3、4∶6、2∶8比例加入超纯水,平衡水分10 min,搅拌均匀后用保鲜膜封口避免水分流失,置于微波反应器中进行微波辐照,微波功率210 W,处理时间5 min。为避免微波加热不均匀,采用间歇加热法(先加热1 min,停止加热,取出并搅拌10 s,再加热1 min,反复操作,直至结束)。所得样品经冷冻干燥后,碾磨,过100目筛,获得成品后备用,分别记为M-PL70、M-PL40和M-PL20。以未经处理的葛根粉为对照,记为PL。
2.2 葛根素成分体外溶出行为考察
2.2.1 对照品溶液制备
精密称取葛根素对照品适量,加30%甲醇配制成80 μg/mL对照品溶液,摇匀,备用。
2.2.2 供试品溶液制备
精密称定PL 和M-PL70/40/20样品粉末各0.1 g,置50 mL锥形瓶中,精密加入30%甲醇25 mL,称定质量,超声(功率240 W,频率45 kHz)处理10 min,放至室温,30%甲醇补足减失的质量,摇匀,过0.22 μm微孔滤膜,取续滤液,备用。
2.2.3 色谱条件
采用ZORBAX SB-C18色谱柱(250 mm×4.6 mm,5 μm),流动相为甲醇-水(30∶70),检测波长250 nm,流速1.0 mL/min,进样量10 μL,柱温30 ℃,理论塔板数按葛根素色谱峰计算不低于4 000。色谱图见图1。
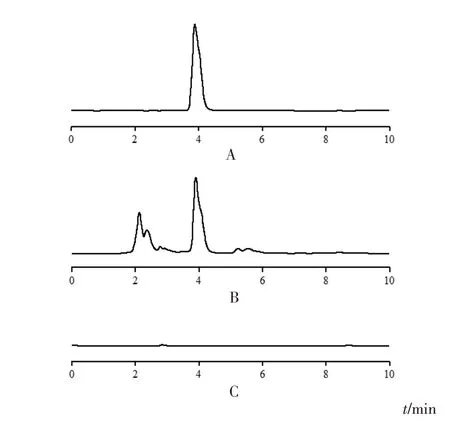
图1 葛根粉中葛根素HPLC图
2.2.4 线性关系考察
精密称取葛根素对照品适量,加30%甲醇制成葛根素浓度分别为3.125、6.25、12.5、25、50、100、200、400 μg/mL的对照品溶液,按“2.2.3”项下色谱条件进样分析,以对照品浓度为横坐标,峰面积积分值为纵坐标,进行线性回归,得回归方程Y=74.308X+219.74,R2=0.999 7,表明葛根素线性范围为3.125~400 μg/mL。
2.2.5 重复性试验
按“2.2.2”项下方法,取同一样品平行制备6份供试品溶液,每次进样10 μL,按“2.2.3”项下色谱条件进样分析,计算葛根素峰面积RSD=1.82%,表明此方法重复性良好。
2.2.6 稳定性试验
取同一供试品溶液,分别于制备后0、2、4、8、12、24 h进样分析,计算葛根素峰面积RSD=2.11%,表明供试品溶液在24 h内稳定性良好。
2.2.7 精密度试验
取一定浓度的对照品溶液,重复进样6次,每次进样10 μL,按“2.2.3”项下色谱条件进样分析,计算葛根素峰面积RSD=2.23%,表明仪器精密度良好。
2.2.8 加样回收率试验
精密称取6份0.1 g已知含量的同一样品,每份精密加入已知量的对照品溶液,按“2.2.2”项下方法制备,并按“2.2.3”项下色谱条件进样分析,计算其平均回收率在96.50%~101.63%范围内,均RSD<3%,表明此方法加样回收率良好。
2.2.9 样品含量测定
参照2020年版《中华人民共和国药典》(一部)葛根项下方法,精密称定葛根粉末(过3号筛)0.1 g,置具塞锥形瓶中,精密加入30%乙醇50 mL,称定质量,加热回流30 min,放冷,再称定质量,用30%乙醇补足减失的质量,摇匀,过滤,取续滤液,按“2.2.3”项下色谱条件测定。
2.2.10 体外溶出试验
参照2020年版《中华人民共和国药典》(四部)通则0931(溶出度与释放度测定法)小杯法,以模拟胃液、模拟小肠液模拟人体胃肠道环境,评价PL和M-PL70/40/20样品中葛根素成分的体外溶出行为。取稀盐酸16.4 mL,加水约800 mL与胃蛋白酶10 g混合,摇匀后,加水稀释至1 000 mL,即得模拟胃液(pH 1.5)。取磷酸二氢钾6.8 g,加水500 mL使溶解,用0.1 mol/L氢氧化钠溶液调节pH值至6.8。取胰酶10 g,加水适量使溶解,并将两液混合,加水稀释至1 000 mL,即得模拟小肠液(pH 6.8)。
精密称定PL和M-PL70/40/20样品各3 g,平行3份,置于溶出杯中,各溶出杯中加入150 mL已脱气处理的蒸馏水,转速75 r/min,温度(37±0.5)℃。分别于5、10、15、30、45、60、90 min时定位吸取1 mL,取续滤液后,立即过0.22 μm微孔滤膜,同时补加同温等量的蒸馏水,进样测定,计算葛根素累积溶出率。
取PL和M-PL70/40/20样品3 g,精密称定,平行3份,采用小杯法,150 mL模拟胃液,转速75 r/min,温度(37±0.5)℃,分别于5、10、15、30、45、60、120、180 min时定位吸取1 mL,取续滤液后立即过0.22 μm微孔滤膜,同时补加同温等量的模拟胃液。待全部取样结束后,立即分离模拟胃液中的样品(12 000 r/min离心10 min),取沉淀物,各样品再次放入溶出杯中,加入模拟小肠液150 mL,转速、温度同前,并分别于5、10、15、30、45、60、90、120、180、240 min 时定位吸取1 mL,取续滤液后立即过0.22 μm微孔滤膜,同时补加同温等量的模拟小肠液,进样测定,计算葛根素累积溶出率。
以水为溶出介质时,各样品在60 min时均达到溶出平衡,PL样品的累积溶出总量为(90.69±4.14)%,M-PL70/40/20样品的累积溶出总量分别为(79.12±3.66)%、(70.28±4.08)%、(61.03±3.51)%,与PL样品比较差异均有统计学意义(P<0.05)。以模拟胃液、模拟小肠液为连续溶出介质时,PL样品在模拟胃液中累积溶出总量为(91.21±2.33)%,M-PL70/40/20样品在模拟胃液中累积溶出总量分别为(78.23±3.41)%、(67.53±5.01)%、(60.92±4.19)%,与PL样品相比,分别减少(12.98±2.14)%、(23.68±2.46)%、(30.29±3.21)%;在模拟小肠液中,PL样品的溶出曲线呈平稳趋势,溶出量为(1.57±0.43)%,表明PL样品中葛根素成分在模拟胃液中大部分已溶出。M-PL70/40/20样品在模拟小肠液中呈缓慢溶出趋势,在孵育3 h后均达到溶出平衡,在模拟小肠液中的溶出量分别 为(6.46±1.69)% 、(11.09±2.33)% 、(13.23±2.49)%。其原因可能是:在微波处理过程中其内部淀粉颗粒在持续的热量及水分的参与下发生膨胀和破碎,经冷冻干燥后在药材粉末表面形成致密结构,该结构使水与模拟胃液难以进入葛根粉末内部,而导致葛根素成分不易在水、模拟胃液中溶出。但在模拟小肠液中,部分淀粉成分被胰淀粉酶分解,导致葛根素成分在模拟小肠液中部分溶出。但从整体上看,PL样品在模拟胃液和模拟小肠液中的累积溶出总量为(92.78±2.66)%,而M-PL70/40/20样品分别为(84.69±3.37)%、(78.62±2.33)%、(74.15±2.55)%,与PL样品比较差异均有统计学意义(P<0.05)。表明微波处理明显改变了葛根粉末饮片中葛根素成分的体外溶出行为,减少了其在模拟胃肠液中的溶出量。见图2、图3。
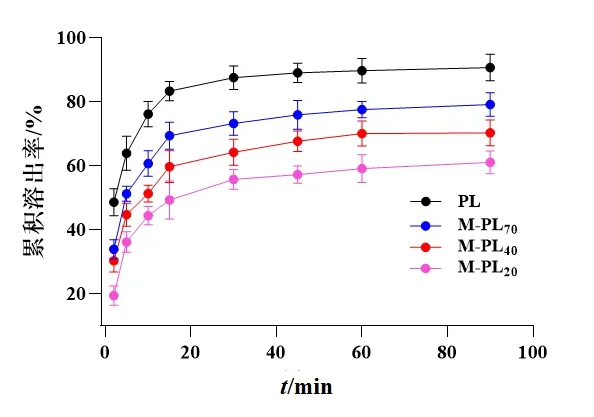
图2 PL和M-PL70/40/20样品在水中葛根素成分溶出曲线
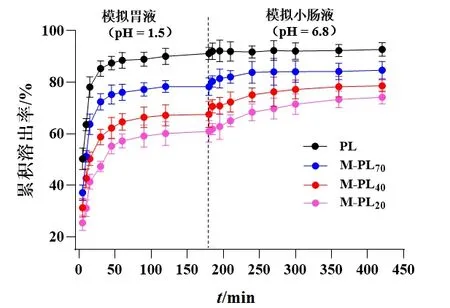
图3 PL和M-PL70/40/20样品在模拟胃肠液中葛根素成分溶出曲线
2.3 微波法对葛根粉末饮片理化性质的影响
2.3.1 形貌观察
取适量PL和M-PL70/40/20样品分别黏着于样品台上,置于离子溅射仪上镀一层导电金膜后,采用扫描电子显微镜进行观察,加速电压为5 kV。
PL样品组织中可见纤维束与薄壁组织成环带状间隔排列,内部充满大量的淀粉颗粒,颗粒多呈半球形和圆多角形,表面光滑。M-PL70/40/20样品的组织结构完整性遭到明显破坏,内部淀粉的颗粒结构发生不同程度改变,特别是M-PL40、M-PL20样品内部淀粉的颗粒形态完全消失,并在样品表面形成了致密层,表明微波处理显著改变了葛根粉末饮片的微观结构。见图4。

图4 PL与M-PL70/40/20样品扫描电镜图
2.3.2 粒径大小及分布
分别称取PL和M-PL70/40/20样品0.2 g,加入20 mL超纯水中,混匀,超声1 min,以激光粒径仪进行测定,每份样品平行3组,取平均值。
PL样品粒径分布为典型的单峰曲线,峰值出现在23.40 μm。M-PL70/40/20样品粒径分布曲线右移,表明大颗粒数目增加,且与水分质量分数密切相关。见图5。

图5 PL与M-PL70/40/20样品粒径分布
2.3.3 淀粉含量测定
PL样品淀粉含量为(51.16±1.76)%,M-PL70/40/20样品淀粉含量分别为(49.38±2.24)%、(50.42±1.49)%、(48.91±2.01)%,与PL样品比较差异均无统计学意义(P>0.05),表明微波处理对葛根粉末饮片中淀粉含量无影响。
2.4 微波法对葛根粉末饮片中淀粉体外消化率的影响

PL和M-PL70/40/20样品在模拟胃液中孵育3 h后并无还原糖生成,表明在胃酸环境中胃蛋白酶对其淀粉成分无影响。在模拟小肠液中淀粉消化速率随时间延长而迅速升高,PL、M-PL70/40/20样品中淀粉的总消化率分别 为(40.38±3.26)%、(46.07±2.31)%、(54.42±3.11)%、(58.65±2.94)%。淀粉消化是消化酶与淀粉分子链上的相关作用位点结合并断裂糖苷键生成葡萄糖的过程,胰淀粉酶作为一种α-淀粉酶,能水解淀粉的α-1,4-糖苷键[23]。在微波处理过程中,淀粉颗粒受热后吸水膨胀,大量水分进入淀粉颗粒内部,当温度持续升高时淀粉颗粒发生破碎或降解、内部晶体结构破坏及分子链断裂等变化,而水分含量是影响微波与淀粉相互作用的重要因素[24]。与PL样品相比,M-PL70/40/20样品在模拟小肠液中的消化率增加(P<0.05),且与微波处理时样品的含水量呈正相关,分析其原因主要是:在高水分含量参与下,微波进一步破坏了葛根粉末饮片中淀粉颗粒结构,从而暴露出更多的酶作用位点[25];由于含水量增加,微波使葛根粉末饮片中淀粉内部螺旋结构解体,导致分子链间的相互作用力减弱,淀粉颗粒的结晶结构更为松散,从而提高了淀粉酶在淀粉内的扩散速率[26];葛根粉末饮片中淀粉内部紧密排列的螺旋结构被破坏后,空间位阻减小,更易于淀粉酶与暴露出的酶作用位点结合。因此,M-PL70/40/20样品中淀粉成分在模拟小肠液中的消化率提高,且微波处理时样品含水量越大,其淀粉消化率越高。见图6。
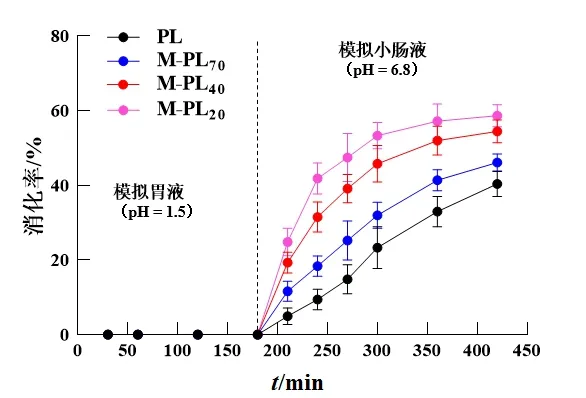
图6 PL与M-PL70/40/20样品中淀粉在模拟胃肠液中的消化曲线
2.5 微波法对葛根粉末饮片中淀粉理化性质的影响
2.5.1 淀粉提取
采用强碱法[27]对PL和M-PL70/40/20样品中淀粉进行提取。于室温将葛根粉末浸泡在0.05 mol/L氢氧化钠溶液中12 h,料液比为1∶8,弃上清液,加适量蒸馏水,过200目筛,收集混合溶液,加适量0.5 mol/L盐酸将酸碱度调节至中性(pH=7.0),3 000 r/min离心10 min,取沉淀物,用蒸馏水洗涤3次,3 000 r/min离心10 min,取沉淀物,用80%乙醇洗涤3次,脱去可溶性糖后,3 000 r/min离心10 min,取沉淀物,置于真空干燥箱内40 ℃干燥,即得。
2.5.2 颗粒形态观察
将“2.5.1”项下提取的淀粉样品制成质量分数1%的混悬液,立即滴加于载玻片上,分别置于偏光显微镜下观察,按“2.3.1”项下方法进行扫描电镜观察。
PL 淀粉颗粒主要呈半球形和圆多角形及少量不规则形状、大小不一,表面光滑。经微波处理后,M-PL70/40/20淀粉颗粒完整性遭到不同程度破坏,且样品含水量越高,破坏程度越大。与PL淀粉相比,M-PL70淀粉的颗粒表面受到损伤,部分颗粒破裂,M-PL40、M-PL20淀粉的颗粒结构完全消失,并形成较大的糊化淀粉团块,可能是在持续热量及高水分的参与下,葛根粉末饮片中的淀粉颗粒吸水膨胀后崩解,并与相邻淀粉颗粒或其他组织的破碎物发生融合导致[28]。由偏光显微镜图可见,PL淀粉的偏光十字清晰可见,随着体系中水分质量分数增加,M-PL70/40/20淀粉的偏光十字逐渐减弱或消失,但仍有偏光性存在,表明微波处理后葛根粉末饮片中淀粉的分子链发生迁移和重组,淀粉的晶体结构发生改变。见图7、图8。

图7 PL与M-PL70/40/20样品中淀粉颗粒扫描电镜图
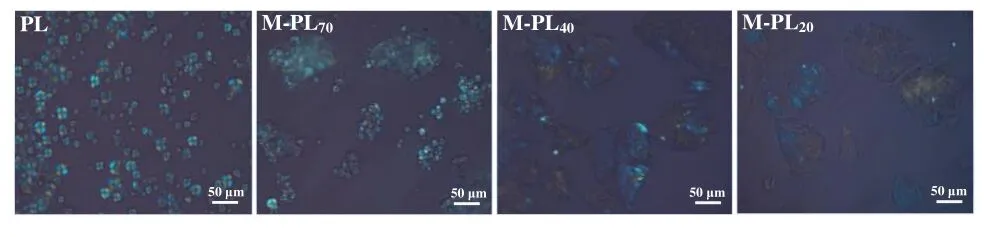
图8 PL与M-PL70/40/20样品中淀粉颗粒偏光显微镜图
2.5.3 晶型与结晶度分析
对“2.5.1”提取的淀粉样品进行X射线衍射分析,采用连续扫描法,扫描范围2θ为3°~40°,扫描速率2°/min,步长0.02°,管压40 kV,管流200 mA。利用Jade6.0软件计算各样品的相对结晶度。
PL淀粉在5.6°、15°、17°、23°处均有较强的衍射峰,属于C型结构,且在20°处出现较明显的衍射峰,是直链淀粉和脂质形成的单螺旋峰[29]。与PL样品相比,M-PL70/40/20淀粉在5.6°、15°、17°、23°处仍然有不同强度的衍射峰,表明微波处理没有改变葛根粉末饮片中淀粉的晶型。但经计算[30],PL、M-PL70、M-PL40、M-PL20淀粉的相对结晶度分别为33.85%、24.61%、11.70%、5.05%。相对结晶度表示结晶区面积与总面积的相对比例,其值降低表明微波处理破坏了葛根粉末饮片中淀粉颗粒的有序结晶结构,使淀粉分子链趋于无序化。随着体系中样品水分质量分数增加,破坏程度增加,结晶度随之降低。见图9。

图9 PL与M-PL70/40/20样品中淀粉颗粒X射线衍射图
2.5.4 分子结构分析
准确称取“2.5.1”项下提取的淀粉样品2 mg,分别与100 mg KBr放于玛瑙研钵中,快速研磨后置于压片机中进行压片处理,对样品薄片进行全波段扫描,分辨率4 cm-1,累计扫描64次。
PL和M-PL70/40/20淀粉红外光谱图中,3 396 cm-1处的吸收峰代表O-H的伸缩振动,2 931 cm-1和861 cm-1处的吸收峰对应C-H键的伸缩振动、弯曲,1 645 cm-1处的吸收峰与淀粉非晶态区吸收水的O-H的弯曲振动有关,1 160、1 080、1 020 cm-1处的吸收峰分别对应C-O、C-O-H、C-O-C 的伸缩振动,765 cm-1处的吸收峰对应C-C的伸缩振动,930 cm-1处的吸收峰代表α-1,4糖苷链(C-O-C)的骨架模式振动[31]。从图中可以看出,PL和M-PL70/40/20淀粉的红外光谱图中没有新的化学键的形成或丢失,表明微波处理不会破坏淀粉分子的化学键。但与PL样品相比,M-PL70/40/20样品中淀粉的多个吸收峰发生展宽,尤其是羟基的吸收峰,且随着体系中样品水分质量分数增加,这一变化更为明显。表明微波处理导致葛根粉末饮片中淀粉的分子链断裂,增加了氢键的形成。见图10。

图10 PL与M-PL70/40/20样品中淀粉颗粒傅里叶红外光谱图
2.5.5 直/支链淀粉含量测定
采用直链/支链淀粉测定试剂盒,通过双波长碘比色法[32](550、485 nm波长测定直链淀粉含量,530、755 nm波长测定支链淀粉含量),对“2.5.1”项下方法提取的淀粉样品中直链淀粉、支链淀粉含量进行测定。
结果PL样品中直链淀粉含量为(23.64±1.36)%,支链淀粉含量为(73.46±3.06)%;M-PL70/40/20样品中直链淀粉含量分别为(26.25±2.04)%、(32.16±3.12)%、(34.42±2.67)%,支链淀粉含量分别为(69.09±2.58)%、(66.17±1.74)%、(62.91±2.64)%。可知,M-PL70/40/20样品中直链淀粉含量均显著高于PL样品,支链淀粉含量均低于PL样品,差异均有统计学意义(P<0.05),且随样品中水分质量分数越大,这一趋势更加明显。在微波热处理和水分的共同作用下,使部分支链淀粉的分支结构发生断裂,从而使直链淀粉含量增加,支链淀粉含量减少[33],表明微波处理显著改变了葛根粉末饮片中直链淀粉和支链淀粉的含量。
3 讨论
葛根素是葛根的主要活性成分。研究表明,葛根素起效机制与调节肠道菌群密切相关。葛根素通过影响肠道菌群丰度,提高其代谢产物短链脂肪酸水平,降低促炎细胞因子的表达,可以改善骨微环境,从而对雌性食蟹去卵巢诱导的骨质疏松小鼠模型发挥治疗作用[9];葛根素还能通过改变肠道菌群的组成,富集黏液嗜阿克曼氏菌的丰度,并提高Muc 2和Reg 3g的肠道表达水平,保护肠道屏障功能,预防高脂饮食诱导的肥胖症以及并发症[7]。另有研究表明,葛根素通过改善溃疡性结肠炎小鼠肠道菌群紊乱,刺激肠道内黏液蛋白分泌和杯状细胞分化,重塑肠道黏液层,可缓解小鼠溃疡性结肠炎的症状[8]。因此,有必要增强葛根素的结肠部位靶向性,而目前大部分葛根类口服制剂主要提高以葛根素为主的活性成分在体内的生物利用度,而难以使葛根素直接作用于结肠部位。本研究通过微波法制备的缓释型葛根粉末饮片与普通葛根粉末饮片相比,可显著减少葛根素成分在模拟胃肠液中的溶出量,有助于葛根素到达结肠部位,通过调节肠道菌群防治疾病。
微波可通过微波场中极性分子的快速振动,使材料在较短时间内达到较高温度[34]。与其他物理加热技术相比,微波具有高效、节能、更安全等优点,其能量对氢键、范德华力、疏水键、盐键等具有较强的破坏作用[35]。在淀粉改性方面,微波也是一种常用且有效的物理方法,而影响淀粉对微波吸收的主要因素是微波的功率、加热时间及淀粉含水量,其中水分对其影响最为显著[24,36]。本研究发现,微波法对葛根粉末饮片中淀粉的颗粒结构和理化性质产生显著影响。微波处理后,淀粉颗粒出现膨胀、发生破裂及颗粒结构消失,淀粉的相对结晶度下降,偏光十字逐渐减少甚至消失,淀粉分子中各基团的吸收峰明显展宽。此外,微波处理导致葛根粉末饮片中直链淀粉含量增加,支链淀粉含量减少,并提高了淀粉在模拟小肠液中的消化速率。这些理化性质的改变可直接或间接影响葛根粉末饮片的营养价值、加工特性及防治疾病效果。
综上,本研究以微波法对葛根粉末饮片中淀粉理化性质的改变,可显著增加葛根素在结肠中的溶出量,从而更有效发挥肠道菌群调节作用。

