基于BDNF/TrkB信号通路的锁阳黄酮对阿尔茨海默病大鼠学习记忆能力的影响
吕鑫 ,顾志荣 ,祁梅 ,郭燕 ,毛小文 ,葛斌
1.甘肃中医药大学药学院,甘肃 兰州 730000; 2.甘肃省人民医院,甘肃 兰州 730000
锁阳为锁阳科植物锁阳Cynomorium songaricumRupr.的干燥肉质茎[1],其有效部位锁阳黄酮主要由儿茶素、木犀草素-7-O-β-D-吡喃葡萄糖苷、表儿茶素、芸香苷、表儿茶素没食子酸酯等成分组成[2],具有抗氧化[3]、延缓衰老[4]、清除自由基及调节免疫[5]等多种活性。阿尔茨海默病(AD)是一种多见于老年人的渐进性、致残性神经退行性病变,以认知功能减退、记忆力下降、语言功能障碍等为主要临床表现,严重者完全丧失生活能力[6]。AD主要病理改变是皮层和海马神经元外的β淀粉样蛋白(Aβ)沉积及神经元内高度磷酸化的Tau蛋白形成纤维缠结[7-8]。BDNF/TrkB信号通路与海马学习记忆能力相关,因此与AD关系密切。脑源性神经营养因子(BDNF)是中枢神经系统最常见的神经营养因子,通过结合和激活酪氨酸激酶受体B(TrkB)维持突触生长和可塑性,抑制神经细胞凋亡及调控中枢胆碱能系统稳态[9]。研究表明,BDNF可通过改变突触前的递质释放,或增加突触后的递质敏感性调节突触效能[10-11],从而提高突触可塑性。乙酰胆碱(ACh)是调节认知功能的神经递质,在AD患者海马中水平降低[12-13],前期研究表明,BDNF蛋白表达与ACh含量呈正相关[14]。BDNF结合TrkB受体后可激活下游PI3K/Akt、MAPK/ERK等抗凋亡通路[15]。因此,本实验通过海马注射Aβ1-42诱导AD大鼠模型,观察锁阳黄酮对模型大鼠行为学,海马组织BDNF、TrkB、ACh及凋亡相关蛋白表达的影响,揭示其抗AD的作用机制,为AD治疗提供实验依据。
1 材料与方法
1.1 动物
4 月龄SPF 级雄性Wistar 大鼠70 只,体质量(250±50)g,中国农业科学院兰州兽医研究所提供,动物生产许可证号SCXK(甘)2020-0002。饲养于甘肃省药品检验研究院SPF级动物实验室,动物使用许可证号SYXK(甘)2020-0006。
1.2 药物及制备
锁阳药材,2021年3月采集于内蒙古,经甘肃中医药大学药学院中药鉴定教研室李硕副教授鉴定为锁阳Cynomorium songaricumRupr.的干燥肉质茎。由实验室按前期方法制备锁阳黄酮[16],用生理盐水分别配制成浓度为2.5、5、10 mg/mL 溶液。Aβ1-42冻干粉(货号04010011827,强耀生物),使用前37 ℃孵育1周,使其呈凝聚态备用。取Aβ1-42冻干粉1 mg 溶于50 μL DMSO 中,加生理盐水至200 μL,稀释成5 μg/μL,分装后,避光保存于-80 ℃冰箱备用。盐酸多奈哌齐片(货号2010023),5 mg/片,卫材(中国)药业,用生理盐水配制成0.05 mg/mL水溶液。
1.3 主要试剂与仪器
TUNEL 试剂盒(货号49330900),瑞士罗氏;Bax 抗体(货号50599-2-1g),武汉三鹰;Bcl-2 抗体(货号A19693)、半胱氨酸蛋白酶(Caspase)-9抗体(货号A18676)、TrkB抗体(货号A19832),武汉爱博泰克;BDNF 抗体(货号ab108319),上海艾博抗;Caspase-3抗体(货号AF6311),江苏亲科生物;胆碱乙酰转移酶(ChAT)、ACh、乙酰胆碱酯酶(AChE)ELISA 试剂盒(货号分别为ZC-36507、ZC-37533、ZC-37535),上海茁彩。大鼠跳台记录仪(型号DB097),北京智鼠多宝;透射电子显微镜(型号JEM-1400FLASH),日本电子株式会社;大鼠脑立体定位仪(型号WT-200),成都泰盟;转轮式切片机(型号2016),德国徕卡;数字切片扫描仪(型号Pannoramic 250),匈牙利3DHIESTECH;全功能酶标仪(型号MK3),美国Thermo Fisher;高速低温组织研磨仪(型号KZ-Ⅲ-F),武汉赛维尔。
1.4 造模
70只大鼠适应性饲养1周后随机选取10只作为空白组、10只作为假手术组。剩余大鼠腹腔注射3%戊巴比妥钠35 mg/kg麻醉,参照脑立体定位坐标[17]确定海马位置:前囟后沿中线移3.0 mm,左右各旁开2.2 mm,硬脑膜下深3 mm。用牙科钻在定位点钻孔,用微量进样器在两侧各缓慢注射Aβ1-42溶液1 μL。空白组不予处理,假手术组注射等体积生理盐水。退针完毕缝合伤口,单笼饲养至大鼠伤口痊愈。
1.5 分组及给药
将造模大鼠随机分为模型组、多奈哌齐组和锁阳黄酮低、中、高剂量组,每组10只。造模后3 d开始灌胃,多奈哌齐组予多奈哌齐溶液0.5 mg/kg,锁阳黄酮低、中、高剂量组予锁阳黄酮溶液25、50、100 mg/kg,灌胃体积1 mL/100 g,空白组、假手术组和模型组灌胃等体积生理盐水,每日1次,连续28 d。
1.6 跳台实验
跳台实验分学习阶段和记忆阶段[18]。学习阶段先将大鼠放入跳台箱中自由活动3 min,再通以36 V电压,大鼠受到刺激后正确反应是跳上平台躲避电击,错误反应是跳下平台受到电击,24 h后再次实验检测大鼠记忆保持能力。记录学习阶段与记忆阶段第1次跳下平台的潜伏期及5 min内错误次数。
1.7 取材
跳台实验结束后,3%戊巴比妥钠麻醉大鼠,股动脉取血,静置2 h,4 ℃、3 500 r/min离心10 min,分离血清,-80 ℃冰箱保存,用于ELISA检测。取血后脱颈处死大鼠,取3只分离全脑,置于4%多聚甲醛中固定,用于TUNEL染色。剩余大鼠冰盒上迅速取脑并分离双侧海马,取黄豆大小海马组织用3%戊二醛固定,用于透射电镜观察,剩余海马组织液氮速冻后,置于-80 ℃冰箱保存,用于ELISA和Western blot检测。
1.8 TUNEL染色
固定的脑组织经脱水、浸蜡、包埋、切片、脱蜡后,柠檬酸微波修复8 min,PBS洗3次,每次5 min。加TUNEL孵育液,37 ℃孵育1 h,PBS洗3次,每次5 min。加DAPI染核15 min,PBS冲洗,甘油明胶封片,采用数字切片扫描仪进行扫描,计算细胞凋亡率(凋亡细胞数÷总细胞数×100%)。
1.9 透射电镜观察
将戊二醛固定的海马组织用1%四氧化锇再固定,丙酮逐级脱水,Epon812包埋,半薄切片用甲苯胺蓝染色作光学定位,钻石刀作超薄切片,醋酸铀和枸橼酸铅染色后用透射电镜观察。
1.10 ELISA检测
取海马组织,加入9倍量PBS,充分研碎,匀浆液4 ℃、12 000 r/min离心10 min,取上清液,按试剂盒说明书操作,测定海马组织及血清ChAT、ACh、AChE含量。
1.11 Western blot检测
取海马组织,加入10 倍量裂解液提取总蛋白,BCA蛋白定量试剂盒测定蛋白浓度,30 μg蛋白上样,先100 V电泳15 min,当溴酚蓝到达分离胶后,再180 V电泳至溴酚蓝到分离胶底部,200 mA转膜1 h,加5%脱脂牛奶封闭,加Bax 一抗(1∶5 000)、Bcl-2 一抗(1∶2 000)、BDNF一抗(1∶2 000)、Caspase-3一抗(1∶2 000)、Caspase-9 一抗(1∶2 000)、TrkB 一抗(1∶2 000)、β-actin一抗(1∶100 000),4 ℃孵育过夜,洗膜,加入二抗孵育,超敏ECL曝光,凝胶成像系统对条带进行扫描,以β-actin为内参,计算目的蛋白相对表达量。
1.12 统计学方法
采用SPSS23.0 统计软件进行分析。计量资料以±s表示,组间比较用方差分析。P<0.05表示差异有统计学意义。
2 结果
2.1 锁阳黄酮对模型大鼠跳台实验结果的影响
与假手术组比较,模型组大鼠跳台实验学习和记忆阶段潜伏期均明显缩短(P<0.01),错误次数明显增加(P<0.01);与模型组比较,多奈哌齐组和锁阳黄酮高剂量组大鼠跳台实验学习和记忆阶段潜伏期明显延长(P<0.05,P<0.01),错误次数明显减少(P<0.05,P<0.01),见表1。
表1 各组大鼠跳台实验结果比较(±s)

表1 各组大鼠跳台实验结果比较(±s)
注:与假手术组比较,**P<0.01;与模型组比较,&P<0.05,&&P<0.01
组别空白组假手术组模型组多奈哌齐组锁阳黄酮低剂量组锁阳黄酮中剂量组锁阳黄酮高剂量组只数10 10 10 10 10 10 10学习阶段潜伏期/s 178.14±77.49 190.30±79.39 92.35±46.95**169.83±63.17&&117.12±67.35 135.93±45.79 163.97±61.60&错误次数2.90±1.10 2.90±1.20 10.30±2.67**4.70±1.95&&8.90±3.21 7.30±2.83 5.90±1.91&记忆阶段潜伏期/s 211.67±67.98 232.60±53.42 122.72±61.24**191.98±91.94&128.10±57.25 155.58±56.36 200.92±49.88&&错误次数1.70±1.06 1.50±0.85 8.40±2.91**3.40±1.26&&6.80±2.82 6.50±2.42 4.10±2.13&
2.2 锁阳黄酮对模型大鼠海马组织细胞凋亡的影响
空白组和假手术组大鼠海马组织无明显细胞凋亡;与假手术组比较,模型组大鼠海马组织细胞凋亡率明显升高(P<0.01);与模型组比较,多奈哌齐组和锁阳黄酮各剂量组大鼠海马组织细胞凋亡率明显降低(P<0.01)。见图1、表2。
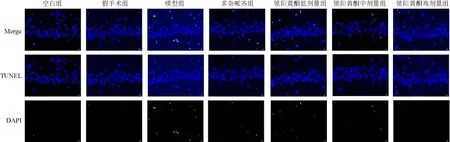
图1 各组大鼠海马组织细胞凋亡阳性表达(TUNEL染色,×400)
表2 各组大鼠海马组织细胞凋亡率比较(±s,%)

表2 各组大鼠海马组织细胞凋亡率比较(±s,%)
注:与假手术组比较,**P<0.01;与模型组比较,&&P<0.01
2.3 锁阳黄酮对模型大鼠海马组织超微结构的影响
空白组和假手术组大鼠海马组织神经细胞结构正常,突触数量较多;模型组大鼠海马组织大量神经细胞凋亡,胞浆内可见肿胀的线粒体,部分粗面内质网扩张,突触数量减少,突触间隙增宽;多奈哌齐组大鼠海马组织神经细胞线粒体轻度肿胀,粗面内质网轻度扩张,突触数量较多;锁阳黄酮低剂量组大鼠海马组织多数神经细胞凋亡,胞浆内可见肿胀的线粒体,部分粗面内质网轻度扩张,突触数量和突触小泡较少,突触间隙增宽;锁阳黄酮中剂量组大鼠海马组织神经细胞少量凋亡,细胞核皱缩,染色质聚集,胞浆电子密度增大,线粒体肿胀,轴突内神经纤维溶解、空化,突触数量较少,突触小泡较丰富,部分突触间隙增宽;锁阳黄酮高剂量组大鼠海马组织神经细胞核轻度皱缩,细胞膜不连续,胞浆内容物丢失,突触数量较多,突触小泡轻度溶解,部分突触间隙增宽。见图2、图3。

图2 各组大鼠海马组织神经细胞超微结构(标尺=1 μm)

图3 各组大鼠海马组织突触超微结构(标尺=500 nm)
2.4 锁阳黄酮对模型大鼠海马组织及血清胆碱乙酰转移酶、乙酰胆碱、乙酰胆碱酯酶含量的影响
与假手术组比较,模型组大鼠海马组织及血清ChAT、ACh含量明显减少(P<0.01),AChE含量明显增加(P<0.01);与模型组比较,多奈哌齐组和锁阳黄酮高剂量组大鼠海马组织及血清ChAT、ACh含量明显增加(P<0.01,P<0.05),AChE 含量明显减少(P<0.01,P<0.05)。见表3。
表3 各组大鼠海马组织及血清ChAT、ACh、AChE含量比较(±s)
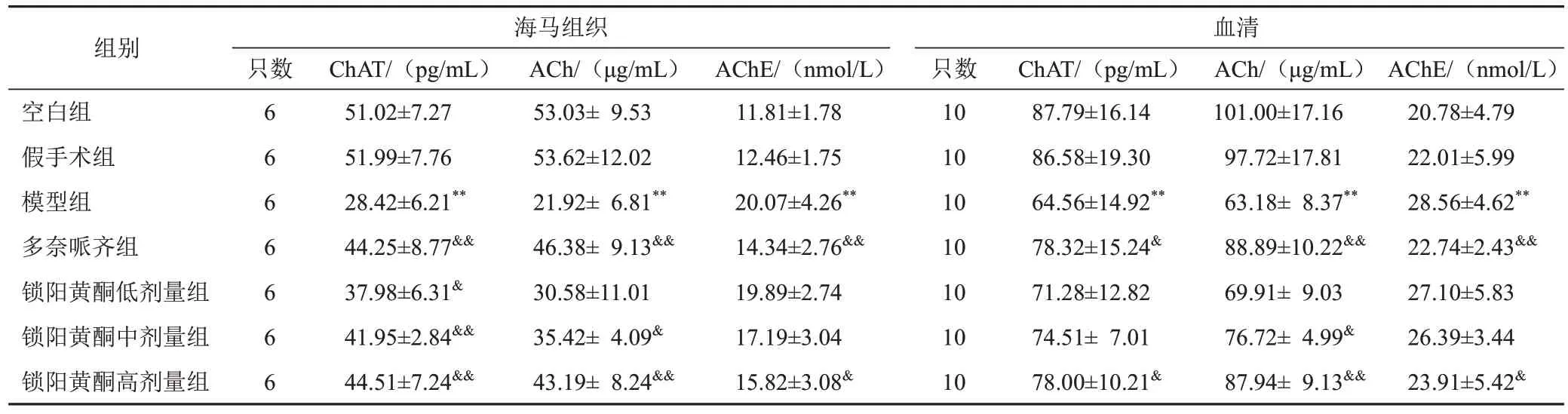
表3 各组大鼠海马组织及血清ChAT、ACh、AChE含量比较(±s)
注:与假手术组比较,**P<0.01;与模型组比较,&P<0.05,&&P<0.01
组别空白组假手术组模型组多奈哌齐组锁阳黄酮低剂量组锁阳黄酮中剂量组锁阳黄酮高剂量组海马组织只数血清AChE/(nmol/L)20.78±4.79 22.01±5.99 28.56±4.62**22.74±2.43&&27.10±5.83 26.39±3.44 23.91±5.42&6 6 6 6 6 6 6 ChAT/(pg/mL)51.02±7.27 51.99±7.76 28.42±6.21**44.25±8.77&&37.98±6.31&41.95±2.84&&44.51±7.24&&ACh/(μg/mL)53.03± 9.53 53.62±12.02 21.92± 6.81**46.38± 9.13&&30.58±11.01 35.42± 4.09&43.19± 8.24&&AChE/(nmol/L)11.81±1.78 12.46±1.75 20.07±4.26**14.34±2.76&&19.89±2.74 17.19±3.04 15.82±3.08&只数10 10 10 10 10 10 10 ChAT/(pg/mL)87.79±16.14 86.58±19.30 64.56±14.92**78.32±15.24&71.28±12.82 74.51± 7.01 78.00±10.21&ACh/(μg/mL)101.00±17.16 97.72±17.81 63.18± 8.37**88.89±10.22&&69.91± 9.03 76.72± 4.99&87.94± 9.13&&
2.5 锁阳黄酮对模型大鼠海马组织Bcl-2、Bax、半胱氨酸蛋白酶-3、半胱氨酸蛋白酶-9、脑源性神经营养因子和酪氨酸激酶受体B蛋白表达的影响
与假手术组比较,模型组大鼠海马组织Bcl-2、BDNF和TrkB蛋白表达明显降低,Bax、Caspase-3和Caspase-9蛋白表达明显升高,差异有统计学意义(P<0.01);与模型组比较,多奈哌齐组和锁阳黄酮高剂量组大鼠海马组织Bcl-2、BDNF和TrkB蛋白表达明显升高,Bax、Caspase-3和Caspase-9蛋白表达明显降低,差异有统计学意义(P<0.05,P<0.01)。见图4、表4。
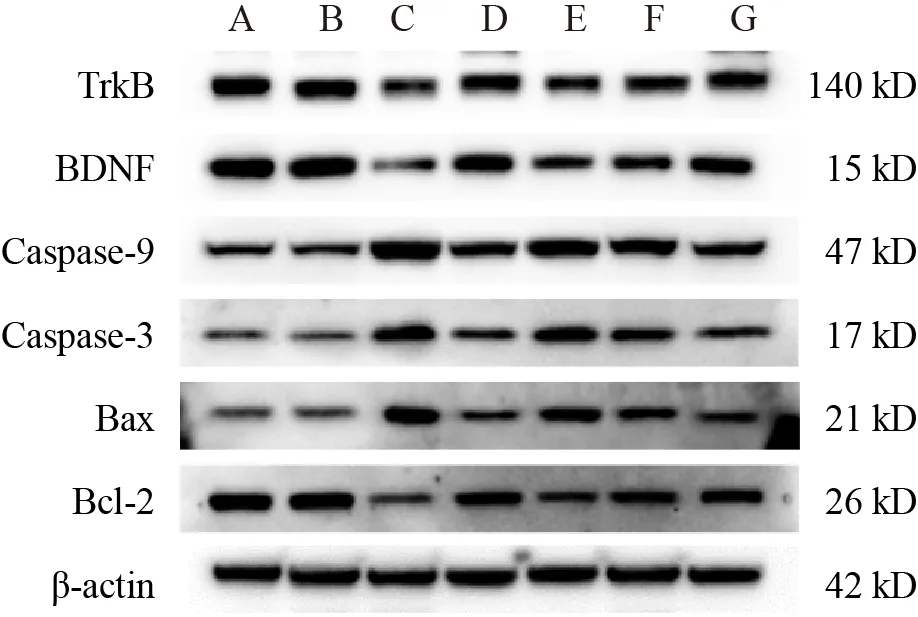
图4 各组大鼠海马组织Bcl-2、Bax、Caspase-3、Caspase-9、BDNF和TrkB蛋白免疫印迹
表4 各组大鼠海马组织Bcl-2、Bax、Caspase-3、Caspase-9、BDNF和TrkB蛋白表达比较(±s)
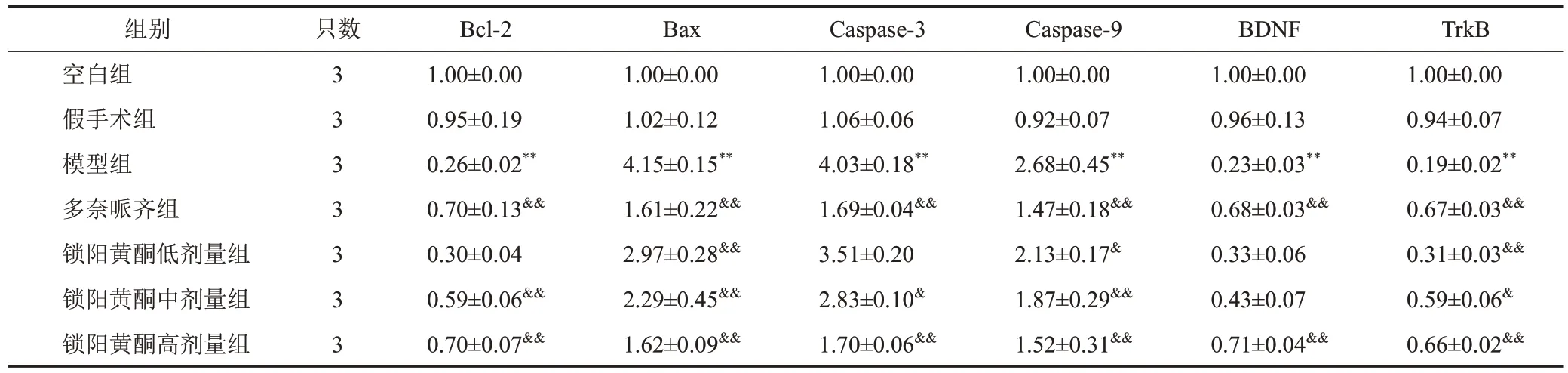
表4 各组大鼠海马组织Bcl-2、Bax、Caspase-3、Caspase-9、BDNF和TrkB蛋白表达比较(±s)
注:与假手术组比较,**P<0.01;与模型组比较,&P<0.05,&&P<0.01
TrkB 1.00±0.00 0.94±0.07 0.19±0.02**0.67±0.03&&0.31±0.03&&0.59±0.06&0.66±0.02&&组别空白组假手术组模型组多奈哌齐组锁阳黄酮低剂量组锁阳黄酮中剂量组锁阳黄酮高剂量组只数3 3 3 3 3 3 3 Bcl-2 1.00±0.00 0.95±0.19 0.26±0.02**0.70±0.13&&0.30±0.04 0.59±0.06&&0.70±0.07&&Bax 1.00±0.00 1.02±0.12 4.15±0.15**1.61±0.22&&2.97±0.28&&2.29±0.45&&1.62±0.09&&Caspase-3 1.00±0.00 1.06±0.06 4.03±0.18**1.69±0.04&&3.51±0.20 2.83±0.10&1.70±0.06&&Caspase-9 1.00±0.00 0.92±0.07 2.68±0.45**1.47±0.18&&2.13±0.17&1.87±0.29&&1.52±0.31&&BDNF 1.00±0.00 0.96±0.13 0.23±0.03**0.68±0.03&&0.33±0.06 0.43±0.07 0.71±0.04&&
3 讨论
中医学认为,AD病机为肾精不足、脑髓渐空,临床常用补肾益精中药治疗记忆力减退、理解能力降低、情绪低落等AD或类AD症状。锁阳是补肾益精要药,能补肾阳、益精血、利大便。现代研究表明,锁阳的神经保护机制是多成分、多靶点共同作用的结果,主要通过降低脑组织氧化应激水平[19]、清除氧自由基[20]、调节线粒体动力失衡[21]、促进细胞再生及神经突触增长[22]、保护海马细胞神经元形态[23]等改善学习记忆能力,实现神经保护作用。
Aβ引起的神经毒性被认为是AD突触功能和认知功能障碍的主要原因[24]。BDNF是哺乳动物海马内分布最广的神经营养因子之一,具有促进神经系统发育、抗神经元损伤、改善学习记忆能力等多种生物学活性[25]。研究表明,AD患者海马区、内嗅皮层、新皮质和基底前脑表现为BDNF表达降低[26],提示Aβ可降低BDNF表达,从而引起突触丢失和认知功能损伤。本实验结果表明,大鼠双侧海马注射Aβ1-42后,跳台实验学习和记忆阶段错误次数明显增加,潜伏期明显缩短,透射电镜观察显示突触数量减少、间隙增宽。经锁阳黄酮干预后,模型大鼠认知功能损伤和突触超微结构得到改善。BDNF通过与TrkB受体结合,导致TrkB酪氨酸残基自磷酸化,并激活下游信号通路。此外,BDNF/TrkB 还可以激活PI3K/Akt 信号通路,诱导BDNF自分泌,破坏糖原合成酶激酶-3磷酸化,从而改善AD大鼠学习记忆能力[27-28]。PI3K/Akt信号通路与细胞凋亡联系密切,其中Bcl-2和Bax蛋白能有效调节细胞凋亡。AD患者海马组织Bcl-2表达降低,Bax表达升高,从而激活Caspase并触发依赖性凋亡级联反应,激活的Caspase可修饰蛋白质,在Aβ1-42引起的细胞凋亡中发挥关键作用[29]。本实验结果表明,模型组大鼠海马组织细胞凋亡率明显升高,多数神经细胞凋亡,Bcl-2、BDNF 和TrkB 蛋白 表 达 明 显 下 调,Bax、Caspase-3和Caspase-9蛋白表达明显上调,锁阳黄酮能降低模型大鼠海马组织细胞凋亡率,逆转上述蛋白表达,提示其能激活BDNF/TrkB信号通路,从而抑制细胞凋亡。ACh是胆碱能传导通路中的关键神经递质,研究表明,其含量与学习记忆能力呈正相关[30]。AChE和ChAT是维持ACh含量动态平衡的关键酶,在AD发生时,大量胆碱能神经元丢失,ChAT水平降低造成ACh合成、储存与释放大幅减少,进而引起学习、记忆和识别功能障碍[31]。本实验结果显示,模型组大鼠海马组织及血清ChAT、ACh含量明显减少,AChE含量明显增加,锁阳黄酮高剂量组海马组织及血清ChAT、ACh含量明显增加,AChE含量明显减少,表明其能改善胆碱能系统损伤,增强胆碱能系统功能。
综上所述,锁阳黄酮能改善Aβ1-42诱导的AD模型大鼠学习记忆能力,其机制可能与激活海马组织BDNF/TrkB 信号通路,增加中枢胆碱能系统ACh 含量,抑制细胞凋亡及增加突触可塑性有关。

