DPMAS联合CVVH治疗对脓毒症致多器官功能衰竭患者炎症反应和预后的影响
殷瑶瑶,黄河奔,郭琼琼,王俊霞
(河南科技大学第一附属医院 肾脏内科二病区,河南 洛阳 471000)
脓毒症多发于各种原因导致的严重感染性疾病,可显著增加患者多器官功能衰竭及病死的风险[1]。对于脓毒症致多器官功能衰竭患者,在控制原发病、抗感染及支持治疗的基础上,进行免疫调节治疗有助于减轻炎症风暴,改善预后[2]。连续性静脉-静脉血液滤过(continuous veno-venous hemofiltration,CVVH)是临床治疗脓毒症常用手段,对排出患者体内毒素、抑制炎症反应均有效果,但由于患者病死风险高,单一应用CVVH难以快速清除患者体内炎症因子[3-4]。而双重血浆分子吸附系统(double plasma molecular absorb system,DPMAS)是组合型人工肝治疗模式,能有效清除人体内中大分子毒素及炎性介质,在伴有全身炎症反应综合征的多种重症疾病中均有应用[5]。鉴于此,本研究旨在探究DPMAS联合CVVH模式治疗脓毒症致多器官功能衰竭患者的临床效果。
1 对象与方法
1.1 研究对象回顾性收集2020年9月至2022年9月河南科技大学第一附属医院92例脓毒症致多器官功能衰竭患者的临床资料,依据患者治疗方式,将其中42例经CVVH治疗的患者纳入对照组,50例经DPMAS联合CVVH治疗的患者纳入观察组。对照组男22例,女20例;年龄43~66岁,平均(52.24±3.74)岁;器官衰竭数2个16例,3个22例,4个及以上4例。观察组中男28例,女22例;年龄41~65岁,平均(52.36±3.68)岁;器官衰竭数2个19例,3个26例,4个及以上5例。两组以上资料差异无统计学意义(P>0.05)。
1.2 入选标准
1.2.1纳入标准 (1)脓毒症符合《中国严重脓毒症/脓毒性休克治疗指南(2014)》[6]中的诊断标准,且经血流动力学、实验室检查证实;(2)2个及以上器官出现功能衰竭;(3)首次发病,接受血液滤过治疗;(4)获得治疗后为期30 d的随访;(5)临床资料保存完整,无缺失。
1.2.2排除标准 (1)入院时进行机械通气治疗;(2)入院72 d内病死;(3)存在血液系统疾病;(4)合并恶性肿瘤或其他传染病。
1.3 研究方法
1.3.1常规治疗 两组均开展系统治疗,主要包括液体复苏治疗、一次或多次静脉经验性给予广谱抗菌药物、肠内营养支持治疗以及并发症防治等。
1.3.2对照组 进行CVVH治疗,于患者股静脉处置管,建立临时血管通路。使用德国费森尤斯有限公司的血液滤过设备和高通量聚砜膜滤器进行血液滤过,根据患者容量情况控制脱水量为250~300 mL·h-1,血流量为180 mL·min-1,置换液量标准:35 mL·kg-1·h-1。维持总治疗时间为72 h。
1.3.3观察组 进行DPMAS联合CVVH模式治疗,治疗前准备同对照组。DPMAS治疗:使用血液净化机分离血浆,对分离的血浆再串联HA330-Ⅱ中性树脂血液灌流器及BS-330血浆胆红素吸附器进行血浆灌流,血流速为150 mL·min-1,血浆分离速度30 mL·min-1,维持治疗时间5 h,5 h后撤下血液净化机、血液灌流器、血浆胆红素吸附器再行CVVH治疗。CVVH治疗:同对照组。维持总治疗时间为72 h。
1.4 观察指标
1.4.1炎症因子 于治疗前、治疗72 h时,采集患者外周肘静脉血5 mL,常规进行离心处理,分离血清后用酶联免疫吸附法检测血清白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、超敏C反应蛋白(hypersensitive C-reactive protein,hs-CRP)水平。
1.4.2血常规 于治疗前、治疗72 h时,采集患者外周肘静脉血5 mL,用血细胞分析仪(南京贝登医疗股份有限公司,型号BC-30S)检测血红蛋白(hemoglobin,Hb)、血小板计数(platelet,PLT);常规取血清用酶联免疫吸附测定法测定白细胞计数(white blood cell,WBC)、中性粒细胞的百分比(neutrophil percentage,NEUT%)。
1.4.3序贯器官衰竭(sequential organ failure assessment,SOFA)[7]及急性生理学和慢性健康状况评分系统Ⅱ(acute physiology and chronic health evaluation Ⅱ,APACHEⅡ)[8]评分 在治疗前、治疗结束后对患者进行SOFA、APACHE-Ⅱ评分。SOFA:量表评估人体六大系统状况,依据器官功能障碍程度依次计分0~4分,0分为无障碍,1、2分为器官功能障碍,3、4分为器官功能衰竭,总分0~24分,总分越高表明器官功能障碍越严重。APACHEⅡ总分0~71分,总分越高表明患者健康状况越差,病情越重。
1.4.4预后结局 统计患者治疗后30 d内患者预后结局(存活、病死)。
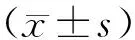
2 结果
2.1 炎症因子治疗前,两组血清IL-6、TNF-α、hs-CRP水平比较,差异无统计学意义(P>0.05);治疗72 h,两组血清IL-6、TNF-α、hs-CRP较降低,与对照组比较,观察组上述血清水平低于对照组(P<0.05)。见表1。
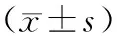
表1 两组炎症因子水平比较
2.2 血常规治疗前,两组Hb、PLT、WBC、NEUT%水平比较,差异无统计学意义(P>0.05);治疗72 h,两组Hb、PLT、WBC、NEUT%水平较治疗前降低,观察组Hb、PLT水平低于对照组,WBC、NEUT%水平高于对照组(P<0.05)。见表2。
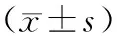
表2 两组血常规水平比较
2.3 SOFA及APACHE-Ⅱ评分治疗前,两组SOFA及APACHE-Ⅱ评分比较,差异无统计学意义(P>0.05);治疗72 h,两组SOFA及APACHEⅡ评分降低,与对照组比较,观察组SOFA及APACHE-Ⅱ评分低(P<0.05)。见表3。
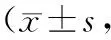
表3 两组SOFA及APACHE-Ⅱ评分比较分)
2.4 预后结局随访期间观察组中病死4例,存活46例,依次占比8.00%(4/50)、92.00%(46/50)。对照组中病死10例,存活32例,依次占比23.81%(10/42)、76.19%(32/42)。与对照组比较,观察组患者病死率低(χ2=4.422,P=0.036)。
3 讨论
脓毒症具有病情重、难治愈、病死率高等特点,而患者并发的多器官功能衰竭则是患者机体感染反应严重失控的结果,其病因病机复杂,现普遍认为患者体内失控性的全身炎症反应以及体内大量炎症介质的存在是导致患者病死的重要原因[9]。临床为延长患者生存期、改善预后须在对症综合治疗的基础上积极开展免疫调节治疗,降低炎症细胞因子水平。
CVVH模式是治疗脓毒症致多器官功能衰竭的有效手段,可清除脓毒症的炎症介质、排出患者体内毒素。DPMAS是血液灌流器、胆红素吸附柱联合应用的人工肝治疗模式,能在吸附胆红素同时对患者炎症介质进行清除且不耗费血浆,疗效确切[10]。
本研究结果显示,与对照组比较,治疗72 h后观察组IL-6、TNF-α、hs-CRP水平降低,表明DPMAS联合CVVH模式可有效减轻脓毒症致多器官功能衰竭患者炎症反应。由于DPMAS系统中的HA330-Ⅱ中性树脂血液灌流器是相对广谱性的吸附剂,具有大孔结构和较大表面积,能高效利用分子间作用力及骨架分子筛作用来吸附体内循环组织中的炎性介质,继而达到清除炎症细胞因子的效果[11]。CVVH将脓毒症患者血液引入血滤器并进行置换液补充,是基于滤过原理来模仿人体正常肾小球滤过功能,从而对患者体内的中分子物质及过多的炎症因子产生清除效果[12]。因而二者联合应用可有效减轻脓毒症致多器官功能衰竭患者炎症反应。
本研究结果数据还指出,与对照组相比,观察组患者血常规指标、SOFA及APACHE-Ⅱ评分均优,表明DPMAS联合CVVH对患者损伤程度小。这是因为DPMAS系统中BS-330血浆胆红素吸附器能依靠亲脂结合性作用以及静电完成胆红素特异性吸附,配合HA330-Ⅱ中性树脂血液灌流器可同时清除相应分子量的炎性细胞因子以及负电性生物毒素[13]。这有效阻止了患者脓毒症后期的炎症瀑布样效应,维持患者血液流变学的稳定,促使机体内炎症因子浓度达到再平衡,重建机体免疫状态,继而保护患者器官功能[14]。此外,患者治疗期间血液有形成分不会与DPMAS吸附介质接触,因而能减轻血液灌流治疗期间对患者血细胞损伤,为患者器官功能恢复提供有利条件[15]。随访期间,观察组病死率低于对照组,这与DPMAS联合CVVH模式可有效减轻患者炎症反应、促使器官功能恢复有直接关系。本研究例数较少导致研究结果可靠性一般,未来需扩大研究样本量研究来增强研究结果的可靠性、实用性。
综上所述,DPMAS联合CVVH模式可有效减轻脓毒症致多器官功能衰竭患者炎症反应,患者预后良好。

