HAX-1通过调控MDM2/SMAD3通路对TGF-β1诱导的特发性肺间质纤维化的作用机制
高崴崴,刘待见,张晓萍,冯青青,刘颖
(郑州大学第二附属医院 呼吸与危重症医学科,河南 郑州 450000)
特发性肺间质纤维化(idiopathic pulmonary fibrosis,IPF)是一种慢性、进行性、纤维化间质性肺炎,其发病率呈逐渐上升趋势,多发于成年人。但因发病机制至今仍不明确,目前尚无有效的治疗方法。IPF起病隐匿,主要表现为活动性呼吸困难、渐进性加重[1-2]。患者常出现肺泡上皮间质转化(epithelial-mesenchymal transition,EMT),引发成纤维细胞过度增殖,间质细胞外基质明显沉积,最终出现肺纤维化[3-4]。A549细胞具有Ⅱ型肺泡上皮细胞的形态和特征,采用转化生长因子-β1(transforming growth factor-β1,TGF-β1)诱导A549细胞发生EMT,是目前常用的构建肺纤维化细胞模型的方法[5-6]。
造血细胞特异性蛋白1相关蛋白X-1(hematopoietic cell-specific protein1-associated protein X-1,HAX-1)是一种广泛表达于人体组织的多功能蛋白[7]。HAX-1主要分布在线粒体、内质网和核膜附近的细胞质中[8-9]。研究显示,HAX-1在恶性肿瘤中呈高表达,并促进乳腺癌、结直肠癌、胶质瘤、肝细胞癌等肿瘤细胞的增殖和侵袭[10-13]。文献表明,HAX-1可通过诱导EMT过程进而促进肝癌细胞的侵袭和迁移[14]。流感病毒感染是导致肺泡上皮细胞EMT及肺纤维化的重要因素[15-16],而HAX-1可以通过与PB1-F2相互作用促进禽流感病毒在肺泡上皮细胞中的复制,并能抑制细胞凋亡,延长细胞寿命[17]。因此,推测HAX-1可能会促进肺泡上皮细胞的EMT过程。本研究拟探讨HAX-1在肺泡上皮细胞EMT过程中的作用及其作用机制,为IPF的治疗提供理论依据。
1 材料与方法
1.1 材料A549细胞购自美国ATCC公司;胎牛血清、DMEM培养基购自美国Gibco公司; TGF-β1、SIS3(SMAD3特异性抑制剂)购自美国Sigma-Aldrich公司;BCA蛋白定量试剂盒、RIPA裂解液购自南京建成生物工程研究所;兔抗HAX-1多克隆抗体(ab137613)、兔抗鼠双微体基因2(murine double minute 2,MDM2)单克隆抗体(ab259265)、兔抗E-钙黏蛋白(E-cadherin)单克隆抗体(ab308347)、兔抗α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)多克隆抗体(ab5694)、兔抗Ⅰ型胶原α1链(collagen type Ⅰ alpha 1 chain,COL1A1)单克隆抗体(ab138492)、兔抗SMAD3多克隆抗体(ab84177)、兔抗p-SMAD3(phospho S423 + S425)多克隆抗体(ab118825)、小鼠抗GAPDH单克隆抗体(ab8245)、辣根过氧化物酶标记的山羊抗兔IgG(ab6721))、辣根过氧化物酶标记的兔抗小鼠IgG(ab6728)购自英国Abcam公司;三色预染蛋白分子量marker(8~180 kD,20350ES72)购自翌圣生物科技股份有限公司;HAX-1 siRNA及MDM2过表达质粒pcDNA.3.1-MDM2购自上海吉玛制药技术有限公司;Turbofect购自赛默飞世尔科技公司。
1.2 细胞培养及分组A549细胞采用含体积分数10%胎牛血清、100 U·mL-1青霉素及100 U·mL-1链霉素的DMEM培养基置于细胞培养箱(体积分数5% CO2、37 ℃)培养至细胞融合度80%,以2.5 g·L-1胰蛋白酶消化细胞并传代。将细胞分为对照组(无处理)、TGF-β1组(用5 μg·L-1的TGF-β1诱导48 h)、NC si组(用阴性对照siRNA转染细胞,再用5 μg·L-1的TGF-β1诱导48 h)、HAX-1 si组(用HAX-1 siRNA转染细胞,再用5 μg·L-1的TGF-β1诱导48 h)、HAX-1 si+pcDNA3.1组(用HAX-1 siRNA转染细胞,再用pcDNA3.1空质粒转染细胞,再用5 μg·L-1的TGF-β1诱导48 h)、HAX-1 si+MDM2组(用HAX-1 siRNA转染细胞,再用MDM2过表达质粒pcDNA3.1-MDM2转染细胞,再用5 μg·L-1的TGF-β1诱导48 h)、HAX-1 si+MDM2+DMSO组(用HAX-1 siRNA转染细胞,再用MDM2过表达质粒pcDNA3.1-MDM2转染细胞,向细胞培养液中加入溶剂DMSO处理细胞30 min,再用5 μg·L-1的TGF-β1诱导48 h)、HAX-1 si+MDM2+SIS3组(用HAX-1 siRNA转染细胞,再用MDM2过表达质粒pcDNA3.1-MDM2转染细胞,用终浓度为1 μmol·L-1溶于DMSO的SIS3处理细胞30 min,再用5 μg·L-1的TGF-β1诱导48 h)。各组细胞培养结束后,采用倒置相差显微镜观察细胞形态;采用Western blot检测相应目的蛋白的表达。
1.3 Western blot检测目的蛋白的表达收集细胞,采用RIPA裂解液裂解细胞,提取总蛋白,采用BCA蛋白试剂盒(美国Thermo Fisher公司)测定蛋白浓度。取50 μg蛋白,进行凝胶电泳(SDS-PAGE,100 g·L-1)。将分离的蛋白质转至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF),用50 g·L-1脱脂奶粉的封闭液室温封闭2 h。加入一抗:anti-HAX-1(1∶1 000)、anti-E-cadherin(1∶1 000)、anti-α-SMA(1∶1 000)、anti-COL1A1(1∶1 000)、anti-MDM2(1∶1 000)、anti-SMAD3(1∶1 000)、anti-p-SMAD3(1∶1 000)和anti-GAPDH(1∶2 000),于4 ℃孵育过夜。TBST洗膜后,加入辣根过氧化物酶标记的相应二抗,室温孵育1 h。用增强化学发光液ECL显影,凝胶成像系统曝光拍照。采用Image J软件分析蛋白条带的灰度值。以GAPDH为内参计算蛋白的相对表达水平。
1.4 细胞转染转染前1 d将A549细胞用胰蛋白酶消化成单细胞悬液,接种于6孔板中,密度为每孔3×105,加入不含抗生素、含体积分数10%胎牛血清的DMEM培养基培养过夜,待细胞生长至40%融合时,将HAX-1 siRNA(0.3 μg)、阴性对照NC siRNA(0.3 μg)、MDM2过表达质粒pcDNA.3.1-MDM2(0.3 μg)或空质粒pcDNA.3.1(0.3 μg)与0.6 μL Turbofect混匀,而后转染细胞,37 ℃、体积分数5% CO2培养箱孵育,24 h后再用TGF-β1诱导。
2 结果
2.1 TGF-β1对A549细胞EMT和HAX-1表达的影响采用TGF-β1诱导A549细胞48 h,结果显示,TGF-β1组细胞形态由鹅卵石形或多角形转变为梭形、纺锤形,细胞间连接变松散,呈现间充质细胞形态(图1A)。Western blot结果显示,与对照组相比,TGF-β1组细胞E-cadherin的蛋白表达降低,α-SMA、COL1A1和HAX-1的蛋白表达升高(P<0.05)(图1B)。

A为TGF-β1诱导的A549细胞镜下形态(200×);B为A549细胞HAX-1蛋白表达,与对照组比较,*P<0.05。图1 TGF-β1对A549细胞EMT和HAX-1蛋白表达的影响
2.2 HAX-1 siRNA转染对TGF-β1诱导的细胞纤维化的影响与TGF-β1组和NC si组相比,HAX-1 si组中细胞形态又转变为鹅卵石形或多角形(图2)。Western blot结果表明,与NC si组比较,HAX-1 si组中HAX-1表达降低,E-cadherin蛋白表达升高,HAX-1、α-SMA和COL1A1的蛋白表达均降低(P<0.05)(图3)。
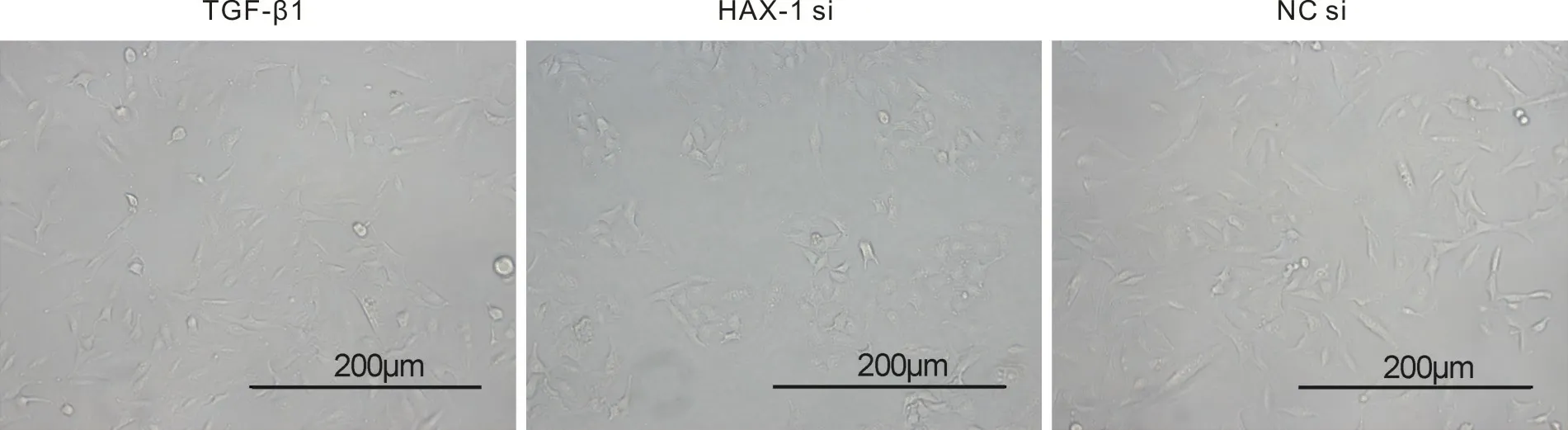
图2 HAX-1 siRNA转染对TGF-β1诱导的细胞形态变化的影响(200×)

与NC si组比较,*P<0.05。图3 HAX-1 siRNA转染对TGF-β1诱导的细胞纤维化的影响
2.3 HAX-1 siRNA转染对TGF-β1诱导的MDM2和p-SMAD3表达的影响Western blot结果表明,与NC si组比较,HAX-1 si组MDM2和p-SMAD3表达均降低(P<0.05)(图4)。

与NC si组比较,*P<0.05。图4 HAX-1 siRNA转染对TGF-β1诱导的MDM2和p-SMAD3表达的影响
2.4 HAX-1通过MDM2调控SMAD3磷酸化Western blot结果显示,与HAX-1 si+pcDNA3.1组相比,HAX-1 si+MDM2组MDM2和p-SMAD3蛋白表达均升高(P<0.05)(图5);同时,E-cadherin蛋白表达降低,α-SMA和COL1A1蛋白表达升高(P<0.05)(图6)。

与HAX-1 si+pcDNA3.1组比较,*P<0.05。图5 MDM2过表达对TGF-β1诱导的A549细胞中SMAD3磷酸化的调控
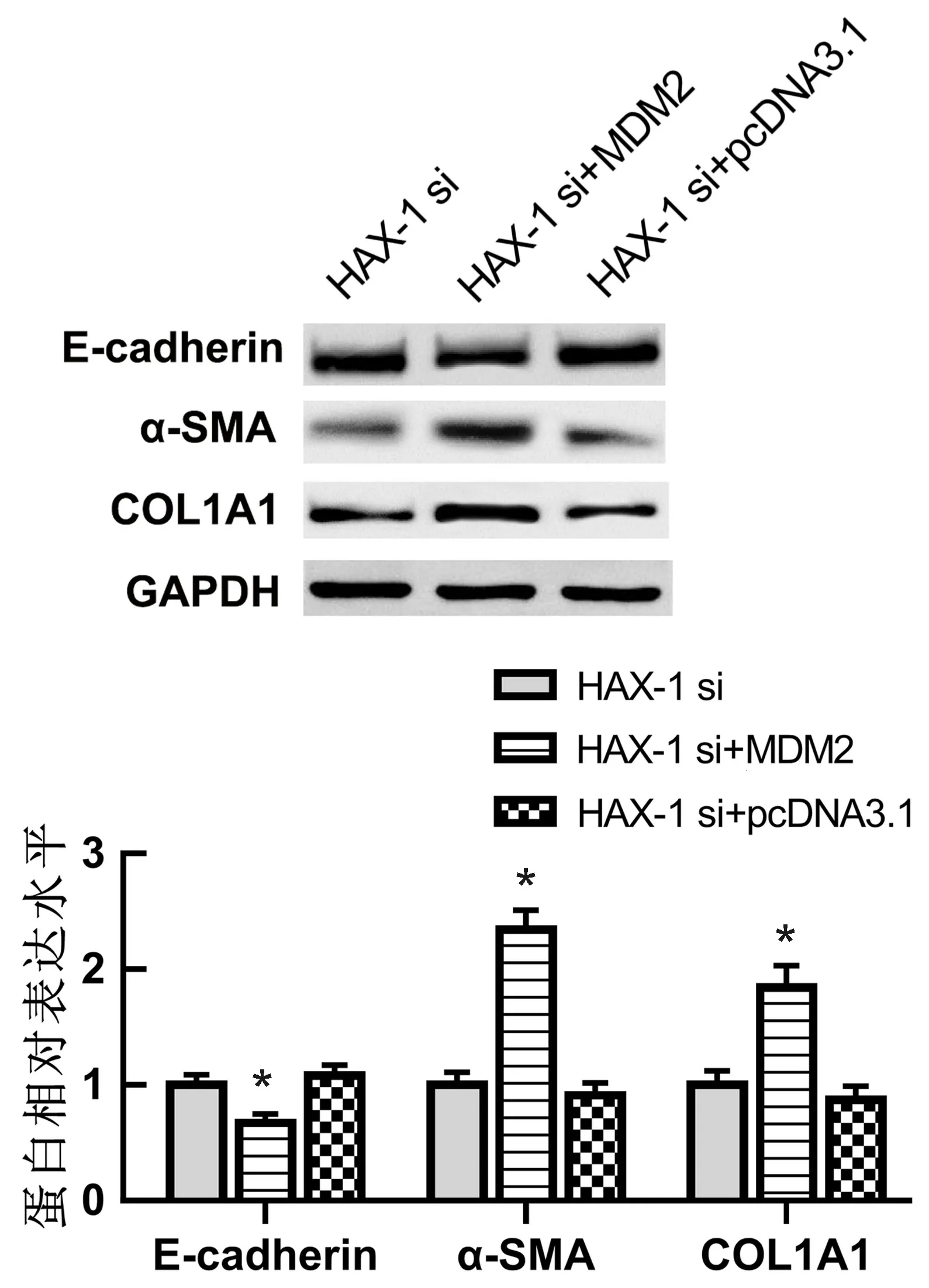
与HAX-1 si+pcDNA3.1组比较,*P<0.05。图6 MDM2过表达对TGF-β1诱导的A549细胞EMT的影响
2.5 HAX-1通过调节SMAD3磷酸化调控TGF-β1诱导的细胞纤维化为了进一步探究SMAD3在HAX-1调控TGF-β1诱导A549细胞纤维化中的作用,采用SIS3(1 μmol·L-1)处理HAX-1敲低且MDM2过表达的A549细胞30 min,再采用TGF-β1诱导48 h,结果显示,SIS3处理后细胞形态转变为鹅卵石形或多角形(图7);Western blot结果显示,与HAX-1 si+MDM2+DMSO组比较,HAX-1 si+MDM2+SIS3组细胞E-cadherin蛋白表达升高,p-SMAD3、α-SMA和COL1A1的蛋白表达下降(图8)。

图7 SIS3对TGF-β1诱导的细胞形态变化的影响(200×)

与HAX-1 si+MDM2+DMSO组比较,*P<0.05。图8 SIS3对TGF-β1诱导的A549细胞EMT的影响
3 讨论
EMT是肺纤维化发生的关键过程,主要表现为细胞黏附分子中的E-cadherin表达缺失,上皮细胞标志物下调,间质细胞标志物中的α-SMA表达上调,细胞极性消失,形成类似成纤维细胞的形态[18-19]。COL1A1的表达也是纤维化的标志[20]。A549细胞具有Ⅱ型肺泡上皮细胞的形态和特征,采用TGF-β1诱导A549细胞发生EMT是目前常用的构建肺纤维化细胞模型的方法[5-6]。
以往文献报道,HAX-1可以促进肝癌[14]、下咽鳞状细胞癌[21-22]的EMT过程,进而促进肿瘤细胞的恶性程度,并且肝癌中HAX-1水平越高,患者预后越差。本研究采用TGF-β1诱导A549细胞制备肺纤维化细胞模型,结果显示,TGF-β1诱导后HAX-1蛋白表达上调,而采用siRNA敲低HAX-1可以抑制TGF-β1诱导的A549细胞EMT过程。这说明HAX-1可以促进肺泡上皮细胞的EMT过程。
MDM2是细胞最主要的凋亡抑制蛋白之一,并且与肿瘤细胞EMT过程有密切关系[23]。文献报道显示,MDM2可以促进神经胶质瘤细胞[24]、卵巢癌细胞[25]等多种细胞的EMT过程,进而促进肿瘤耐药和转移。Deng等[13]研究表明,在胶质母细胞瘤细胞中,下调HAX-1可抑制MDM2表达。本研究结果也显示,HAX-1敲低抑制MDM2蛋白表达。TGF-β1/SMAD是EMT过程的经典通路[26]。有文献表明,MDM2通过激活SMAD信号通路促进肺腺癌细胞EMT进程[27]。因此,推测HAX-1可通过MDM2调节SMAD3活性,从而调控A549细胞EMT过程。本结果显示,HAX-1敲低可抑制MDM2蛋白表达和SMAD磷酸化水平,同时过表达MDM2可上调SMAD3磷酸化水平且促进EMT发生,说明MDM2过表达可有效抵消干扰HAX-1对p-SMAD3表达量和EMT过程的抑制作用。
由于时间和经费限制,本研究结论未能在动物体内进行验证,下一步将采用气道滴注博来霉素构建IPF小鼠模型[28],在动物体内研究HAX-1在IPF中的作用及机制。
综上,本研究证实,HAX-1在TGF-β1诱导的A549细胞中高表达,HAX-1敲低可通过MDM2/SMAD3通路抑制TGF-β1诱导的肺泡细胞纤维化过程,这为IPF的防治提供新的潜在靶标和理论基础。

