骨髓间充质干细胞来源外泌体通过ERK1/2信号通路调控子痫前期滋养层细胞侵袭和增殖相关机制研究
宋素香 徐 琳
子痫前期(preeclampsia,PE)是产科的常见病、多发病,属于妊娠期高血压疾病的一种,具有发病率高,预后差的特点[1-2]。多发生于孕周20周左右,表现为高血压,蛋白尿和水肿。其病理机制多于滋养层细胞的异常侵袭和增殖有关[3-4]。据流行病学调查研究发现,在全球范围内,子痫的发病率明显增加,可能与人们的生活习惯,自然和社会的环境变化有关[5-6]。但是,目前的治疗方案对于PE的治疗效果不佳,所以,亟需对其发病机制进行探索,从而为子痫的治疗提供新的靶点。有研究表明,骨髓间充质干细胞(BMSCs)与妊娠期疾病有一定相关性,比如妊高症等[7-8]。因此,本研究以BMSCs作为研究对象,以滋养层细胞系JEG-3细胞为种子细胞,提取其外泌体,观察其对JEG-3细胞学行为的影响。
外泌体(Exosome,Exo)是一类可以携带遗传信息的双层囊泡结构。外泌体多由细胞分泌,并且通过旁分泌的方式将遗传信息传递至旁系细胞中,进而起到信息交流的作用。尤其在肿瘤细胞中,外泌体的作用甚为重要,因为外泌体可以摆脱细胞之间的局限,进而影响临近细胞和组织的生物学行为,比如增殖等[9]。在本研究中,通过提取BMSCs来源的外泌体,与滋养层细胞系JEG-3细胞共培养,然后利用ERK1/2蛋白抑制剂AZD0364进行干预后,对BMSCs-Exo对滋养层细胞系JEG-3细胞生物学行为的影响,以及对其作用机制进行深入探讨。
1 材料与方法
1.1 实验细胞和实验动物
本研究以滋养层细胞系JEG-3细胞为种子细胞,惠赠于上海生物化学与细胞生物学研究所的杨力博士;采购20只SPF级SD大鼠,购自山东省青岛市黄岛区实验动物中心(SCXK(鲁)2019-2889)。月龄6~7个月,体重398~412 g。
1.2 BMSCs的培养和鉴定
根据文献中的实验方法[10],取成熟SD大鼠的后腿骨髓组织,然后应用差速培养法提取和培养骨髓间充质干细胞(BMSCs)以备用。采用流式细胞仪检测方法,检测BMSCs的表面蛋白CD29和CD44的表达。
1.3 BMSCs来源外泌体的提取和鉴定
1.3.1 外泌体的提取 本研究采用超速离心法进行收集细胞的外泌体。待细胞融合率达80%以上时,弃掉原有上清液,弃去培养基,PBS洗涤3次,加入2 mL的DMEM培养基,于温度37 ℃、CO2浓度5%的细胞培养箱中孵育48 h。收集培养液,于4 ℃条件下以300 r·min-1(离心半径5 cm)离心10 min;转移上清于离心管,于4 ℃条件下以2000 r·min-1(离心半径5 cm)离心20 min;取上清,经0.22 μm过滤器过滤后转移至离心管中,于4 ℃条件下以10 000 r·min-1(离心半径5 cm)离心70 min;取沉淀,用PBS洗涤1次,于4 ℃条件下以10 000 r·min-1(离心半径5 cm)离心70 min;小心弃去上清,即得到外泌体沉淀,于-80 ℃冰箱中保存备用。
1.3.2 透射电子显微镜法鉴定 在外泌体沉淀中加入100 μL PBS重新悬浮外泌体,并采用马尔文Nanosight纳米颗粒追踪分析仪分析外泌体粒径分布。
1.3.3 Western blot法鉴定 采用RIPA裂解液提取总蛋白。采用BCA蛋白浓度测定试剂盒测定蛋白浓度,电泳结束后,转膜封闭一抗(兔抗鼠CD63、CD9、CD81,浓度为1∶10000),4 ℃过夜孵育后加入辣根过氧化物酶标记的山羊抗鼠IgG二抗,室温避光孵育10 min,于凝胶成像分析系统显影并拍照。
1.4 滋养层细胞系JEG-3细胞摄取及内化外泌体
在外泌体沉淀中加入100 μL PBS重新悬浮外泌体后加入4 μL荧光探针PKH67溶液,于室温下孵育10 min;加入1 mL的10%BSA溶液进行固定,超速离心法外泌体。将JEG-3细胞接种于预先铺有盖玻片的24孔板中,每孔接种300 μL细胞液(细胞浓度约1.0×106个·mL-1),每组接种3个复孔。加入10 μL的鬼笔环肽,室温下避光孵育20 min,弃去染色剂,使用PBS洗涤3次,使用4%的多聚甲醛溶液固定30 min;PBS清洗后指甲油封片,于荧光显微镜下观察。
1.5 细胞分组
根据实验目的,将滋养层细胞系JEG-3细胞分成3组,其中实验组细胞加入BMSCs来源的外泌体,将提纯后的100 μg BMSCs-Exo 与PBS溶液混合后,加入到滋养层细胞系JEG-3细胞中;抑制剂组细胞加入外泌体后,再加入ERK1/2蛋白的抑制剂AZD0364,将AZD0364用PBS溶液稀释为0.25 mg/mL,将提纯后的100 μg BMSCs-Exo 与PBS溶液混合,联合0.5 mL的BIXO2188溶剂加入到滋养层细胞系JEG-3细胞中;对照组细胞加入等量的PBS溶液作为对照。
1.6 CCK-8试剂盒检测细胞的增殖
根据试剂盒要求,配置各个试剂,将实验组细胞,抑制剂组细胞和对照组细胞重悬后,接种于96孔板,按照说明书要求设置对比孔。然后加入CCK-8试剂盒中的检测试剂,37 ℃恒温避光孵育15 min,酶标仪测定各组细胞的吸光度(OD值)。
1.7 Transwell 试剂盒检测细胞侵袭
将实验组细胞,抑制剂组细胞和对照组细胞重悬后,收集各组细胞,按照Transwell 试剂盒的说明书要求,将各组细胞接种于Transwell侵袭上室,37 ℃恒温避光孵育2 h,然后更换无血清的培养基,Transwell下室加入含血清的培养基,37 ℃恒温避光孵育24 h,加入结晶紫试剂,常温避光孵育15 min,倒置光学显微镜观察下室细胞数,则为细胞侵袭数量。
1.8 荧光定量聚合酶链反应(RT-PCR)检测ERK1/2和核因子NF-κB的表达
将实验组细胞,抑制剂组细胞和对照组细胞重悬后,收集各组细胞,应用 Trizol 法提取上述3组细胞中的总RNA,然后用逆转录试剂盒将总RNA逆转为cDNA,其目的是可以方便保存,防止降解。采用荧光定量PCR试剂盒分析上述各组细胞中的DNA样本,Tm值设置为53.7 ℃,采用2-△△CT法进行分析。引物设计由上海生工公司设计并检测合格(表1)。

表1 ERK1/2和核因子NF-κB的引物序列
1.9 Western-blot检测ERK1/2和NF-κB的蛋白表达
方法同1.3.3,抗体选择兔抗鼠ERK1/2和NF-κB一抗。
1.10 数据统计方法
2 结果
2.1 BMSCs的培养和鉴定
结果显示,原代BMSCs呈多角形,贴壁生长(图1 A)。P2代BMSCs细胞成长梭形(图1 B);流式细胞仪检测细胞表明CD29蛋白表达为99.5%,CD44蛋白表达为100%(图1 C-D),见图1。
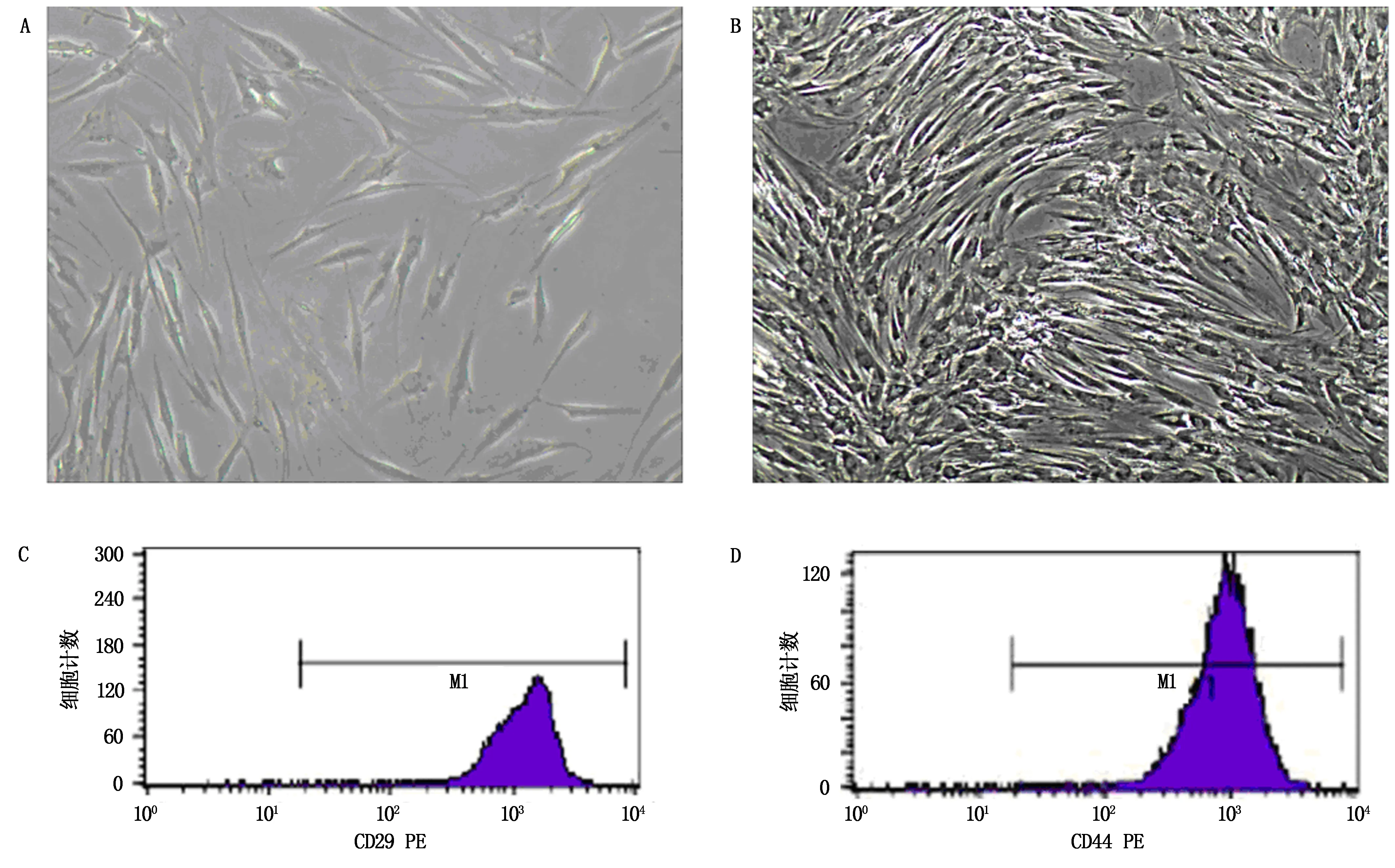
A为原代BMSCs;B为P2代BMSCs;C-D为BMSCs细胞表面CD29和CD44表达。图1 骨髓间充质干细胞的培养和鉴定
2.2 BMSCs来源外泌体的鉴定结果
透射电子显微镜结果显示,外泌体为杯口状结构,外泌体直径150~180 nm。Western Blot可以检测到外泌体的分子标志物CD63、CD9和CD81的表达。见图2。
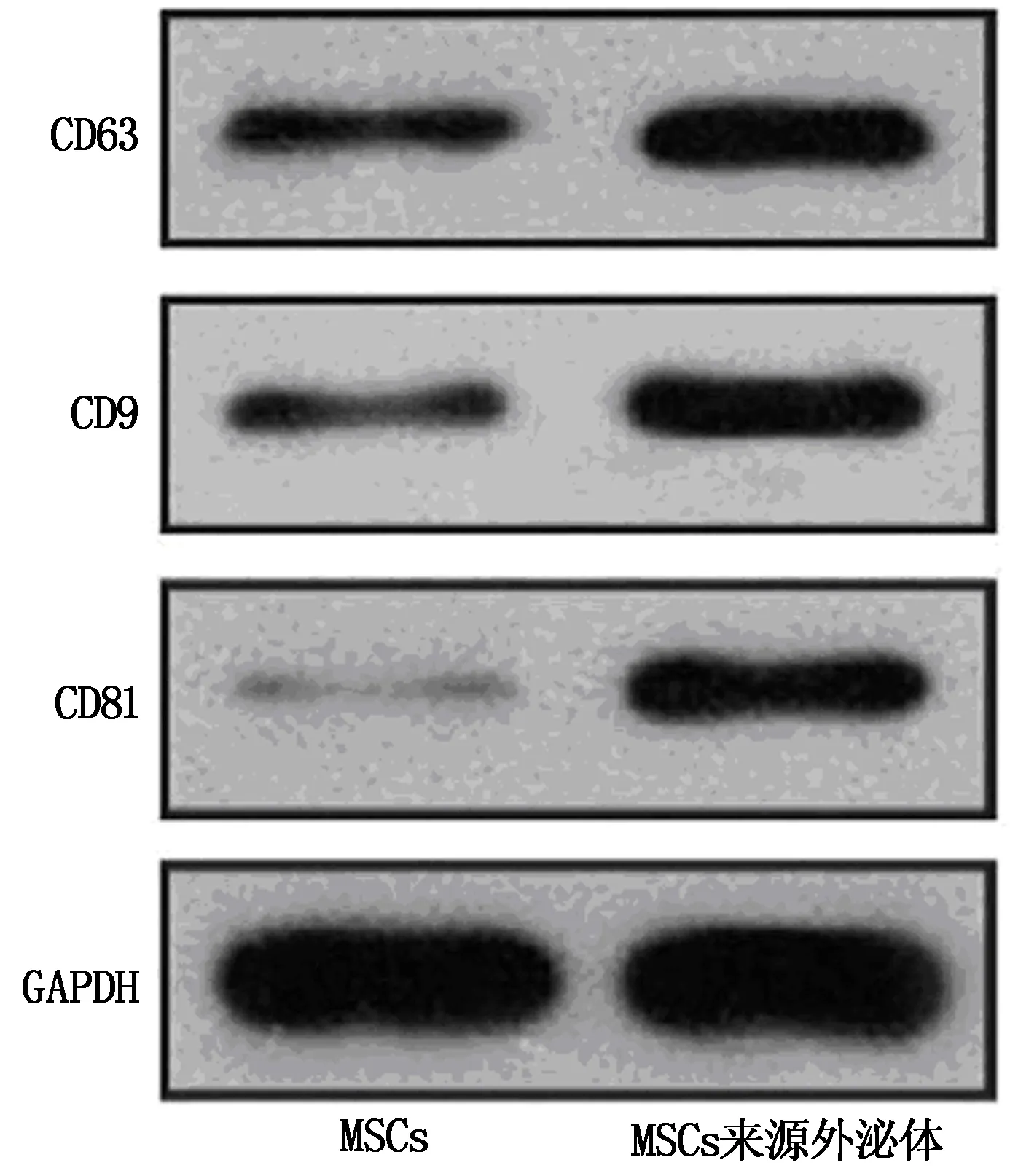
图2 Western Blot检测结果
2.3 滋养层细胞系JEG-3细胞摄取及内化PKH67标记的外泌体
结果显示,外泌体与JEG-3细胞共培养的过程中,可见JEG-3细胞可以摄取并内化PKH67标记的外泌体。
2.4 细胞增殖结果
应用CCK-8试剂盒检测外泌体和肿瘤细胞共培养后对细胞增殖水平的作用,结果显示,实验组细胞增殖率明显高于对照组,而抑制剂组细胞的增殖率明显低于实验组(P<0.05)。见图3。

图3 细胞增殖结果
2.5 细胞侵袭能力结果
结果显示,实验组细胞的侵袭能力明显强于对照组(P<0.05),抑制剂组细胞的侵袭能力明显弱于实验组(P<0.05)。见图4。
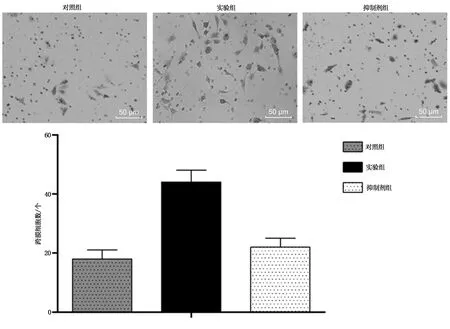
图4 细胞侵袭能力结果
2.6 RT-PCR检测ERK1/2和核因子NF-κB的mRNA的相对表达结果
结果显示,实验组ERK1/2和NF-κB mRNA相对表达量明显高于对照组(F=9.897,11.906;P=2.785,2.192;P=0.021,0.014<0.05),抑制剂组ERK1/2和NF-κB mRNA相对表达量明显低于实验组(P=2.437,3.908;P=0.013,0.009<0.05),见图5。
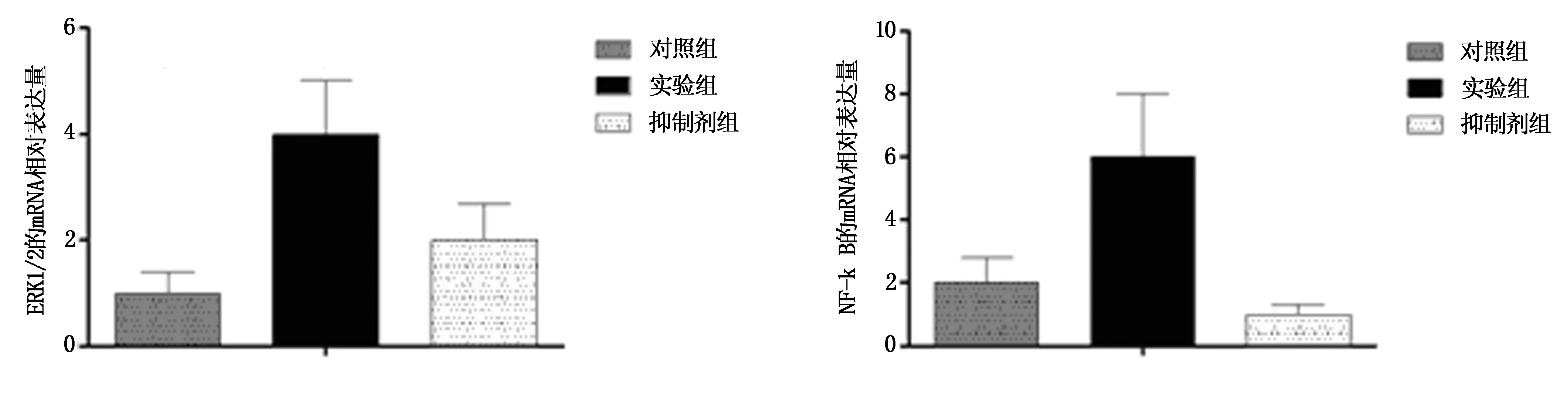
图5 RT-PCR检测ERK1/2和核因子NF-κB的mRNA的相对表达结果
2.7 Western blot检测ERK1/2和核因子NF-κB的蛋白表达结果
结果显示,对照组、实验组与抑制剂组的ERK1/2 蛋白表达量比较具有统计学差异(F=9.887,P<0.05),其中实验组ERK1/2 蛋白表达量明显高于对照组(P=2.012,P<0.05),抑制剂组ERK1/2 蛋白表达量明显低于实验组(P=2.003,P<0.05)。
对照组、实验组和抑制剂组的NF-κB蛋白表达量比较具有统计学差异(F=9.761,P<0.05),其中实验组NF-κB 蛋白表达量明显高于对照组(P=2.4154,P<0.05),抑制剂组NF-κB 蛋白表达量明显低于实验组(P=2.007,P<0.05),见图6。
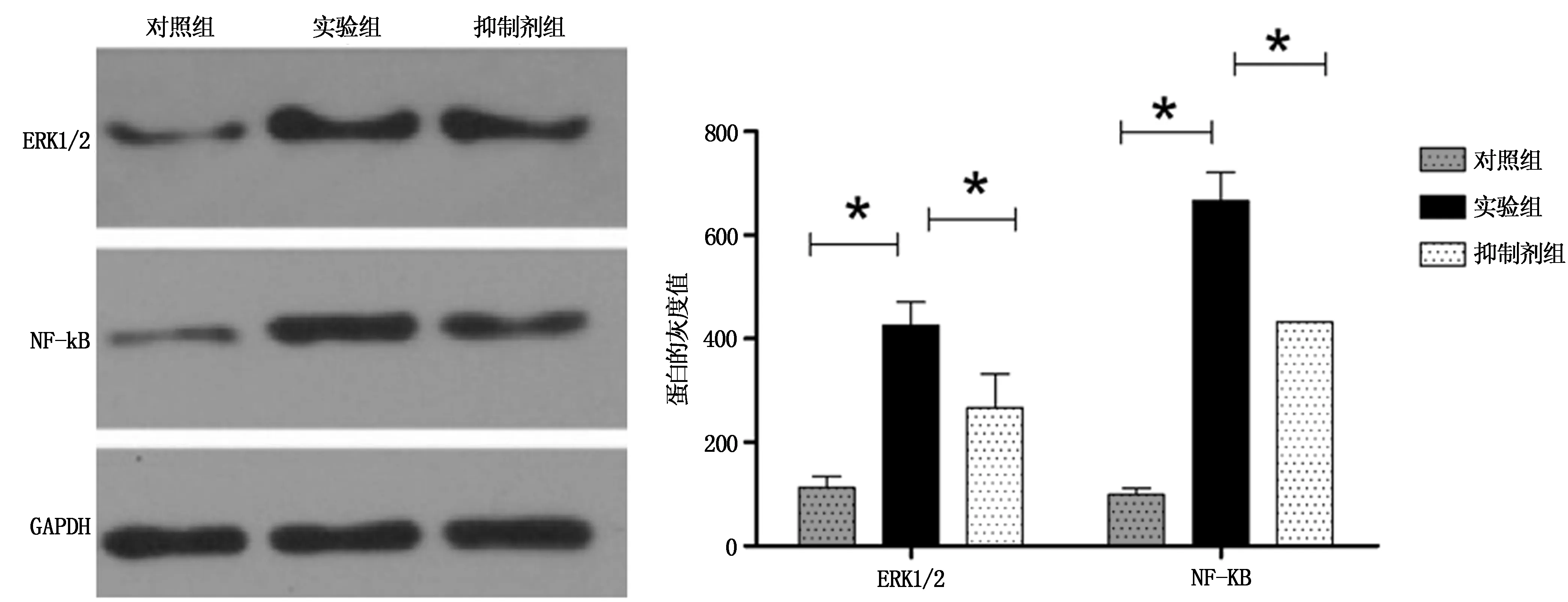
图6 Western blot检测ERK1/2和核因子NF-κB的蛋白表达结果
3 讨论
子痫前期与多种因素密切相关,比如胎盘的过度炎症反应和滋养层细胞的异常增殖和侵袭等[11]。除了特异基因外,也有研究表明,骨髓间充质干细胞可以在一定程度上影响子痫前期患者滋养层细胞的侵袭与增殖,但是具体的机制尚未完全明了[12]。本研究通过提取骨髓间充质干细胞的外泌体,观察其对子痫前期患者滋养层细胞的侵袭与增殖能力的影响,以及通过ERK1/2/MAPK信号通路对其具体的作用机制进行深入研究,以期为临床上子痫前期患者的治疗提供新的思路和方法。
外泌体是目前研究的热点问题,可以携带相关的遗传信息,从而影响细胞的生化性质,比如增殖,凋亡和侵袭等[13-14]。本研究通过提取BMSCs来源的外泌体,并且通过外泌体与JEG-3细胞共培养的过程中,可见JEG-3细胞可以摄取并内化PKH67标记的外泌体。说明,JEG-3细胞可以内吞外泌体,从而发挥作用。另外我们通过CCK-8试剂盒和Transwell 试剂盒检测BMSCs来源外泌体对JEG-3细胞增殖和侵袭能力的影响,结果表明,外泌体与JEG-3细胞共培养后可以促进细胞的增殖能力和侵袭能力,明显高于对照组,结果说明,BMSCs来源的外泌体可以促进JEG-3细胞的增殖,促进细胞的侵袭。
MAPK/ERK1/2信号通路是与细胞增殖密切相关的信号通路之一,ERK1/2信号通路与结肠癌细胞,肝癌细胞等增殖凋亡关系密切[15-16]。本研究也以ERK1/2为研究切入点,对BMSCs来源的外泌体促进JEG-3细胞增殖和侵袭进行机制研究,利用RT-PCR和Western blot检测外泌体和ERK1/2抑制剂AZD0364处理后,细胞共培养体系中ERK1/2 和核因子NF-κB的mRNA和蛋白的表达量,结果表明,BMSCs来源外泌体与JEG-3细胞共培养后,可以促进ERK1/2和NF-κB的表达量,而经过ERK1/2抑制剂AZD0364处理后,ERK1/2和NF-κB的表达量明显降低。而且,CCK-8和Transwell检测结果中,经过AZD0364处理后,明显可以抑制JEG-3细胞的增殖和侵袭水平。结果表明,ERK1/2信号通路可能是调控BMSCs来源外泌体促进JEG-3细胞增殖和侵袭的信号通路之一。
然而,本研究也有缺点。比如除了ERK1/2信号通路之外,是否存在其他的信号通路存在,是否有网状信号通路可以参与调控外泌体对滋养层细胞的生物学行为的影响,这也是本研究后续的研究方向。

