高氧水和戊己丸对幽门螺杆菌的抑菌作用研究*
施 敏,刘富林,张叔琦,许文娟,夏旭婷,张 婷,李镕伟
(湖南中医药大学,湖南 长沙 410208)
幽门螺旋菌(Helicobacter pylori,Hp)是一种微需氧细菌,主要形态为螺旋弯曲,多定植在人体胃黏膜上皮表面和黏液底层[1]。因高感染率、高危害性,Hp广受临床工作者及科研工作者的关注。Hp在全球均具有高感染率[2],我国Hp的感染率为41.35%~72.30%[3]。Hp有较强致病性,与慢性胃炎、消化性溃疡等一系列消化系统疾患的发生密切相关[4]。研究发现Hp与神经系统疾病、癌症、糖尿病等疾病也有一定相关性[5-7]。目前西医治疗Hp感染存在耐药性强、副作用明显、患者依从性差等问题[8],而中医药辨证治疗Hp感染具有安全有效、可提高根除率等优势[9-10]。
高氧水是将无菌饮用水进行光化学容氧所得。高氧水的氧分压从21kPa升高至100~120kPa,氧含量从4.6%提高至14.6%,且常温常压下氧气不易逸出[11]。基于高氧环境对微需氧菌和厌氧菌的抑制作用,有学者提出高氧水或许可替代抗生素,开辟厌氧/微需氧菌感染治疗新途径的猜想[12]。车蕾等[13]将高氧水运用于厌氧菌的抑制研究,结果显示高氧水对异链球菌、中间普氏菌、黏性放线菌3种厌氧菌均具有抑菌作用。由此推测,高氧水对Hp亦应具有抑菌作用。
戊己丸由黄连、吴茱萸和白芍组成,临床研究发现超微戊己丸对Hp清除率为66.7%[14]。唐小梅等[15]运用戊己丸水煎液对Hp进行体外抑菌研究,结果显示戊己丸对Hp具有抑制作用。戊己丸能显著调节Hp感染胃炎小鼠胃内微生物及酶活性.[16]。《古今录验养生必用方》的戊己丸是黄连、吴茱萸、白芍按照1∶1∶1的质量配比[17]。2020年版《中华人民共和国药典》所载戊己丸中黄连、吴茱萸、白芍的药物质量配比为6∶1∶6[18]。
本研究基于高氧水可破坏Hp的生存环境和戊己丸能抑制Hp生长的理论,运用体外抑菌实验论证高氧水抑制Hp的可行性,并比较古方戊己丸和药典戊己丸在抑制Hp方面的优劣,再选用效果更好的戊己丸以检验高氧水和戊己丸对Hp的抑制作用,旨在探索更安全、有效、廉价的治疗Hp感染的手段。
1 材料
1.1 菌株、药物 (1)细菌:H.pylori(批号:ATCC43504)购自广东省微生物菌种保藏中心(GDMCC)。(2)药物:黄连超微颗粒40 g(批号:20010)、吴茱萸超微颗粒15 g(批号:200779)、白芍超微颗粒40 g(批号:191014)均购自湖南春光九汇现代中药有限公司,经湖南中医药大学张裕民主任药师鉴定合格。阿莫西林钠克拉维酸钾粉针剂(0.6 g/剂,批号:H10910017)购自华北制药有限公司。
1.2 试剂 胎牛血清(批号:10270106)、1640细胞培养基(批号:C1187500BT)均购自gibco公司;布氏琼脂培养基(批号:HB0315)购自青岛海博生物技术有限公司;无菌脱纤维绵羊血(批号:BJLY10031)购自南京便诊生物科技有限公司;高氧水由浙江氧典饮品有限公司提供,生产许可证号:SC10633102401450。
1.3 主要仪器 MIS型高温高压灭菌锅(施都凯仪器设备有限公司);GNP-9270型恒温恒湿培养箱(上海三发科学仪器有限公司);TG16-WS型离心机(湖南湘仪实验仪器开发有限公司);DK-98-IIA型水浴锅(天津泰斯特仪器有限公司)。
2 方法
2.1 各试剂对Hp的抑菌活性测定及比较
2.1.1 药物制备 (1)古方戊己丸:取黄连、吴茱萸、白芍超微颗粒剂各10 g分别置于试管中加蒸馏水30 mL搅拌使之充分溶解,4 ℃,4 000 r/min离心10 min(离心半径为8 cm)吸取上清液,混合置于1个大试管再按上述条件离心10 min,吸取离心后的上清液得到戊己丸药液。(2)药典戊己丸:取黄连30 g、吴茱萸5 g、白芍30 g超微颗粒剂,制备方法同古方戊己丸。(3)高氧戊己汤:于无菌环境下吸取制备好的古方戊己丸药液5 mL,再吸取5 mL高氧水置于无菌试管中,得到10 mL高氧戊己汤。(4)抗生素药液制备:吸取蒸馏水5 mL注入阿莫西林钠克拉维酸钾粉针剂瓶中,摇晃瓶身使之溶解,加入10 mL生理盐水稀释至每1 mL药液含有阿莫西林10 μg的试剂。
2.1.2 布氏琼脂培养皿制备 称取布氏琼脂培养基粉8.62 g置于椎型瓶中加入200 mL蒸馏水,加热搅拌溶解后于120 ℃高压灭菌15 min。取一个90 mL玻璃平皿,倒入约20 mL蒸馏,标记液面水平。比照已经标记好的平皿,将加入无菌脱纤维绵羊血的布氏液体琼脂倒入90 mL平皿,高度与标记线平齐。待制备好的布氏琼脂培养皿琼脂凝固后,密封放入恒温恒湿培养箱中鉴定培养24 h,无杂菌生长则为可用。
2.1.3 菌株成活及分裂培养 抽取菌株液0.5 mL注入于含有1640细胞培养基和灭活后胎牛血清的无菌真空采血管中,使试管内形成微需氧环境,封口并贴标签。置于微需氧密封箱中,放入微需氧产气袋后将微需氧密封箱加盖密封,放入37 ℃的恒温恒湿培养箱48 h。采血管内液体颜色变淡,采血管底部灰白色沉淀产生,且采血管内液体变浑浊提示菌株成活。
2.1.4 Hp菌液的制备 将复活菌株的采血管放入离心机中,4 ℃,4 000 r/min离心10 min(离心半径为8 cm),使Hp菌落置底,于无菌环境下吸取采血管底部含有Hp菌落的液体加入1640细胞培养基,再用0.5麦氏比浊管进行比浊,使菌液浓度达到1.5×108个/mL。
2.1.5 抑菌圈实验 (1)取灭菌后直径为6 mm的圆形纸片,分别于戊己丸药液、生理盐水、抗生素药液中浸湿后,于37 ℃恒温恒湿培养箱中4 h制备成含相应试剂的干燥药敏纸片,高氧水纸片选择含高氧水湿纸片。(2)将制备好的布氏琼脂培养皿均匀分为A、B、C、D、E区,分别代表古方戊己丸、药典戊己丸、高氧水、生理盐水和抗生素药液。(3)将Hp菌液0.1 mL均匀涂布在布氏琼脂培养皿上,取制备好的药敏纸片平贴于布氏琼脂培养皿对应的位置。(4)将贴好药敏纸片的布氏琼脂培养皿置于微需氧密封箱中,放入微需氧产气袋后将微需氧密封箱加盖密封,放入37 ℃恒温恒湿培养箱培养48 h后取出布氏琼脂培养皿,观察抑菌圈并用游标卡尺测量抑菌圈直径。
2.2 各试剂对Hp的MIC及MBC测定 通过“2.1.5”中抑菌圈实验结果选取抑菌效果更好的戊己丸,进行对Hp的MIC及MBC测定。(1)取6×8的48孔一次性无菌细胞培养板,各行由上到下依次标注为A、B、C、D,其中A、B、C分别代表戊己丸组、高氧戊己汤组、高氧水组;D行无指代,作为对照用。将每一列从左到右依此标注为“1”“2”“3”“4”“5”“6”“7”“8”。(见图1)

图1 细胞培养板
(2)向无菌48孔细胞培养板前3行和D1、D2各孔注入100 μL 1640细胞培养基。
(3)抽吸制备好的每1 mL含药1 000 mg的戊己丸药液,注入A1~A8孔中,使A1、A2、A3、A4、A5、A6、A7、A8各孔含戊己丸药液质量浓度应依次为500.000 00、250.000 00、125.000 00、62.500 00、31.250 00、15.625 00、7.812 50、3.906 25 mg/mL。同样方法在B行各孔中注入稀释高氧戊己汤,在C行各孔中注入稀释的高氧水。
(4)D3孔中注入100 μL每1 mL含药1 000 mg的戊己丸药液,D4孔中注入100 μL每1 mL含药1 000 mg的高氧戊己汤药液,D5孔中注入100 μL每1 mL含药1 000 mg的高氧水。
(5)分别向细胞培养板前3行和D1、D2各孔注入10 μL胎牛血清和10 μL制备好的菌液。
(6)将48孔细胞培养板用封口膜封口,置于微需氧密封箱中,将微需氧密封箱放入37 ℃恒温恒湿培养箱培养48 h。
(7)微需氧环境恒温恒湿培养48 h后将48孔细胞培养板取出,于灯下肉眼观察,无菌落生成、无试剂变色或变浑浊者为该药的MIC。
(8)运用点试法测定各药对Hp的MBC,于无菌环境下取制备好的90 mL含无菌脱纤维绵羊血的布氏琼脂培养皿3个,将每个平均分为12个扇形区域,并用马克笔依次标记为A1、A2、A3······D5。(见图2)

图2 琼脂培养皿
(9)将48孔细胞培养板各孔接种到划分好的90 mL含无菌脱纤维绵羊血布氏琼脂培养皿对应的区域上,接种完毕后,置于微需氧密封箱中,放入37 ℃恒温恒湿培养箱培养48 h,取出观察各区域是否有菌落生长,其中完全无菌落生长的最小浓度即为该药的MBC。
2.3 统计学方法 采用SPSS 25.0软件处理。计量资料以“均数±标准差”(±s)表示,满足正态性和方差齐性的计量资料采用多样本单因素方差分析,各组间两两比较使用LSD法;不符合正态性者采用非参数检验。P<0.05为差异有统计学意义。
3 结果
3.1 抑菌圈实验(纸片琼脂扩散法)结果 高氧水、古方戊己丸、药典戊己丸、抗生素的抑菌圈直径均大于生理盐水(P<0.05或P<0.01),且古方戊己丸的抑菌圈直径大于药典戊己丸(P<0.01)。(见表1、图3)
表1 各药物抑菌圈直径比较 (±s,mm)
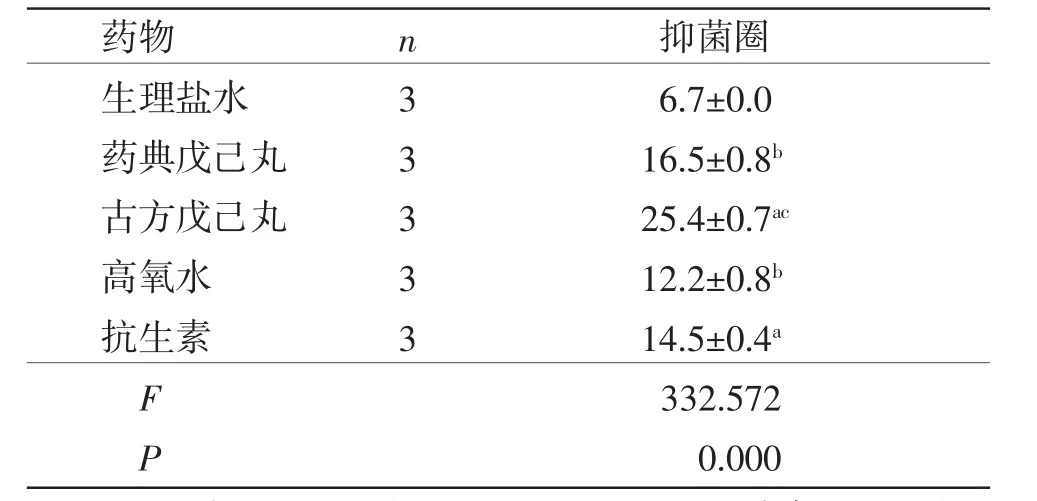
表1 各药物抑菌圈直径比较 (±s,mm)
注:与生理盐水比较,aP<0.01,bP<0.05;与典戊己丸比较,cP<0.01。
药物n抑菌圈生理盐水36.7±0.0药典戊己丸316.5±0.8b古方戊己丸325.4±0.7ac高氧水312.2±0.8b抗生素314.5±0.4a F 332.572 P 0.000

图3 纸片琼脂扩散法测定各试剂的抑菌圈
3.2 各药物对Hp的MIC及MBC测定 灯下肉眼观测各培养孔细菌的生长情况,A组和B组未见菌落生长的最后一个菌孔均为5号孔;C组未见菌落生长的最后一个菌孔为4号孔;D组为对照组,除2号孔外,其余菌孔均未见菌落生长。(见表2)

表2 肉眼观测各孔Hp的生长情况
运用点试法测定各培养孔细菌的存活性,A组和B组试剂未见菌落生长的最后一个菌孔均为4号孔;C组未见菌落生长的最后一个菌孔为2号孔;D组为对照组,除2号孔外,其余菌孔均未见菌落生长。(见表3)
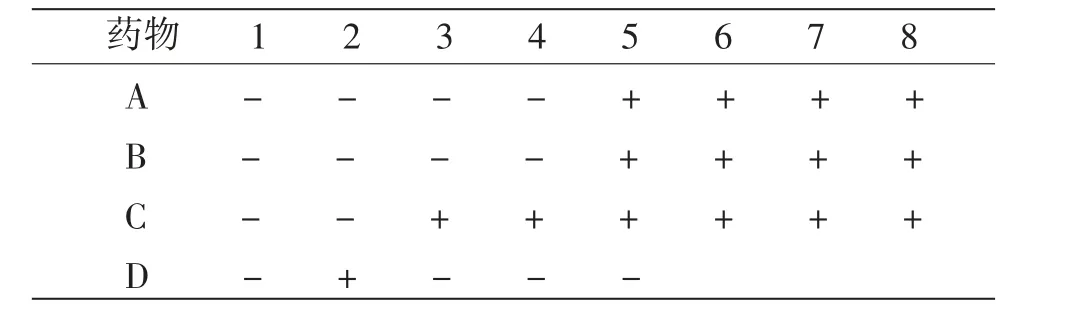
表3 点试法测定各孔Hp的生长情况
对照组2发现菌落生长,对照组1、3、4、5未发现菌落成长。(见表4)

表4 各对照组Hp菌落的生长情况及意义
古方戊己丸对Hp的MIC为31.25 mg/mL,MBC为62.50 mg/mL;高氧水对Hp的MIC为62.50 mg/mL,MBC为250.00 mg/mL;高氧戊己汤MIC对Hp的为31.25 mg/mL,MBC为62.50 mg/mL。(见表5)

表5 各药物组对Hp的MIC、MBC (mg/mL)
4 讨论
Hp感染具有高感染率、高致病性特点,根除Hp已成为胃炎、消化性溃疡、胃癌、消化不良等患病人群的首要治疗方案。但抗Hp的临床实践存在Hp高耐药性和彻底根除的矛盾性的问题。随着Hp抑菌药物的使用,关于Hp耐药性的报道逐年增多。以克拉霉素为例,其在日本和意大利的耐药比率高达30%,中国为50%,土耳其为40%,且其他抗生素也显示出相似的趋势[19-23]。临床工作中,根除Hp存在矛盾和争议。如肝肾功能不全或者对抗生素广泛过敏的Hp感染者如何彻底根除Hp?此外,依从性较差的患者难以规范使用四联疗法,或者反复根除Hp后再感染,已经形成明显耐药的Hp感染者,是否继续使用四联疗法根除Hp?因此,开发出一种更安全有效的方法防治Hp感染已迫在眉睫。针对这一现实需求,本研究团队结合中医药特色,进行了积极探索。
Hp感染在中医学中没有相对应的病名,历代医家根据其临床症状将其归为“胃脘痛”“反酸”“嘈杂”“痞满”等范畴。中医证候主要以脾胃湿热、肝胃不和及脾胃虚弱为主[24]。治疗主要以清热利湿、疏肝理气、活血化瘀、清热解毒、和胃止痛、健脾和胃、辛开苦降等立法[25]。《古今录验养生必用方》[26]记载戊己丸由黄连、吴茱萸、白芍按照1∶1∶1的质量配比。方中黄连为君药,清肝胃之热;白芍为臣药,和里止痛;吴茱萸为佐药,其辛助开郁,其热制黄连之苦寒。全方辛开苦降,肝胃同治,用以治疗肝火犯胃、肝胃不和所致的胃脘灼热疼痛、口苦嘈杂、呕吐吞酸、腹痛泄泻。
本研究的抑菌圈实验发现《古今录验养生必用方》记载的戊己丸抑菌效果优于药典戊己丸,原因可能是古方戊己丸中黄连和吴茱萸以1∶1质量配伍,平调寒热,适用证型广,而药典戊己丸中黄连和吴茱萸以6∶1质量配伍,方性寒重于温,适用证型较为局限。
本研究通过抑菌圈实验和各药物对Hp的MIC及MBC测定发现高氧水对Hp有一定的抑菌活性,其作用机理可能与高氧水可以破坏Hp的微需氧生存环境有关。高氧水是食品级商品,对人体的毒副作用相对较小,暂未发现有关于高氧水的过敏和不良反应报道。因此,本研究论证的高氧水可抑制Hp假说具有临床意义,使不服用药物即可杀灭Hp成为可能,同时为肝肾功能不全的Hp患者、对抗生素过敏的Hp患者、不能耐受四联疗法的Hp患者、未见临床症状的Hp感染者提供了安全可行的抗Hp手段。戊己丸水煎液对Hp也有抑杀作用,这与诸多学者的[14-16]研究结果一致,
实验结果显示高氧戊己汤对Hp的抑菌作用未明显优于戊己丸单独使用,分析原因如下。其一,中药在人体中对Hp的抑制作用有两种方式:与Hp直接接触抑杀细菌以及通过介导人体的免疫细胞抑杀细菌。本研究为体外抑菌,未在活体中进行,故无法介导人体的免疫细胞,故未形成协同抑菌的结果。其二,高氧水与戊己丸1∶1质量配比时,中药药液稀释了高氧水,使高氧戊己汤每毫升含氧量不足以破坏Hp的生存环境,故高氧戊己汤对Hp的抑杀作用主要依靠药液中的中药成分。
后续研究将考虑中药汤剂与高氧水配比,设置不同浓度中药与高氧水配比的比较研究,寻找最强的抑菌配比,以此为后续的动物实验及临床研究提供基础数据。
综上所述,戊己丸和高氧水对Hp均有抑制作用,为中医药临床防治Hp感染提供了防治思路和实验依据。

