汉黄芩素对气虚模型LLC种植瘤小鼠的抗肿瘤作用及淋巴细胞亚群的影响*
毛跃程,邢代君,刘心宁,蔡厚昊,黄国栋,曲泓霖,郑 心
(1.山东中医药大学中医学院,山东 济南 250355;2.青岛市中医医院,山东 青岛 266033)
肺癌是一种临床常见的恶性肿瘤,主要发病于肺部支气管黏膜或腺体,是全球范围内发病率及死亡率最高的恶性肿瘤之一[1]。我国肺癌发病率及死亡率居高不下。现代研究[2]证实,肿瘤发生、发展与肿瘤宿主免疫状况密切相关,细胞免疫在机体抗肿瘤免疫中起主导作用,而淋巴细胞是人体内主要细胞免疫系统。外周血淋巴细胞(Peripheral blood lymphocyte)主要位于血液循环,该淋巴细胞由T细胞和B细胞组成[3-4]。在机体免疫细胞中,T淋巴细胞是数目最多、最重要的功能细胞,其细胞亚群主要包括CD4+和CD8+T淋巴细胞,这些T淋巴细胞亚群在人体内的比例直接影响免疫功能[5-6]。CD8+T杀伤性淋巴细胞与癌症患者生存期[7]及对治疗反应密切相关[8]。CD4+辅助性T细胞高表达与一些高复发转移风险预测指标更为相关[9];调节性T细胞(Treg)为CD4+T淋巴细胞亚群,其动态平衡在维持机体免疫防御、免疫监视方面发挥重要作用[10-11]。自然杀伤细胞(natural killer cell,NK)与B细胞同样可杀伤肿瘤,在机体的抗肿瘤免疫反应中同样具有重要作用[12-13]。
汉黄芩素(Wogonin)来源广泛,在黄芩、半枝莲等多种中药材中均有分布,属于黄酮类化合物,具有抗炎、抗肿瘤等药理作用[14]。研究表明,汉黄芩素能促进人肺癌细胞A549[15]、肝癌细胞HepG2[16]和乳腺癌mcf-7[17]等凋亡,但尚不清楚其是否能通过干预免疫细胞发挥抗肿瘤作用。针对上述问题,本研究采用中医学传统病因和现代医学病因病理造模方法,模拟肺癌患者常见气虚体质,用烟熏结合种植瘤方法建立肺癌气虚证病证结合小鼠模型[18],观察汉黄芩素的抗肿瘤作用,并探讨其作用机制是否与调控各淋巴细胞亚群相关。
1 材料与方法
1.1 实验动物与细胞 SPF级健康雄性C57BL/6小鼠(N型)40只,4~6周龄,体质量16~18 g,购自北京维通利华实验动物技术有限公司,动物生产许可证号:SCXK(京)2021-0006;小鼠饲养环境温度(25±2)℃,湿度(50±10)%。本研究中所有使用的实验方案均得到了青岛市中医医院(市海慈医院)医学伦理委员会的批准,批准号:2021HC12LZ036。
LLC小鼠肺癌细胞株,购自大连美仑生物技术有限公司公司。
1.2 药物与试剂 汉黄芩素(批号:22012106)购自成都普菲德生物技术有限公司;DMEM高糖培养基(批号:MA0212-Mar-18H)、胎牛血清(批号:F0223B)、0.25%胰酶-EDTA(批号:MA0232-Apr-11H)、双抗-青链霉素(批号:MA0110)、细胞冻存液(批号:MA0401)、PBS缓冲液(批号:MA0015-Sep-10G2)均购自大连美仑生物技术有限公司;流式破膜固定液(批号:B360640)、APC780 anti-mouse CD3e 抗体(批号:B349356)、APC anti-mouse Foxp3抗体(批号:B13358685)、APC anti-mouse CD49b抗体(批号:B336797)均购自BIOLEGEND(北京)生物科技有限公司;FITC anti-mouse CD8抗体(批号:2287200)、PE anti -mouse CD25 抗体(批号:2293919)、PE anti-mouse CD19抗体(批号:2376142)均购自赛默飞世尔科技公司;PE-Cy7 anti-mouse CD4抗体(批号:A20334)购自杭州联科生物技术股份有限公司;红细胞裂解液(批号:20220105)购自北京索莱宝科技有限公司;红细胞裂解液(批号:5211106212)购自上海美天旎生物技术贸易有限公司;巴比妥钠(批号:57-34-2)购自美国SIGMA公司;泰山(华贵)香烟购自中国烟草公司;苏木精-伊红染色试剂盒(批号:abs9217)、中性树胶(批号:abs9177)均购自上海爱必信生物科技有限公司。
1.3 主要仪器 Celmate型细胞培养箱(新加坡ESCO公司);BX61型光学显微镜(日本Olympus公司);CytoFLEX型流式细胞仪(Beckman Coulter公司);EG1150C型组织包埋机、RM2235型组织切片机、ST5010型全自动组织切片染色机(德国Leica公司);BTH-I型摊烘片一体机(山东欧莱博公司);Sigma1-14型高速冷冻离心机(德国sigma公司)。
1.4 造模与分组
1.4.1 LLC小鼠肺癌细胞培养 LLC小鼠肺癌细胞培养于含10%胎牛血清、1%双抗-青链霉素的DMEM高糖培养基中,置于37 ℃、5%CO2细胞培养箱中培养。细胞生长到90%以上时进行传代培养。
1.4.2 气虚型LLC种植瘤小鼠模型的制备与分组 用烟熏法建立小鼠气虚模型[18],每天10∶00∶00将小鼠放于300 L烟箱内用香烟熏0.5 h(每天暴露2根香烟,每支香烟约燃烟10 min,在每一轮接触香烟的间隔时间内,让小鼠休息10 min,以防止二氧化碳引起的窒息),1次/d,连续21 d。在小鼠的常见证候辨证标准[19]中,迟证包括心率缓/迟;食量、饮水量减少;吻、躯体移动减弱。虚证包括老年、发育不良;食量减少、体质量减轻、去瘤体质量减轻、消瘦、羸瘦;吻、躯体移动减弱;精神萎靡、反应迟钝、倦怠、朦胧欲睡、嗜卧;步态不稳、活动减少、行动呆滞;呼吸微弱、蜷缩、扎堆、拱背;毛蓬松、竖立、无光泽、枯黄、稀少;眼裂变窄/眼眯/闭目、眼中无神、瞳孔对光反应减弱;肌力减弱;肛门脱垂;垂尾;爪舒展差、蜷缩、伸展无力、白嫩;尾、爪污物附着。迟证、虚证>1项即可辨证为小鼠气虚证。无菌条件下,取对数生长的LLC小鼠肺癌细胞,以1×107个/mL重悬于不含血清的DMEM高糖培养基中。将细胞接种于烟熏后气虚模型小鼠右侧腋窝皮下,每只接种约2×106个LLC细胞。造模6 d后进行成瘤评价,于小鼠右侧腋下触及小米大小皮下结节,质硬,活动度一般,边界清楚,即为造模成功。共有30只小鼠进行造模,造模成功25只。选择造模成功小鼠24只,按随机数字表法分为汉黄芩素高剂量组、汉黄芩素中剂量组、汉黄芩素低剂量组、气虚荷瘤组,每组6只。另取6只正常小鼠作为正常组。
1.5 实验给药 汉黄芩素低、中、高剂量组小鼠分别按25、50、100 mg/kg剂量灌胃给予汉黄芩素混悬液(5 mL/kg),正常组、气虚荷瘤组小鼠灌胃给予等体积生理盐水,1次/d,连续给药15d。
1.6 观察指标
1.6.1 气虚证小鼠行为状态表现 烟熏结束后,根据小鼠的常见证候辨证标准[19]观察小鼠精神状态、活动度、异常动作及皮毛色泽等多种行为状态。
1.6.2 小鼠体质量变化及末次给药后去瘤体质量 从初次给药前24 h(Day1)开始,每4 d称量一次小鼠体质量。末次给药24 h(Day17)后,使用0.3%戊巴比妥钠溶液以30 mg/kg剂量腹腔注射麻醉小鼠后脱颈椎处死,剥除瘤体,称量小鼠去瘤体质量。
1.6.3 小鼠肿瘤生长情况及抑瘤率 与称量小鼠体质量时间节点一致,使用游标卡尺测量肿瘤长径(A)及与长径垂直的最大宽径(B),并计算肿瘤体积。肿瘤体积(V)=AB2/2。剥除瘤体,测量瘤质量,并计算抑瘤率。抑瘤率(TGI)=(气虚荷瘤组瘤质量-给药组瘤质量)/气虚荷瘤组瘤质量×100%。
1.6.4 小鼠脾脏指数、胸腺指数测定 小鼠处死后,取脾脏和胸腺。去除多余脂肪后称定质量,并计算脾脏指数和胸腺指数。脾脏指数(mg/g)=[脾脏质量(mg)/体质量(g)]×10;胸腺指数(mg/g)=[胸腺质量(mg)/体质量(g)]×10。
1.6.5 小鼠肿瘤、肝脏和肾脏病理形态学观察 小鼠处死后,取肿瘤、肝脏和肾脏。用4%多聚甲醛固定24 h后,经脱水、包埋、切片,置于自动染色机进行苏木素-伊红(HE)染色。待染色结束并晾干后,采用中性树胶封片,光镜下观察、拍照。
1.6.6 小鼠外周血中各免疫细胞计量 采用眼球摘除采血法将血液分别收集于抗凝管中,经红细胞裂解后,制备得到细胞悬液;再以每管106个细胞分别收集于EP管中。管中同时加入规定剂量的抗体CD3e、CD4、CD25、CD8、CD19、CD49b,混匀后于4 ℃下避光孵育30 min;使用PBS洗涤细胞,进行固定、破膜,破膜后加入抗体Foxp3,混匀后继续4 ℃避光孵育30 min。孵育完成后使用PBS洗涤细胞,然后重悬于100 μL PBS中。使用流式细胞仪分析辅助性T细胞(CD3+、CD4+、CD8-)、杀伤性T细胞(CD3+、CD4-、CD8+)、调节性T细胞(Treg)(CD3+、CD4+、CD25+、Foxp3+)、NK细胞(CD3-、CD49b+)和B细胞(CD3-、CD19+)所占比例。
1.7 统计学方法 采用SPSS 25.0统计软件进行数据分析,计量资料以“均数±标准差”(±s)表示;数据满足正态分布与方差齐性检验时采用单因素方差分析,否则采用秩和检验,组间两两比较采用LSD-t检验,重复测量数据比较采用重复测量方差分析,以P<0.05为差异有统计学意义。统计图采用GraphPad Prism9.0软件进行绘制。
2 结果
2.1 小鼠一般情况 烟熏造模结束后,正常(未烟熏)小鼠无撞击、眯眼、蜷卧等行为,活动度活跃,皮毛光亮,精神状态正常,饮食量正常;烟熏小鼠烟熏时有跳跃、撞击表现,喜蜷卧,活动度减弱,毛发脱落且蓬松凌乱,毛色发灰,欠光泽,精神萎靡,饮食量较未烟熏小鼠下降。在小鼠的常见证候辨证[19]中,烟熏后小鼠符合气虚证体质表现。(见图1)

图1 小鼠一般情况
2.2 各组小鼠体质量比较 所有小鼠随时间推移体质量均有增加,差异有统计学意义(P<0.001),即存在时间效应。各组小鼠体质量总体比较,差异无统计学意义(P=0.104),即不存在分组效应;各组小鼠于给药前(Day1)、给药第4天(Day5)、给药第12天(Day13)、末次给药24 h(Day17)体质量比较,差异均无统计学意义(P>0.05);给药第8天(Day9),气虚荷瘤组小鼠体质量高于正常组(P<0.05),汉黄芩素中、高剂量组小鼠体质量均低于气虚荷瘤组(P<0.05)。随时间推移,各组小鼠间体质量增长幅度不一致(P=0.007),即时间因素与分组因素间存在交互效应。(见表1、图2)5组小鼠给药结束后去瘤体质量比较,差异均无统计学意义(P>0.05)。(见图3)
表1 各组小鼠体质量比较 (±s,g)

表1 各组小鼠体质量比较 (±s,g)
注:F时间主效应=455.272,P时间主效应=0.000;F分组主效应=2.144,P分组主效应=0.104;F交互效应=2.282,P交互效应=0.007;与正常组比较,aP<0.05,bP<0.01;与气虚荷瘤组比较,cP<0.05。
组别n给药剂量/[mg/(kg/d)]Day1Day5Day9Day13Day17FP正常组6-17.88±0.62 20.21±0.59 23.59±0.50 24.79±1.59 24.93±1.60 71.545 0.000气虚荷瘤组6-17.24±0.50 22.20±0.59 26.06±1.29b 26.65±1.28 27.28±1.96 127.608 0.000汉黄芩素低剂量组 62517.39±1.06 21.51±2.34 24.57±2.50 25.55±2.90 26.79±1.76 93.716 0.000汉黄芩素中剂量组 65017.10±0.53 21.31±0.72 24.72±1.02c 25.31±1.33 25.97±1.57 93.095 0.000汉黄芩素高剂量组 610017.46±0.89 22.33±2.10 24.57±1.75c 25.17±1.83 25.85±2.08 78.065 0.000 F 1.6382.6494.0411.8881.749 P 0.1950.0560.0110.1430.170
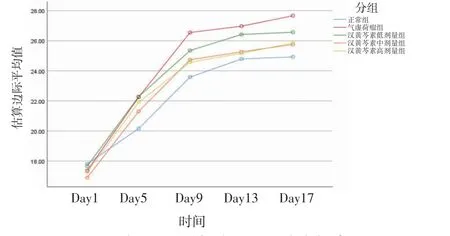
图2 各组小鼠体质量交互效应轮廓图

图3 各组小鼠给药结束后去瘤体质量比较 (±s,n=6)
2.3 各组小鼠瘤体体积及抑瘤率比较 所有小鼠瘤体体积随时间推移均增大,差异有统计学意义(P<0.001),即存在时间效应。各组小鼠瘤体积总体比较,差异有统计学意义(P<0.001),即存在分组效应;给药前(Day1),各组小鼠瘤体体积比较,差异均无统计学意义(P>0.05);给药第4天(Day5),汉黄芩素高剂量组小鼠瘤体体积明显低于气虚荷瘤组(P<0.05);给药第8天(Day9)、给药第12天(Day13)、末次给药24 h(Day17),汉黄芩素低、中、高剂量组小鼠瘤体体积均明显低于气虚荷瘤组(P<0.01)。随时间推移,各组小鼠间瘤体体积增长幅度不一致(P=0.022),即时间因素与分组因素间存在交互效应。(见表2、图4~5)与气虚荷瘤组比较,汉黄芩素低、中、高剂量组瘤体质量均明显降低(P<0.05或P<0.01)。汉黄芩素低、中、高剂量组抑瘤率分别为55.68%、56.84%、76.33%。(见图6)
表2 各组小鼠瘤体体积比较 (±s,mm3)

表2 各组小鼠瘤体体积比较 (±s,mm3)
注:F时间主效应=27.043,P时间主效应=0.000;F分组主效应=10.769,P分组主效应=0.000;F交互效应=2.227,P交互效应=0.022;与气虚荷瘤组比较,aP<0.05,bP<0.01。
组别n给药剂量/[mg/(kg·d)] Day1Day5Day9Day13Day17FP气虚荷瘤组6-33.34±10.41 101.73±30.36 393.337±153.61 1 317.17±547.47 2 004.29±954.34 36.355 0.000汉黄芩素低剂量组62532.89±15.99 68.35±32.39 141.07±75.66b297.35±169.49b708.82±160.39b 2.981 0.049汉黄芩素中剂量组65032.30±11.07 55.81±10.10 96.72±40.70b297.17±86.36b553.79±377.64b 3.912 0.020汉黄芩素高剂量组610032.37±6.3537.82±11.39a 74.11±19.50b179.17±52.83b347.14±98.94b0.975 0.447 F 0.5461.8905.3369.69011.975 P 0.6560.1640.0070.0000.000

图4 各组小鼠瘤体体积交互效应轮廓图
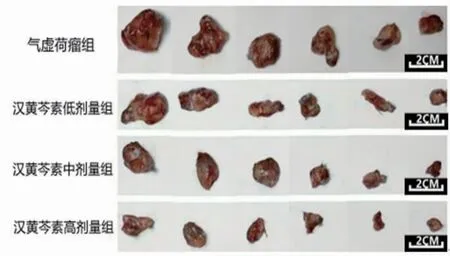
图5 各组小鼠瘤体大体观察图
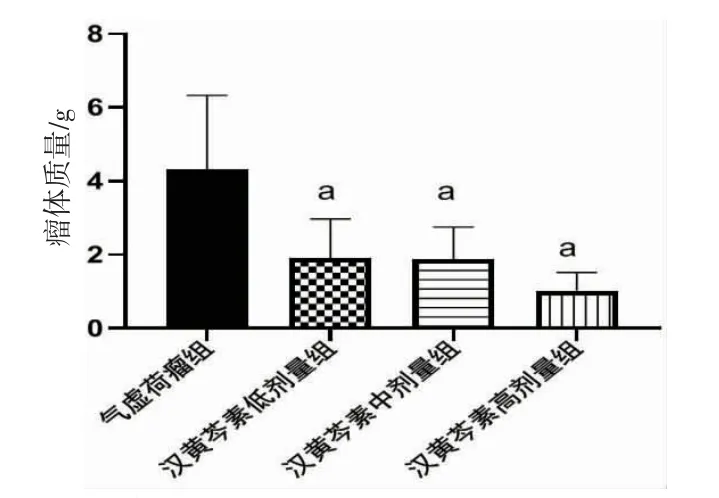
图6 各组小鼠瘤体质量比较 (±s,n=6)
2.4 各组小鼠脾脏指数、胸腺指数比较 与正常组比较,气虚荷瘤组小鼠脾脏指数明显升高(P<0.05),胸腺指数明显降低(P<0.05);汉黄芩素低、中、高剂量组小鼠脾脏、胸腺指数与气虚荷瘤组比较,差异均无统计学意义(P>0.05)。(见图7)

图7 各组小鼠脾脏指数、胸腺指数比较 (±s,n=6)
2.5 各组小鼠肿瘤及肝脏、肾脏组织病理变化 气虚荷瘤组小鼠肿瘤组织细胞排列紧密,大小不一,细胞核染色深且形状各异;汉黄芩素低、中、高剂量组小鼠肿瘤组织可见较多处坏死区域,且肿瘤细胞的排列相对紊乱。(见图8)
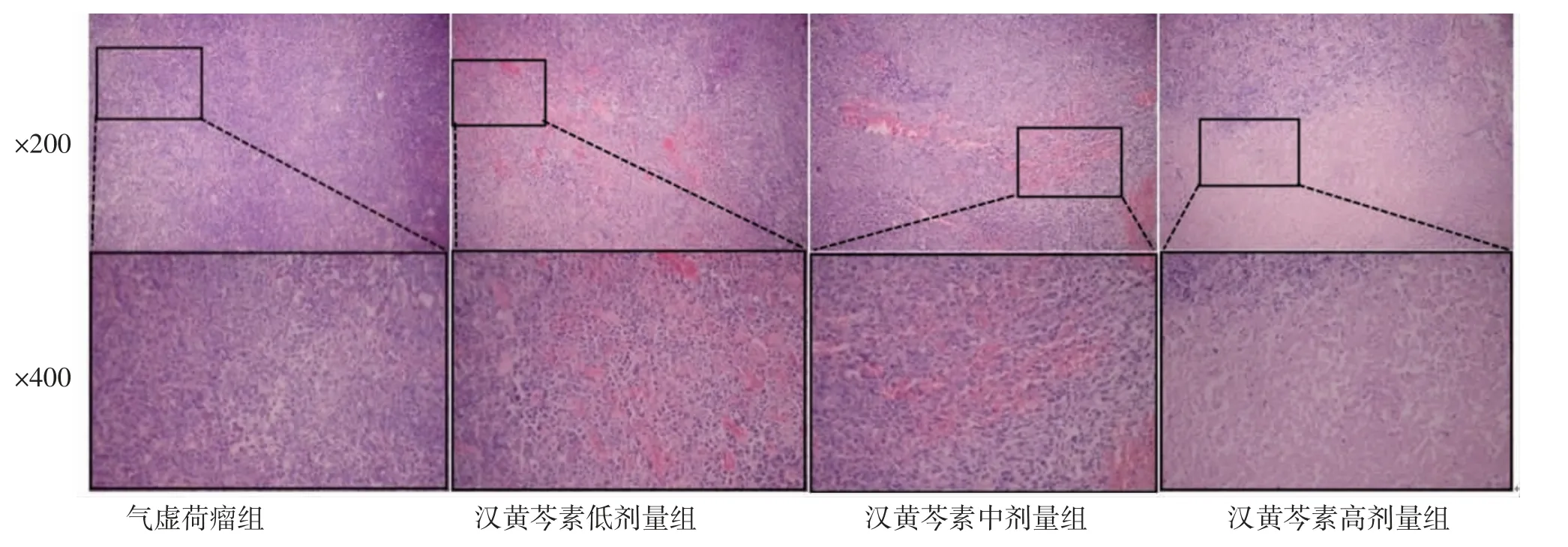
图8 各组小鼠的肿瘤组织病理切片图 (HE)
正常组、气虚荷瘤组及汉黄芩素低、中、高剂量组小鼠肝脏组织的肝细胞索间界限清晰,肝小叶结构清晰,胞浆界限明显,未见明显异常;肾脏组织的肾小球、肾小管等结构清晰完整,无明显水肿及血管扩张充血等病变。(见图9)

图9 各组小鼠的肝脏、肾脏病理切片图 (HE,×400)
2.6 各组小鼠外周血辅助性T细胞亚群比例比较 与正常组比较,气虚荷瘤组小鼠外周血CD3+CD4+T细胞比例明显降低(P<0.05);与气虚荷瘤组比较,汉黄芩素低、中、高剂量组小鼠外周血CD3+CD4+T细胞比例均明显升高(P<0.01或P<0.05);汉黄芩素低、中、高剂量组间小鼠外周血CD3+CD4+T细胞比例比较,差异无统计学意义(P>0.05)。(见图10~11)
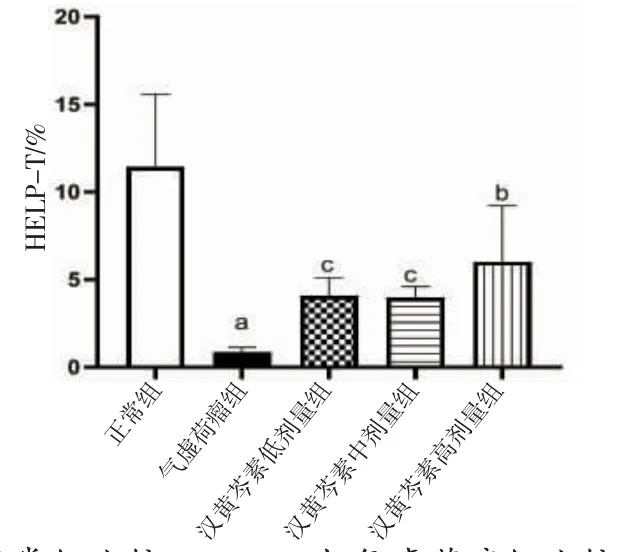
图10 各组小鼠外周血辅助性T 细胞亚群比例比较(±s,n=6)

图11 各组小鼠外周血辅助性T 细胞亚群部分流式细胞图
2.7 各组小鼠外周血杀伤性T细胞亚群比例比较 与正常组比较,气虚荷瘤组小鼠外周血CD3+CD8+T细胞比例明显降低(P<0.01);汉黄芩素低、中、高剂量组小鼠外周血CD3+CD8+T细胞比例与气虚荷瘤组比较,差异均无统计学意义(P>0.05)。(见图12~13)

图12 各组小鼠外周血杀伤性T 细胞亚群比例比较(±s,n=6)

图13 各组小鼠杀伤性T 细胞亚群部分流式细胞图
2.8 各组小鼠外周血CD4+/CD8+比值比较 与正常组比较,气虚荷瘤组小鼠外周血CD4+/CD8+比值明显降低(P<0.01);与气虚荷瘤组比较,汉黄芩素低、中、高剂量组小鼠外周血CD4+/CD8+比值均明显升高(P<0.01或P<0.05);汉黄芩素低、中、高剂量组间小鼠外周血CD4+/CD8+比值比较,差异均无统计学意义(P>0.05)。(见图14)
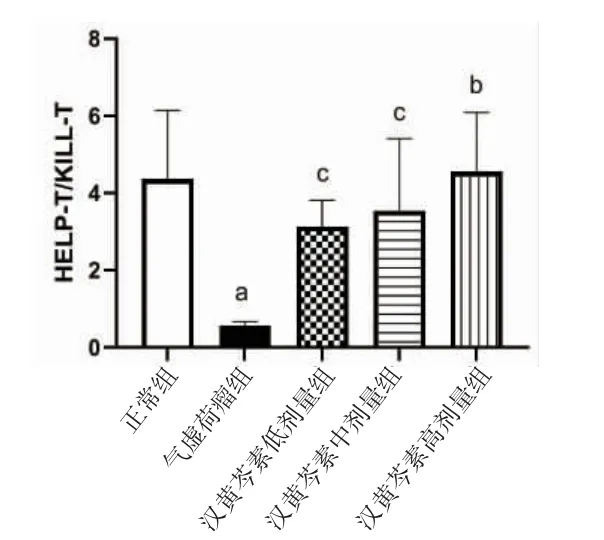
图14 各组小鼠外周血CD4+/CD8+比值比较 (±s,n=6)
2.9 各组小鼠外周血调节性T细胞(Treg)(Treg)亚群比例比较 与正常组比较,气虚荷瘤组小鼠外周血CD3+CD4+CD25+Foxp3+T细胞比例明显降低(P<0.01);与气虚荷瘤组比较,汉黄芩素低、中、高剂量组小鼠外周血CD3+CD4+CD25+Foxp3+T细胞比例均明显升高(P<0.05或P<0.01);汉黄芩素低、中、高剂量组间鼠外周血CD3+CD4+CD25+Foxp3+T细胞比例比较,差异均无统计学意义(P>0.05)。(见图15~16)
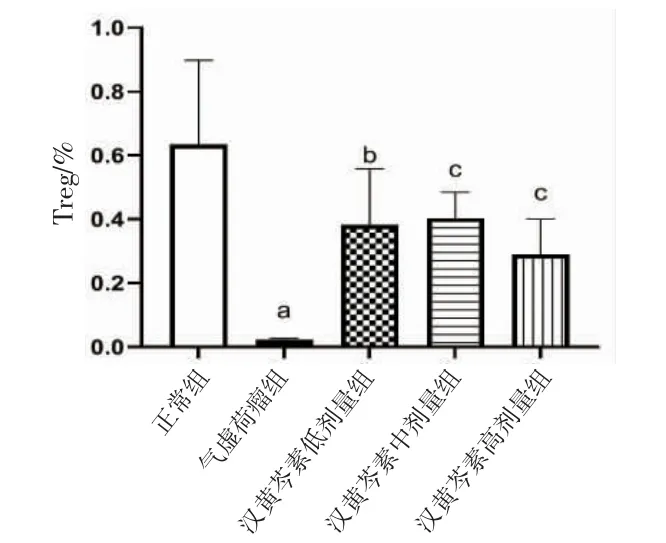
图15 各组小鼠外周血调节性T 细胞(Treg)亚群比例比较(±s,n=6)

图16 各组小鼠外周血调节性T 细胞(Treg)亚群部分流式细胞图
2.10 各组小鼠外周血B淋巴细胞亚群比例比较 与正常组比较,气虚荷瘤组小鼠外周血CD3-CD19+B细胞比例明显降低(P<0.01);汉黄芩素低、中、高剂量组小鼠外周血CD3-CD19+B细胞比例与气虚荷瘤组比较,差异均无统计学意义(P>0.05)。(见图17~18)

图17 各组小鼠外周血B 淋巴细胞亚群比例比较(±s,n=6)

图18 各组小鼠外周血B 淋巴细胞亚群部分流式细胞图
2.11 各组小鼠外周血中NK细胞亚群比例比较 与正常组比较,气虚荷瘤组小鼠外周血CD3-CD49b+NK细胞比例有所升高,但差异无统计学意义(P>0.05);汉黄芩素低、中、高剂量组小鼠外周血CD3-CD49b+NK细胞比例与气虚荷瘤组比较,差异均无统计学意义(P>0.05)。(见图19~20)

图19 各组小鼠外周血NK淋巴细胞亚群比例比较(±s,n=6)
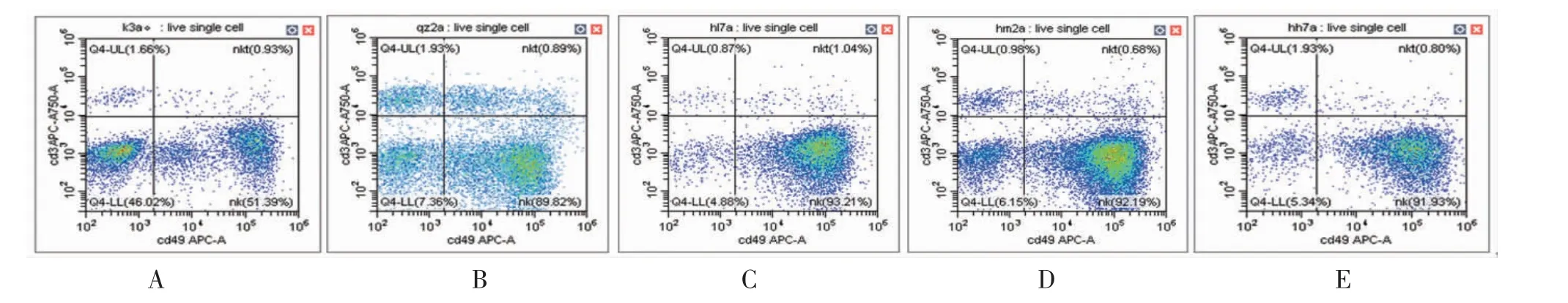
图20 各组小鼠外周血NK 淋巴细胞亚群部分流式细胞图
3 讨论
在中国,肺癌是发病率和死亡率最高的恶性肿瘤[20]。在过去40年间,中国肺癌的死亡率增加约4倍,取代了胃癌成为癌症死亡的最主要原因[21]。目前研究发现,肺癌的发生、发展与环境污染、吸烟、职业接触、电离辐射等多种因素有关,而自身的免疫状态更与其有着十分密切的联系[1]。肺癌患者体内免疫功能抑制或紊乱可导致肿瘤细胞逃脱免疫细胞的“监测”而“逃逸”,这不仅会使肿瘤细胞的恶性增殖不受控制,而且会大大增加肿瘤细胞转移的风险性[22-23]。因此,监测肺癌患者免疫功能的动态变化对于选择合适的治疗方案及预测肺癌患者预后的意义十分重大。
中医学认为肺癌的基本病机在于正气亏虚。本病病位在肺,吸烟、肺部基础疾病等可导致肺阴亏虚、易感外邪,正气不足而邪毒滞于体内,内外因相互作用引起气机阻滞、脏腑失调,血液运行不畅形成瘀血,而痰热瘀毒聚于肺腑,共结为癌毒[24]。正如李中梓在《医宗必读》中所说:“积之成者,正气不足,而后邪气踞之。”本研究采用烟熏法以造模气虚型小鼠[18],后采用皮下接种LLC肺癌细胞制备小鼠种植瘤模型,模拟肺癌发生、发展的全过程。
汉黄芩素属于黄酮类化合物,广泛存在于黄芩、半枝莲等中药材,肝毒性和肾毒性均较低。本研究采用皮下接种LLC肺癌细胞制备小鼠种植瘤模型,以此探讨汉黄芩素的抗肺癌作用以及其作用机制是否与调控各淋巴细胞亚群相关。从瘤体体积、瘤体质量及瘤组织的病理检查结果来看,汉黄芩素干预能够减缓肿瘤的生长,与汉黄芩素的抗肿瘤活性相关研究结果[25-26]一致。现代医学认为,脾脏和胸腺是重要的免疫器官,是衡量机体免疫能力的重要指标[27]。脾脏是机体最大的免疫器官,既是T细胞和B细胞定居的场所,也是免疫应答发生的场所。肿瘤会引起脾脏的肿大,而肿大的脾脏会导致白细胞明显减少,严重影响机体正常的免疫功能[28]。T细胞的发育是由骨髓来源的淋巴样祖细胞和支持性胸腺基质微环境之间的相互作用协调的。而胸腺功能的下降则会导致抗肿瘤免疫功能受损,延迟癌症患者的免疫重建[29]。在癌症治疗中,更好的全身免疫状态意味着可以更持续的从外周血中募集抗肿瘤淋巴细胞,对于癌症治疗具有更好的意义[30]。T淋巴细胞亚群作为检测机体细胞免疫功能的重要指标之一,其对于某些疾病的诊断、分析发病机制、疗效观察及预后的预测均具有重要临床价值[31]。作为抗肿瘤免疫的一个重要组成部分,外周血CD4+T细胞有助于调节和促进细胞毒性T淋巴细胞(CTL)的启动、迁移潜力和杀伤活性[32]。临床研究发现,对于晚期非小细胞肺癌患者,更高水平的CD4+T细胞与更好的疗效及更长的PFS相关[33]。CD4+T细胞亚群在识别免疫治疗前临床受益者,预测免疫治疗效果和患者存活率方面有很大价值[34]。与气虚荷瘤组比较,汉黄芩素低、中、高剂量组小鼠CD4+T细胞水平较高,这说明汉黄芩素可增加CD4+T细胞数量,从而获得更持久的抗肿瘤反应。CD8+T细胞可以扩增分化成CTL,通过血液循环迁移浸润肿瘤以直接杀伤肿瘤细胞,在抗肿瘤免疫中发挥重要作用[35],所以高CD8+T细胞水平可以增强抗肿瘤反应。然而有临床试验[33-36]显示,免疫治疗有效组的外周血CD8+T细胞比例较基线组有所降低,故CD8+T细胞比例水平与抗肿瘤免疫可能与多种因素有关。CD4+/CD8+比值可以显示机体免疫功能的状态,是癌症患者细胞介导免疫的标志,其降低提示机体处于免疫抑制状态,可能诱发或加快肿瘤生长[37-38]。与气虚荷瘤组比较,汉黄芩素低、中、高剂量组小鼠外周血CD4+/CD8+比值明显升高,说明汉黄芩素低、中、高剂量组小鼠的免疫抑制状态得到了明显改善。调节性T细胞(Treg)是以免疫抑制功能为特征的CD4+T细胞谱系,具有维持机体免疫稳态、免疫监视和预防自身免疫的作用[39],对于预防所有组织的破坏性免疫至关重要[10]。与气虚荷瘤组比较,汉黄芩素低、中、高剂量组小鼠外周血中调节性T细胞(Treg)比例明显增加,与临床研究[33]所显示的晚期非小细胞肺癌患者免疫治疗临床受益组的外周血调节性T细胞(Treg)较基线有所增加相符合,所以汉黄芩素对于LLC种植瘤小鼠外周血调节性T细胞(Treg)的升高作用可能具有积极意义。B细胞通过抗原呈递激活T细胞,外周血B细胞的比例下降,表明体液免疫受损[40]。然而,多项研究[41]表明,激活的B细胞的细胞毒性具有导致肿瘤发展的潜在危害,如B细胞介导抑制活化CD8+T细胞,促进晚期非小细胞肺癌细胞生长等[42]。NK细胞在肿瘤免疫检测中具有积极作用,临床研究证实,免疫治疗临床受益组外周血中NK细胞比例较基线有所增加,且基线NK细胞的比例越高,则临床疗效越好,患者更有可能获得更长的FPS[33,43-44];NK细胞的活性也可作为生物标志物来预测非小细胞肺癌患者对于免疫治疗的反应程度[45]。
综上所述,在气虚型LLC种植瘤小鼠模型上,汉黄芩素可以有效抑制种植瘤的生长,提高外周血中CD4+T淋巴细胞的比例,提高CD4+/CD8+T细胞的比值,改善免疫状态,从而更好地发挥免疫系统的抗肿瘤作用。本研究结果可为将汉黄芩素开发为抗肿瘤免疫治疗药物提供参考,但汉黄芩素作用于淋巴细胞的机制尚不明确,这仍需要进一步的研究。

