SARS-CoV-2相关血管紧张素转化酶2表达异常与乳腺疾病的关系研究新进展
黄伟健,曾达通 综述 黄素宁 审校
1.广西玉林市红十字会医院病理科,广西 玉林 537000;
2.广西医科大学附属肿瘤医院放疗科,广西 南宁 530021
截至2022年11月,全世界约有超过6亿4 000万新冠肺炎确诊病例[1]。目前相关流行病学统计,除肺弥散能力受损、肺间质纤维化等肺部症状外,该疾病并发症可能累及多系统,包括以心律失常、高血压、心力衰竭等为主要表现的心血管系统,以嗅觉减退和认知功能障碍为主要表现的神经系统。目前新冠的防控除严格的管控措施外,疫苗接种是最重要的手段,疫苗接种后部分人群有乳腺炎的症状。在近年乳腺癌首次评估中,有19.7%的患者有过新冠肺炎的感染[2-5]。该病的致病由严重急性呼吸综合征冠状病毒-2(SARS-CoV-2)引起,可通过人体组织中广泛表达的血管紧张素2转化酶(angiotensin-converting enzyme 2,ACE2)为受体[6-7],入侵后会引起相应宿主细胞的ACE2 受体脱落,导致肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RASS)的成分失衡[8],不仅如此,ACE2低表达会引起肿瘤过度增殖、侵袭性和迁徙增加以及促进乳腺发生炎症等效应[9-11],然而目前缺乏ACE2 在乳腺疾病的知识体系的总结和梳理,基于上述考虑,本文对SARS-CoV-2 经ACE2 受体入侵宿主细胞后所导致的ACE2受体脱落和ACE2低表达对乳腺癌和乳腺炎方面造成的影响进行了简要综述,旨在为预防SARS-CoV-2对乳腺的损害提供思路。
1 ACE2异常表达机制及效应
SARS-Cov-2 导致ACE2 的异常表达与病毒特征性结构有关。SARS-CoV-2 的刺突(S)蛋白由长的N端S1亚基和短的C端S2亚基组成了该蛋白的主要功能亚基,其中S1亚基能够与作为受体的ACE2相互作用并引起ACE2 的脱落,从而造成了ACE2 异常表达的效应(图1)。S蛋白功能激活与丝氨酸蛋白酶(transmembrane serine protease 2,TMPRSS2)的活化有关,丝氨酸蛋白酶将S 蛋白的S1、S2 亚基分离,分离后的S2亚基会促使受感染细胞与新冠病毒进行结合,从而使得新冠病毒进入相应细胞并释放关于自身复制的物质,从而进一步感染并损害其他细胞[12-14]。
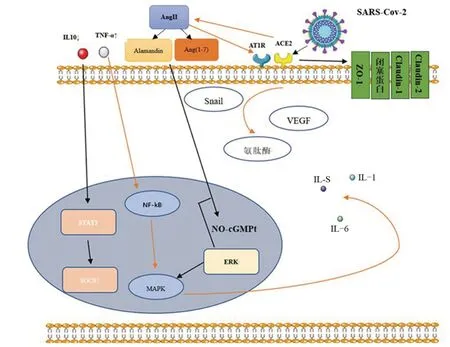
图1 SARS-CoV-2以ACE2为受体入侵乳腺细胞后引起炎症性损害和癌变作用示意图Figure 1 Schematic diagram of the inflammatory damage and carcinogenic effect of SARS-CoV-2 invading breast cells using ACE2 as a receptor
ACE2 的异常表达会干扰RASS 调控轴实现生物学调控,RASS 调控轴在肿瘤等诸多疾病中至关重要。血管紧张素原在肾素的作用下转化为血管紧张素I(angiotensinI,AngI),而AngI由血管紧张素转化酶I(ACE1)转化为血管紧张素Ⅱ(angiotensinⅡ,AngⅡ),而AngⅡ在ACE2的作用下转化为激素Ang(1-7),最终转化为alamandine,而alamandine 与Ang(1-7)会作用于原癌基因Mas 受体(MASR)和Mas 相关GPCR 成员D(MRGD)。在乳腺癌中,RASS 调控轴AngⅡ在作用于AngⅡ的1 受体(AngⅡType 1 Receptor,AT1R)后会促进肿瘤的生长以及增加其侵袭性[15-17],因此可以看出,ACE2 的异常表达对乳腺癌的发生和发展起到了正相关效应。
2 ACE2表达与乳腺癌的关系
2.1 ACE2在不同乳腺癌分子分型中的表达 乳腺癌根据HER、ER、PR 的表达情况主要可以分为Luminal A 型[ER(+)/HER-2(-)]、LuminalB 型[ER(+)/HER-2(+)]、Basal-like 型[ER(-)/HER-2(-)]、HER-2 型[ER(-)/HER-2(+)][18-19],每一种类型的生物学行为不同。笔者分析了2 320 例乳腺癌样本人群数据,数据来源于TCGA 数据库、GEO 数据库及Oncomine 数据库,ACE2普遍在乳腺癌中低表达,而在Basal-like型中处于高表达状态,在Luminal B型乳腺癌中ACE2的高表达与其更好的预后相关(无复发生存率:风险率=0.76;远处无转移生存期:风险率=0.6),多因素分析提示ACE2可以作为乳腺癌的独立预后因素[20-22]。
2.2 ACE2 表达与乳腺癌的肿瘤微环境的关系 乳腺癌的发生除了与细胞本身发生癌变有关,还与其周围的微环境变化密切相关,即乳腺癌的肿瘤微环境(tumor microenvironment,TME),TME的主要细胞成分含成纤维细胞、树突状细胞、巨噬细胞、淋巴细胞。其中,浸润的淋巴细胞是TME中的关键参与者之一[23]。
使用TIMER、UALCAN对不同亚型乳腺癌的ACE2转录水平和免疫浸润水平之间的相关性分析表明,在Luminal型中,ACE2的表达水平不仅与其CD8+T细胞(r=0.184,P<0.001)、CD4+T 细胞(r=0.104,P=0.02)的免疫浸润水平呈显著正相关,而且与CD8+T 细胞中的CD8A(r=0.244)和CD8B (r=0.262)标志物呈正相关。在涉及乳腺癌的预后方面,调节性T 细胞作为乳腺癌的不良预后因素而言,与ACE2 呈负相关[21,24-25],然而在Basal-like 型中,ACE2 的表达与中性粒细胞及其标志物SIGLEC5(r=0.232)和CSF3R(r=0.260)呈正相关,经过TCGA 数据库中832 个样本与METABRIC 数据库中1 898 个样本的相关数据分析表明,Basal-like 型乳腺癌的ACE2处于高表达状态[20],因此,有理由推测新冠病毒导致的ACE2 低表达对Basal-like 型的乳腺癌的发生发展起到一定的拮抗作用。
此外,TME的改变会对乳腺癌的治疗方面产生影响,通过使用TIMER、EPIC、MCP-counter、quanTIseq和TISIBD计算免疫细胞浸润水平发现,ACE2过表达造成的Ang(1-7)增加会提升CD3+和CD8+免疫细胞的浸润丰度并上调细胞因子CXCL9,但是会下调TGFβ1,由此造成TME重塑,同时对Ang(1-7)致敏的小鼠的研究发现,基于Ang(1-7)的作用,乳腺癌会对化疗和免疫治疗呈现出敏感的反应,即将乳腺癌从原本的“冷”肿瘤变成了“热肿瘤[24]。
由此可见,新冠病毒导致的ACE2降低,势必会对乳腺细胞原本的周围环境发生改变,甚至形成造成乳腺癌变的肿瘤微环境,对于Luminal型及HER2型的乳腺癌而言,新冠病毒导致的ACE2 低表达对其本身反应出的ACE2低表达相同,而对于Basal-like型乳腺癌而言,新冠病毒导致的ACE2 低表达对其本身反应出的ACE2 高表达相矛盾,因此可以推测新冠病毒对于Basal-like型乳腺癌的进展可能存在拮抗作用。
2.3 SARS-Cov-2 经由ACE2 入侵乳腺 经由ACE2 介导SARS-Cov-2 的S 蛋白可进入人体,ACE2在人体细胞组织表面广泛表达,这可能是SARS-Cov-2进入了乳腺细胞的主要方式。SARS-Cov-2入侵后可降低ACE2 的表达,导致AngⅡ经ACE2 转化为Ang(1-7)的路径受到阻碍,引起alamandine、MASR及MRGD相应减少,最终导致ERK/MAPK通路或NO-cGMPt通路会被抑制,被抑制的该通路将无法抑制AngⅡ与ATR1作用而产生的细胞增殖效应,最终促进乳腺癌的发生[9,16,26-27]。在1 082 例人群样本数据分析中发现(数据来源TCGA),ACE2 与snail 表达呈负相关。敲低MCF10A 细胞系ACE2 后snail 表达上调,并可诱导乳腺上皮细胞发生上皮间充质转化(epithelial-mesenchymal transition,EMT)重编程,促进细胞的侵袭和迁徙[8,28-29]。
新冠病毒引起的乳腺细胞内ACE2的下调会导致血管紧张素Ⅱ的降解减少,血管紧张素Ⅲ的增加,最终导致氨肽酶的上调,而氨肽酶与乳腺癌的进展密切相关,可能会刺激乳腺癌的进展[30]。但过表达ACE2后乳腺癌细胞迁徙受到了抑制,可能与过表达ACE2后抑制了ERK信号通路中的磷酸化有关,磷酸化抑制后血管内皮生长因子a (vascular endothelial growth factor a,VEGFa)的表达下调,进一步抑制了VEGFa结合肿瘤附近内皮细胞上的血管内皮生长因子受体2的过程,最终抑制肿瘤的增殖以及相应的肿瘤血管生成[31]。因此,经新冠病毒导致的ACE2低表达,可以逆转ACE2过表达对于肿瘤的抑制效应,从而促进乳腺癌的发生发展。
综上所述,低表达的ACE2 在乳腺癌的上皮间充质转化、血管生成、细胞增殖过程中起到正向作用,这可能会成为新冠病毒感染引起的并发症的一个新关注点。
3 ACE2表达与乳腺炎的关系
ACE2 的异常表达会导致炎症因子的释放异常。TNF-α作为炎症介质可以产生LPS (脂多糖),上调TLR-4/NF-κB/MAPK信号通路,同时引起IL-1、IL-6、IL-8 等炎症因子的增加,产生级联放大效应,引起了炎症反应扩散,导致乳腺炎的发生[32]。在EpH4 Ev(小鼠乳腺上皮)细胞和MSC、MSC-GFP及MSC-ACE2共同培养中发现过表达的ACE2会减少上述炎症因子的释放,抑制LPS 诱导的乳腺上皮细胞炎症损伤,过表达的ACE2 还会激活IL-10/STAT3/SOCS3 信号通路,来抑制LPS诱导的炎症[10,33],因此,可以看出,ACE2的低表达无法对诱发炎症的信号通路进行抑制,会引起炎症因子的增加,甚至会造成原有的ACE2正常表达状态下的炎症通路抑制被削弱,最终导致乳腺炎的发生。
ACE2 表达可能与血乳屏障功能有关。ZO-1(闭塞小带1)、闭塞蛋白、Claudin-1和Claudin-2会与乳腺上皮细胞相连,组成阻挡病原微生物入侵乳腺的第一道防线-血乳屏障。ACE2 过表达会改变乳腺炎的主要病原微生物结核分枝杆菌引起的ZO-1、闭塞蛋白、Claudin-1 和Claudin-2 的下调状态,从而修复血乳屏障,恢复其对于乳腺的保护功能,以此减少或者缓解乳腺炎的发生发展[11,34-37]。
4 展望
SARS-CoV-2所引起的新冠肺炎并发症的研究多集中于其对肺部和心血管系统的影响,如何引起并发症的机制正受到研究者重视。ACE2 作为重要的受体,在SARS-CoV-2 所致乳腺癌和乳腺炎的疾病发生与发展发挥了重要作用。SARS-CoV-2 导致ACE2 作用缺如可能促进了ACE2低表达的乳腺癌和乳腺炎的发展。而在ACE2高表达的Basal-like型乳腺癌中,新冠病毒所致的ACE2低表达对于其进展的最终效应是拮抗还是协同效应,还需要进一步的研究,因此,新冠病毒对于不同类型的乳腺癌而言,其所致的ACE2 低表达效应对于相应的类型而言,可能存在不同的分子调控机制。

