白及多糖脂质体的制备及其体外透皮吸收考察
孙铭洋,闫心茹,时庆泽,张玉洁,王中彦 (. 沈阳药科大学中药学院,辽宁 沈阳 006;. 沈阳药科大学药学院,辽宁 沈阳 006)
白及多糖(Bletilla striata polysaccharide,BSP)是从白及根茎中提取的一种水溶性多糖,又称白及胶,具有收敛止血的功效[1]。研究[2]表明白及多糖可以提高表皮生长因子的表达,促进创面愈合,而且对皮肤的刺激性较小,在消炎、消除痤疮等方面有良好功效。白及多糖有保湿[3]、抗氧化[4]、祛黄[5]等能力,具有开发成护肤品的潜力。若要发挥药效作用,白及多糖需透过角质层,滞留在表皮层和真皮层。本课题组预试验表明白及多糖虽易透过角质层,但皮肤滞留量低,难以发挥功效,因此如何提高白及多糖在皮肤中的滞留量是本研究拟解决的问题。脂质体(Liposomes,Lip)是将药物包封在类脂双分子层内形成的微型球状体,其类脂双分子与皮肤组织存在良好的生物相容性[6],并可使药物缓释,降低药物不良反应,是一种高效、安全的透皮给药系统[7]。因此将白及多糖制成脂质体,可以降低白及多糖在皮肤中的渗透速率,提高滞留量。本研究用星点设计-响应面法筛选和优化白及多糖脂质体的处方,并对其进行质量评价,以考察其在体外透皮吸收性,为白及多糖的开发提供科学依据。
1 仪器与材料
1.1 仪器 FA1004 型万分之一电子天平,上海舜宇恒平科学仪器有限公司;756PC 型紫外可见分光光度计,上海舜宇恒平科学仪器有限公司;UV-2000 紫外-可见分光光度计,尤尼柯(上海)仪器有限公司;RE-5203 旋转蒸发仪,上海亚荣生化仪器厂;DF-101S 集热式恒温加热磁力搅拌器,巩义市予华仪器有限责任公司。
1.2 试剂与试药 无水乙醚,分析纯,天津市富宇精细化工有限公司;胆固醇,北京沃凯生物公司;大豆磷脂(SPC-95A,艾维拓(上海)医药科技有限公司;白及多糖,纯度≥70%,上海源叶生物科技有限公司,批号:O23GS164559。
2 方法与结果
2.1 白及多糖脂质体的制备[8]采用逆相蒸发法制备白及多糖脂质体(BSP-Lip)。精确称取处方量的磷脂、胆固醇,加入一定量乙醚溶解形成溶液,并将含有白及多糖的PBS 溶液在搅拌下加入,超声使其混合均匀、充分乳化,形成W/O 型乳剂(30 min 以上不分相)。将形成的乳剂在35 ℃恒温条件下旋转蒸发至形成胶态,再加入PBS 溶液旋转水化,直到液体中出现微蓝的乳光,说明脂质体制成。将制得混悬液超声处理10 min,然后依次滤过0.45 μm、0.22 μm 滤膜,得到白及多糖脂质体溶液,置于4 ℃保存。
2.2 白及多糖含量测定 采用苯酚硫酸比色法[9],以无水葡萄糖作为标准品,绘制标准曲线后测定白及多糖的含量。
2.3 脂质体包封率及载药量的测定 选用鱼精蛋白法[10]测定BSP-Lip 包封率,并考察此方法的回收率。用移液枪吸取混合不同浓度白及多糖的空白脂质体和鱼精蛋白溶液(10 mg·mL-1),加入离心管中,二者1∶1 混合,涡旋3 min,将混合液在室温下以转速12 000 r·min-1离心(离心半径为64 mm)15 min。取上清液,用“2.2”项下方法测定上清液中药物浓度,除以加入的药物稀释到体系中的浓度,计算后得出回收率,结果见表1。确定好方法后用移液枪吸取白及多糖脂质体和鱼精蛋白溶液(10 mg·mL-1)加入离心管中,按相同的方法操作后取上清液,用“2.2”项下方法测定游离药物含量(We),计算脂质体包封率和载药量。包封率=(1-We/W0)×100%,载药量=(W0-We)/(W0+W)×100%。其中W0为制备脂质体所加入的药物含量,W 为脂质体中脂质的质量。

表1 白及多糖(BSP)脂质体的回收率测定结果(n=5)Table 1 Determination results of recovery rate of Bletilla striata pollysaccharide liposomes(BSP-Lip)(n=5)
2.4 BSP-Lip 的处方优化
2.4.1 单因素筛选 根据文献方法[11]以包封率为指标分别考察以下4 个因素:有机相与水相比(3∶1、4∶1、5∶1、6∶1),磷脂与胆固醇比(1∶1、2∶1、3∶1、4∶1、5∶1、6∶1、7∶1),磷脂浓度(0.5%、0.7%、0.9%、1.2%、1.5%、1.7%)和磷脂与药物比(10∶1、20∶1、30∶1、60∶1、90∶1)对BSP-Lip 包封率的影响[12],结果见图1。根据试验的结果,选择了磷脂浓度(A)、磷脂与胆固醇(B)和磷脂与药物比(C)3 个对包封率影响较大的因素进行星点设计-响应面优化。

图1 白及多糖脂质体的单因素筛选结果Figure 1 Single-factor screening results of BSP-Lip
2.4.2 星点设计 响应面试验因素与水平设计见表2。以3 个因素为自变量(X),包封率为因变量(Y),利用Design-Expert V8.0.6.1 软件进行响应面试验设计,选用了其中的Box-Behnken 模型,进行3 因素5 水平共17 个试验组合。试验结果见表3。

表2 白及多糖脂质体响应面试验的因素与水平设计表Table 2 The factors and levels used in response surface test of BSP-Lip

表3 白及多糖脂质体的响应面法试验结果Table 3 Test results of response surface method of BSP-Lip
通过二次回归拟合得出响应值与影响因素之间的回归方程:Y=63.95-0.86A+1.34B+0.92C+0.47AB-0.29AC+0.69BC-5.72A2-5.14B2-4.77C2(r=0.982),并得出预测出的最优处方:A=1.44,B=2.13,C=42.18,Y=64.11。
2.4.2 方差分析 对处方优化试验结果进行方差分析。结果见表4。回归方程模型的P值小于0.000 1,模型具有非常显著性;失拟项P值为0.107 4,说明其无显著性差异,表明模型是合适的,可用试验处方的预测。模型中线性系数(A、B、C)的P值均小于0.05,说明对包封率有显著性的影响;交互作用系数(AB、AC、BC)P值大于0.05,说明影响无显著性。两两交互因素对包封率的影响见图2。
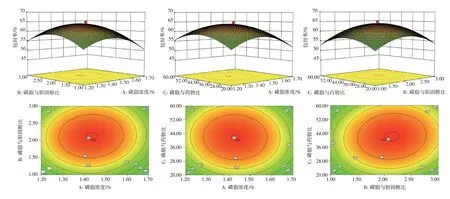
图2 影响白及多糖脂质体包封率的三维效应面图及二维等高线图Figure 2 Three-dimensional effector surface and two-dimensional contour map affecting encapsulation rate

表4 白及多糖脂质体处方优化试验的方差分析Table 4 Analysis of variance for prediction of prescription optimization test of BSP-Lip
2.4.3 优化处方验证 按上述处方优化结果制备了3 批BSP-Lip,测定其包封率。结果见表5。与预测结果的误差在5%以内,说明优选出的处方稳定可行。
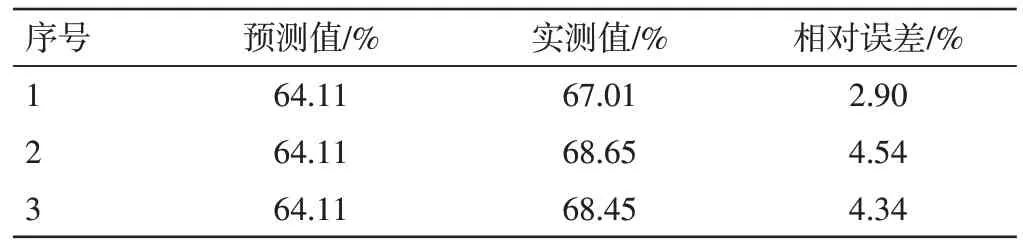
表5 白及多糖脂质体优化处方的验证结果Table 5 The validation results of aptimum prescription of BSPLip
2.5 BSP-Lip 制备工艺优化 采用单因素试验对BSP-Lip 乳化时间(2、5、8、10、12 min)、水化时间(20、40、60、90、120 min)、超声破碎时间(2、5、8、10、15 min)3 个因素的最佳时间进行筛选。结果见图3。制备工艺最终选取乳化时间10 min、水化时间40 min、超声粒径破碎时间10 min。2.5.1 BSP-Lip 最佳制备工艺验证 在最优工艺条件下,利用最佳处方制备的脂质体包封率相较于单一最佳条件下所制备的5 份脂质体,包封率均有提升,包封率分别为69.52%、68.95%、71.17%、68.41%、70.22%,RSD 值为1.4%,结果表明BSPLip 优化的制备工艺具有良好的重现性。按照上述方法计算后得出脂质体载药量为(0.93±0.013)%,药物的质量浓度为(334±7.3)μg·mL-1。
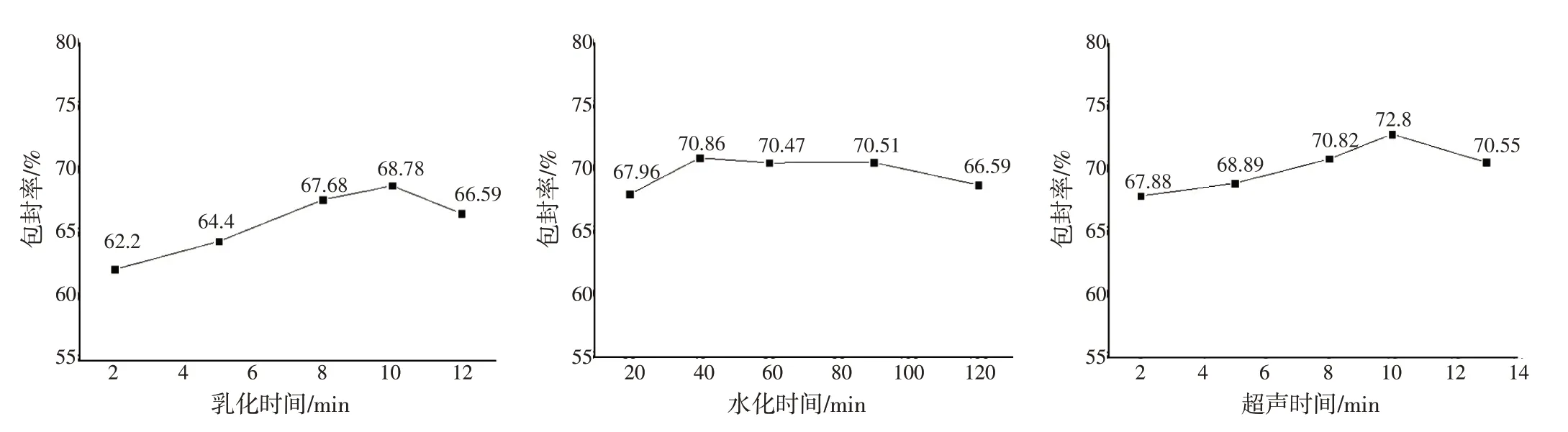
图3 乳化时间、水化时间、超声破碎时间对白及多糖脂质体包封率的影响Figure 3 Effects of emulsification time,hydration time and ultrasonication time on encapsulation efficiency of BSP-Lip
2.6 脂质体粒径、多分散系数(PDI)及Zeta 电位测定 取制备的BSP-Lip 稀释到适宜浓度(澄清透明),置入样品池中。使用Malvern 粒度分析装置检测粒径、PDI 及Zeta 电位,测得制剂的Zeta 电位为-(18±1.3)mV,平均粒径为(172.2±5.2)nm,PDI 为(0.241±0.104 0)。见图4、图5。

图4 白及多糖脂质体的粒径分布Figure 4 Particle size distribution of BSP-Lip

图5 白及多糖脂质体的Zeta 电位Figure 5 Zeta potential of BSP-Lip
2.7 体外释放试验[13]分别在透析袋(相对分子量8 000 ~14 000)中加入白及多糖脂质体混悬液和白及多糖PBS 溶液[14],放置于20 mL PBS 溶液中,在恒温33.0 ℃、磁力搅拌速度50 r·min-1条件下搅拌。分别在0.5、1、2、3、4、5、6、7、8、9、10、11、12 h 时取接收液0.5 mL,同时补充0.5 mL PBS,并用“2.2”项下方法测定接收液中白及多糖含量,以累积释放率为Y轴,时间为X轴绘制释放曲线。结果见图6。BSP 释放较快,第4 小时即达到药物释放平台期,第12 小时累积释放量为82.8%;BSP-Lip明显缓释,在第9 小时基本释放稳定,第12 小时累积释放量为52.2%。

图6 白及多糖脂质体和白及多糖累积释放曲线Figure 6 Cumulative release curves of BSP-Lip and BSP
将BSP-Lip 和BSP 的释放曲线分别进行零级方程(Q=kt+C)、一级方程(lnQ=klnt+C)、Higuchi 方程拟合。方程中Q为药物的累积释放率,k和C为释放常数,t为释放时间。拟合结果见表6。经分析BSP 体外释放符合零级释放方程拟合,释放过程以自由扩散为主;BSP-Lip 体外释放符合Higuchi 释放方程拟合,说明BSP 均匀分散在脂质体骨架结构中,释放过程不是简单的扩散过程,是溶蚀与扩散相结合。

表6 白及多糖脂质体和白及多糖体外释药曲线动力学模型拟合Table 6 Kinetic model fitting of in vitro drug release curves of BSP-Lip and BSP
2.8 体外经皮渗透试验[15]分别将等体积的BSP-Lip与BSP(334 μg·mL-1)分别加入容器中,取处理好的新鲜猪皮,根据扩散池的口径,裁剪成适宜大小,经检查无破损后,将猪皮表面(角质层)朝上,使真皮层与接受液充分接触;排除气泡,并使药液与角质层接触,设定温度为33 ℃,接收液(PBS)体积为4.5 mL,分别在0.5、1、2、3、4、5、6、7、8、9、10、11、12 h 取出0.5 mL 接收液;同时补充等体积PBS 并排除气泡,按“2.2”项下的方法检测BSP 含量,计算其累积透皮率。结果如图7 所示。BSP 累积透皮率为52.2%,BSP-Lip 累积透皮率18.06%,最后一个时间点取样后,将猪皮表面残留药物洗净,将猪皮剪碎浸泡于5 mL PBS 中24 h,测定BSP 含量,计算猪皮中BSP 的滞留量。

图7 白及多糖脂质体和白及多糖12 h 累积透皮率Figure 7 Cumulative transdermal absorption rate of BSP and BSP-Lip in 12 hours
方程拟合结果见表7。经分析BSP 体外经皮透过符合零级释放方程;BSP-Lip 体外释放符合Higuchi释放方程拟合,是扩散和相转移的综合过程,比起原料药释放更加稳定,说明在体外透皮试验中,BSP-Lip 可以长时间发挥疗效。BSP 与BSP-Lip 滞留量分别为13.5、33.8 μg·g-1。说明将白及多糖制成脂质体后可以增加其在皮肤中的滞留量,更好地发挥疗效。

表7 白及多糖(BSP)脂质体和白及多糖体外经皮释药曲线动力学模型拟合Table 7 Kinetic model fitting of BSP-LIP and BSP in vitro transdermal drug release curve of BSP-Lip and BSP
3 讨论
本研究在选择制备白及多糖脂质体(BSP-Lip)的方法时,分别比较了薄膜分散法、乙醇注入法和逆向蒸发法,结果表明,薄膜分散法、乙醇注入法制得的脂质体包封率在40% ~50%之间,远低于逆向蒸发法,且制得的脂质体不稳定、易沉淀,因此,最终选择逆向蒸发法。本研究在单因素试验的基础上通过响应曲面优化法对BSP-Lip 的制备工艺和处方进行了筛选和优化,经筛选后制备的脂质体包封率高,粒径小,PDI 较低,分布均匀,在体外释放中释放缓慢,在第9 小时基本释放稳定,比原料药更加缓释;体外经皮渗透试验中,BSP-Lip 滞留量为33.8 μg·g-1,相较于原料药透过量低,滞留量高,可以长时间停留在皮肤中发挥药效,可作为缓控透皮制剂进行开发,也为其他水溶性强、极性大的化合物的研究提供了借鉴参考。

