不同剂量养心通脉有效部位方对心肌缺血再灌注损伤模型大鼠心肌线粒体代谢相关酶及其转运的影响
尹梦影,曹伟,胡鑫,郑景辉,莫云秋
研究显示,冠心病是心血管疾病的首要死亡原因,其主要治疗方式是对心肌进行早期再灌注[1-2]。而再灌注可导致心肌线粒体功能紊乱,进而损伤心功能。心肌缺血再灌注损伤(myocardial ischemia-reperfusion injury,MIRI)指心肌血供短暂中断后又迅速恢复正常,导致心肌能量代谢障碍、心肌细胞结构改变等进一步加重的现象[3],故修复受损的线粒体是其重要的治疗手段。养心通脉方是由我国著名中医学家秦伯未先生运用“扶养心气,和通血脉”之法治疗胸痹心痛的有效名方,而养心通脉有效部位方(active principle region of Yangxin Tongmai formula,apr-YTF)能促进心肌线粒体的修复,其有效成分——人参皂苷、丹参酮ⅡA、总生物碱、人参多糖、复方多糖、总挥发油等与养心通脉方相似[4]。但与养心通脉方相比,apr-YTF中的活性成分更加丰富,其可以降低用药剂量,提高抗MIRI的疗效[5]。本研究旨在分析不同剂量apr-YTF对MIRI模型大鼠心肌线粒体代谢相关酶及其转运的影响,以期为采用apr-YTF防治MIRI提供实验依据。
1 材料与方法
1.1 实验时间 本实验时间为2020年6月至2021年6月。
1.2 实验动物 健康雄性Wistar大鼠95只,体质量为180~220 g,购自广西中医药大学实验动物中心,许可证号:SCXK(湘)2019-0013。大鼠在SPF级实验中心常规饲养,饲养条件如下:5只大鼠为一笼,温度控制在22~25 ℃,相对湿度为35%,大鼠自由饮水,常规饲料,不限制进食,实验室灯光为12 h/12 h日夜交替。
1.3 实验药物 apr-YTF由人参20 g、桂枝15 g、生地15 g、丹参25 g、泽泻10 g组成,统一由广西中医药大学附属瑞康医院采购,药材均为同一批次。将方剂放入圆底烧瓶内煎煮,首煎加8倍水,煮45 min;二煎加4倍水,煮30 min;搅拌均匀后用武火烧开,制成apr-YTF。冠心苏合丸由北京同仁堂科技发展股份有限公司中药厂生产(批号:Z11021184,每10丸8.5 mg)。
1.4 实验仪器与试剂 病理组织切片机购自Thermo Fisher Scientific公司,光学显微镜购自OLYMPUS,动物心电监护仪购自美国SurgiVet公司,小动物呼吸机、小动物麻醉机及手术器械购自Harvard Bioscience公司,全自动血液细胞分析仪购自上海涵飞医疗器械有限公司,KE-300S血液流变仪购自上海康美国际生化有限公司,Tecan Infinite 200Pro酶标仪购自上海迪奥生物科技有限公司,1658033型电泳仪、电转仪和电源购自美国Bio-Rad公司。
注射用青霉素钠购自华北制药股份有限公司,异氟烷购自深圳市瑞沃德生命科技有限公司,4%多聚甲醛通用型组织固定液购自Biosharpa;苏木素、伊红染色试剂购自上海蓝季科技发展有限公司,肌酸激酶同工酶(creatine kinase isoenzymes,CK-MB)、心肌肌钙蛋白I(cardiac troponin I,cTnI)、乳酸脱氢酶(lactate dehydrogenase,LDH)、磷酸果糖激酶1(phosphofructokinase 1,PFK1)、琥珀酸脱氢酶(succinate dehydrogenase,SDH)、腺苷酸转运体(adenine nucleotide translocator,ANT)、异枸橼酸脱氢酶(isocitrate dehydrogenase,IDH)ELISA试剂盒及ATP含量生化试剂盒购自江苏酶免实业有限公司,肿瘤坏死因子α诱导蛋白2(tumor necrosis factor alpha-induced protein 2,TNFαIP2)抗体购自武汉贝茵莱生物科技有限公司(Bioswamp),MIRO1抗体购自NOVUS公司。
1.5 实验方法
1.5.1 分组及干预方法 将70只健康雄性Wistar大鼠随机分为空白对照组、模型组、阴性对照组、阳性对照组及apr-YTF低、中、高剂量组,每组10只。除空白对照组外,其他组大鼠构建MIRI模型,具体方法为:将大鼠采用仰卧位固定于手术台,采用异氟烷进行持续呼吸麻醉,待大鼠呼吸平稳后,连接动物心电监护仪,实时观测心电图变化情况;将大鼠经背位固定,充分暴露气管后进行气管插管,并连接小动物呼吸机,大鼠呼吸频率与呼吸机一致表明气管插管成功;于胸前左侧第3~4肋备皮消毒,逐层剥离并充分暴露心脏,于左心耳下缘用7-0 mm可吸收线结扎左冠状动脉前降支,结扎完成后将心脏迅速放回胸腔内;结扎30 min后进行再灌注2 h。心电图导联ST段弓背向上抬高说明造模成功。缝合胸壁,待大鼠呼吸频率稳定后暂停机械通气以恢复其自主呼吸。如无异常,将大鼠放回干净笼内,密切观察大鼠生命体征。术后常规应用注射用青霉素钠3 d以预防感染。造模期间,各组大鼠共死亡25只,为保证实验完整性,补充造模至每组10只。造模完成后,空白对照组及模型组大鼠正常饲养,阴性对照组大鼠给予0.9%氯化钠溶液灌胃,阳性对照组大鼠给予冠心苏合丸灌胃,apr-YTF低、中、高剂量组大鼠分别给予1.5、3.0、6.0 ml apr-YTF灌胃〔以成年人体质量60 kg为标准,根据实验动物剂量换算方法计算给药量,大鼠给药量(g/kg)=成人给药量(g/kg)×6.3〕,1次/d,不限制饮水、进食,分笼饲养,共干预2周。
1.5.2 血液流变学指标、血清心肌梗死标志物水平检测方法 造模24 h后,从空白对照组与模型组中随机选取3只大鼠,采用5%水合氯醛(0.01 ml/g)腹腔注射进行麻醉,待大鼠疼痛反射消失后采集其腹主动脉血液5 ml,室温静置2 h后4 000 r/min离心15 min(离心半径8.6 cm),取上清液备用。采用KE-300S血液流变仪检测血液流变学指标,包括全血低切、中切、高切黏度,严格按照试剂盒说明书进行操作。采用ELISA检测血清心肌梗死标志物水平,包括CK-MB、cTnI、LDH水平,严格按照试剂盒说明书进行操作。
1.5.3 心肌组织病理学检查 造模第14天,随机选取各组大鼠3只,采用5%水合氯醛(0.01 ml/g)腹腔注射进行麻醉;待大鼠疼痛反射消失后剪开胸腔,取出心脏,采用0.9%氯化钠溶液冲洗干净,使用4%多聚甲醛通用型组织固定液固定标本;取适量心肌组织并采用10%多聚甲醛溶液浸泡过夜,采用PBS清洗,进行乙醇梯度脱水、二甲苯透明,放入蜡块浸渍,采用病理组织切片机将蜡块切成3~5 μm的薄片,将切片放于热水上,将石蜡融化展于玻片上,封固,采用苏木素、伊红染色试剂进行染色;将玻片置于光学显微镜下,观察心肌组织病理学变化情况。
1.5.4 线粒体代谢相关酶水平检测方法 造模第14天,随机选取各组大鼠6只,采用5%水合氯醛(0.01 ml/g)腹腔注射进行麻醉,待大鼠疼痛反射消失后采集腹主动脉血液5 ml;室温静置2 h后4 000 r/min离心15 min(离心半径8.6 cm),取上清液备用。采用比色法检测ATP水平,采用ELISA检测PFK1、SDH、ANT、IDH水平,严格按照试剂盒说明书进行操作。
1.5.5 心肌组织中TNFαIP2、MIRO1表达水平检测方法 造模第14天,随机选取各组大鼠3只,采用5%水合氯醛(0.01 ml/g)腹腔注射进行麻醉,待大鼠疼痛反射消失后剪开胸腔,取出心脏,用0.9%氯化钠溶液冲洗干净,使用4%多聚甲醛通用型组织固定液固定标本;取适量左心室心肌组织,用液氮快速冷冻,于-80 ℃环境下保存备用;采用Western blot法检测心肌组织中TNFαIP2、MIRO1表达水平,方法如下:采用裂解液于冰上裂解心肌组织,研磨后14 000 r/min离心3 min(离心半径10 cm),取上清液;进行蛋白定量及变性、电泳、转膜、封闭、TBST洗涤,加入TNFαIP2及MIRO1一抗(1∶1 000)孵育过夜,加入二抗(1∶5 000)室温孵育1 h,进行ECL显影;采用Image J软件进行条带灰度分析,以目标蛋白与β-actin的比值作为目标蛋白表达水平。
1.6 统计学方法 采用Graphpad Prism 8.0统计学软件进行数据分析。计量资料以(±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 血液流变学指标、血清心肌梗死标志物水平 模型组全血低切、中切黏度及血清CK-MB、cTnI、LDH水平高于空白对照组,差异有统计学意义(P<0.05);空白对照组与模型组全血高切黏度比较,差异无统计学意义(P>0.05),见表1。
表1 空白对照组与模型组血液流变学指标、血清心肌梗死标志物水平比较(±s,n=3)Table 1 Comparison of hemorheology indexes and serum myocardial infarction marker levels between blank control group and model group
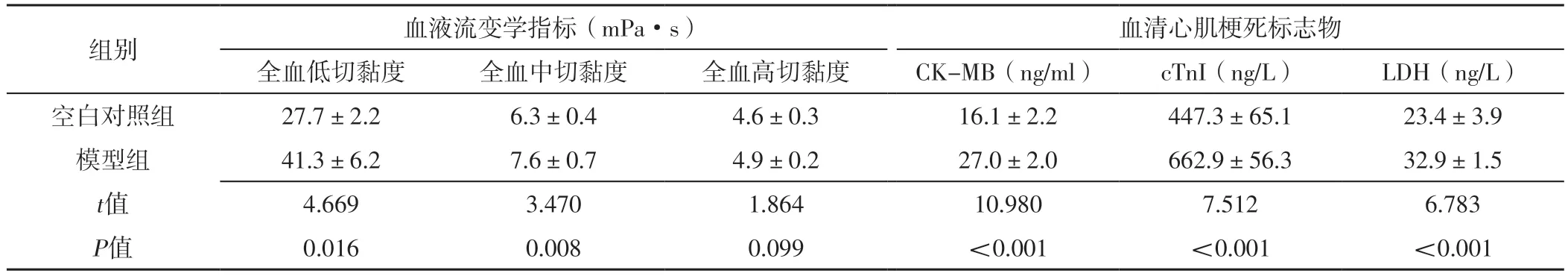
表1 空白对照组与模型组血液流变学指标、血清心肌梗死标志物水平比较(±s,n=3)Table 1 Comparison of hemorheology indexes and serum myocardial infarction marker levels between blank control group and model group
注:CK-MB=肌酸激酶同工酶,cTnI=心肌肌钙蛋白I,LDH=乳酸脱氢酶
组别血液流变学指标(mPa·s)血清心肌梗死标志物全血低切黏度全血中切黏度全血高切黏度CK-MB(ng/ml)cTnI(ng/L)LDH(ng/L)空白对照组27.7±2.26.3±0.44.6±0.316.1±2.2447.3±65.123.4±3.9模型组41.3±6.27.6±0.74.9±0.227.0±2.0662.9±56.332.9±1.5 t值4.6693.4701.86410.9807.5126.783 P值0.0160.0080.099<0.001<0.001<0.001
2.2 心肌组织病理学检查 空白对照组大鼠心肌组织结构完整,心肌纤维组织整齐有序,细胞核形态正常;模型组大鼠心肌纤维断裂,排列紊乱,大量细胞核分布于细胞外,心肌间质中可见炎症细胞浸润、水肿;阴性对照组可见心肌纤维断裂;与模型组相比,阳性对照组及apr-YTF低、中、高剂量组心肌水肿明显减轻,炎症细胞数量明显减少,见图1。
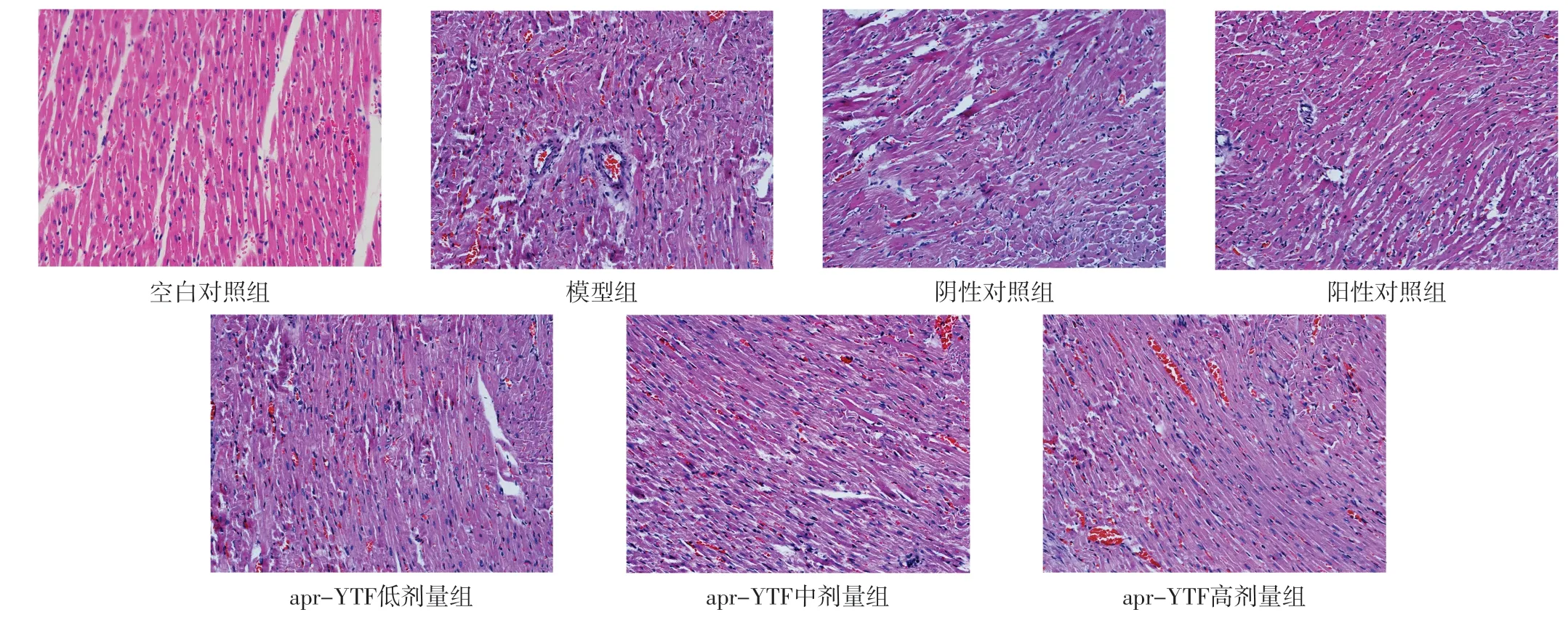
图1 七组大鼠心肌组织病理学检查结果(HE染色,×20)Figure 1 Histopathology examination results of myocardium in seven groups
2.3 线粒体代谢相关酶水平 七组ATP、PFK1、SDH、ANT、IDH水平比较,差异有统计学意义(P<0.05)。模型组ATP水平低于空白对照组,模型组、阴性对照组PFK1、SDH、ANT、IDH水平高于空白对照组,差异有统计学意义(P<0.05);阴性对照组、阳性对照组及apr-YTF低、中、高剂量组ATP水平高于模型组,阳性对照组及apr-YTF中、高剂量组PFK1、ANT、IDH水平低于模型组,阳性对照组及apr-YTF低、中、高剂量组SDH水平低于模型组,差异有统计学意义(P<0.05);apr-YTF低剂量组ATP、ANT水平高于阳性对照组,apr-YTF低、中剂量组PFK1、IDH水平高于阳性对照组,差异有统计学意义(P<0.05);apr-YTF中剂量组ATP水平低于apr-YTF低剂量组,apr-YTF中、高剂量组PFK1、ANT、IDH水平低于apr-YTF低剂量组,apr-YTF高剂量组SDH水平低于apr-YTF低剂量组,差异有统计学意义(P<0.05),见表2。
表2 七组线粒体代谢相关酶水平比较(±s,n=6)Table 2 Comparison of mitochondrial metabolism-related enzyme levels in seven groups

表2 七组线粒体代谢相关酶水平比较(±s,n=6)Table 2 Comparison of mitochondrial metabolism-related enzyme levels in seven groups
注:PFK1=磷酸果糖激酶1,SDH=琥珀酸脱氢酶,ANT=腺苷酸转运体,IDH=异枸橼酸脱氢酶,apr-YTF=养心通脉有效部位方;a表示与空白对照组比较,P<0.05;b表示与模型组比较,P<0.05;c表示与阳性对照组比较,P<0.05;d表示与apr-YTF低剂量组比较,P<0.05
组别ATP(U/mg)PFK1(U/L)SDH(U/mg)ANT(pg/ml)IDH(U/L)空白对照组2.6±0.656.2±13.6154.0±17.4127.7±15.216.3±2.5模型组0.7±0.1a202.0±28.0a276.7±26.7a338.2±40.8a64.7±7.5a阴性对照组3.3±0.6b202.6±14.5a272.8±49.4a344.9±20.2a67.3±3.6a阳性对照组1.6±0.8b101.9±41.5b198.4±34.9b198.2±51.7b32.3±13.2b apr-YTF低剂量组2.5±0.7bc176.7±27.4c226.9±39.5b308.8±41.8c58.5±9.1c apr-YTF中剂量组1.7±0.4bd137.8±25.6bcd206.2±37.6b243.7±37.6bd43.6±8.6bcd apr-YTF高剂量组1.8±0.7b125.1±31.9bd181.3±31.3bd228.9±50.0bd41.7±10.3bd F值23.4946.6220.2750.2056.22 P值<0.001<0.001<0.001<0.001<0.001
2.4 心肌组织中TNFαIP2、MIRO1表达水平 七组心肌组织中TNFαIP2、MIRO1表达水平比较,差异有统计学意义(P<0.05)。模型组、阴性对照组心肌组织中TNFαIP2表达水平高于空白对照组,心肌组织中MIRO1表达水平低于空白对照组,差异有统计学意义(P<0.05);阳性对照组及apr-YTF中、高剂量组心肌组织中TNFαIP2表达水平低于模型组,阳性对照组及apr-YTF低、中、高剂量组心肌组织中MIRO1表达水平高于模型组,差异有统计学意义(P<0.05);apr-YTF低剂量组心肌组织中TNFαIP2表达水平高于阳性对照组,apr-YTF低、中、高剂量组心肌组织中MIRO1表达水平低于阳性对照组,差异有统计学意义(P<0.05);apr-YTF中、高剂量组心肌组织中TNFαIP2表达水平低于apr-YTF低剂量组,差异有统计学意义(P<0.05),见表3。
表3 七组心肌组织中TNFαIP2、MIRO1表达水平比较(±s,n=3)Table 3 Comparison of expression levels of TNFαIP2 and MIRO1 in myocardial tissue in seven groups

表3 七组心肌组织中TNFαIP2、MIRO1表达水平比较(±s,n=3)Table 3 Comparison of expression levels of TNFαIP2 and MIRO1 in myocardial tissue in seven groups
注:TNFαIP2=肿瘤坏死因子α诱导蛋白2;a表示与空白对照组比较,P<0.05;b表示与模型组比较,P<0.05;c表示与阳性对照组比较,P<0.05;d表示与apr-YTF低剂量组比较,P<0.05
组别TNFαIP2MIRO1空白对照组0.37±0.110.99±0.07模型组1.11±0.08a0.75±0.11a阴性对照组0.99±0.15a0.72±0.08a阳性对照组0.64±0.06b1.23±0.07b apr-YTF低剂量组1.10±0.11c0.98±0.05bc apr-YTF中剂量组0.52±0.03bd1.05±0.06bc apr-YTF高剂量组0.49±0.04bd1.06±0.02bc F值35.1420.09 P值<0.001<0.001
3 讨论
线粒体是决定心肌细胞生存率的重要因素,而心肌缺血缺氧会损伤线粒体功能,进而影响心肌细胞的正常运转,因而线粒体功能与MIRI息息相关[6]。MIRI期间心肌的缺血缺氧会导致心肌细胞内的线粒体产生大量的活性氧(reactive oxygen species,ROS),从而导致钙超载、氧化应激等[7],在这些因素协同作用下机体发生线粒体膜电位紊乱、细胞中ATP生成减少、糖酵解反应增强以及氧化磷酸化解偶联[8],其实质是三大物质代谢紊乱导致心肌能量发生改变,主要表现为脂肪酸的β氧化转向糖酵解,导致心肌障碍、心脏超微结构及功能的异常[9]。研究表明,心肌能量代谢被破坏以及线粒体功能障碍与心肌重塑相关,而减少缺血再灌注对线粒体的损伤是提高心肌缺血患者治疗效果、改善其预后的重要措施[10]。养心通络方具有“扶养心气,和通血脉”的作用,其最早在1989年被用于治疗冠心病心绞痛[11]。临床研究表明,养心通络方治疗冠心病心绞痛的有效率较高[4]。本课题组前期研究表明,apr-YTF不仅具有明显的抗心肌缺血、加快血液流动速率、抗动脉粥样硬化的作用,而且对于线粒体损伤有一定的修复作用[12]。本研究旨在分析不同剂量apr-YTF对MIRI模型大鼠心肌线粒体代谢相关酶及其转运的影响。
在血液流变学中,血浆黏度指标中的任何一项高于参考范围即可判定为血液流变学异常。心肌受损后机体的泵血功能会发生改变,血流速度减慢并处于高凝状态[13]。血清CK-MB、cTnI、LDH是反映心肌坏死的标志物,对于判断病情的严重程度和预后极为重要。研究表明,MIRI模型大鼠心肌细胞膜的通透性增大,从而释放大量CK-MB、LDH和cTnI到血清中,进而加重大鼠心肌缺血缺氧[14]。本研究结果显示,模型组全血低切、中切黏度及血清CK-MB、cTnI、LDH水平高于空白对照组,提示模型组大鼠血液处于高凝状态,且心肌受损,再次验证MIRI模型构建成功。
本研究心肌组织病理学检查结果显示,空白对照组大鼠心肌组织结构完整,心肌纤维组织整齐有序,细胞核形态正常;模型组大鼠心肌纤维断裂,排列紊乱,大量细胞核分布于细胞外,心肌间质中可见炎症细胞浸润、水肿;阴性对照组可见心肌纤维断裂;与模型组相比,阳性对照组及apr-YTF低、中、高剂量组心肌水肿明显减轻,炎症细胞数量明显减少;提示apr-YTF可减轻MIRI模型大鼠的心肌损伤程度。
研究显示,心肌长时间缺氧可导致线粒体相关代谢酶活性降低、ATP耗竭及心肌收缩功能受损;无氧条件下机体主要通过糖酵解产生ATP,因此,在心肌缺血缺氧期间,心肌的能量来源主要依靠糖酵解[15]。而PFK是糖酵解过程中的关键酶[16]。SDH和IDH是有氧氧化的关键酶,不仅可反映有氧氧化水平,还可反映心肌线粒体相关代谢酶活性[17]。ANT在线粒体能量生成及利用的过程中发挥着关键作用,其影响着整个细胞能量代谢的全过程[18]。本研究结果显示,模型组ATP水平低于空白对照组,PFK1、SDH、ANT、IDH水平高于空白对照组,提示MIRI模型大鼠存在线粒体能量代谢功能障碍。本研究结果还显示,阳性对照组及apr-YTF低、中、高剂量组ATP水平高于模型组,SDH水平低于模型组;阳性对照组及apr-YTF中、高剂量组PFK1、ANT、IDH水平低于模型组;提示不同剂量apr-YTF均可有效减轻MIRI模型大鼠线粒体能量代谢功能障碍。此外,apr-YTF中、高剂量组PFK1、ANT、IDH水平低于apr-YTF低剂量组,apr-YTF高剂量组SDH水平低于apr-YTF低剂量组,而apr-YTF中、高剂量组ATP、PFK1、SDH、ANT、IDH水平比较差异无统计意义,提示中剂量(3.0 ml)、高剂量(6.0 ml)apr-YTF减轻MIRI模型大鼠线粒体能量代谢功能障碍的效果相似,且优于低剂量(1.5 ml)apr-YTF。
心肌缺血再灌注时过度的氧化应激可使细胞内ROS增多和细胞膜的通透性增大,从而导致线粒体功能障碍[16]。心肌发生急性炎症反应时会释放大量的TNFαIP2,同时产生大量的ROS自由基,从而损伤线粒体内膜[19]。MIRO1为线粒体衔接蛋白,定位于线粒体外膜上,线粒体损伤后MIRO1发生磷酸化和泛素降解使受损的线粒体与微管分离,从而诱导线粒体功能障碍[20]。本研究结果显示,模型组心肌组织中TNFαIP2表达水平高于空白对照组,MIRO1表达水平低于空白对照组,提示MIRI模型大鼠可能存在线粒体转运障碍;阳性对照组及apr-YTF中、高剂量组心肌组织中TNFαIP2表达水平低于模型组,阳性对照组及apr-YTF低、中、高剂量组心肌组织中MIRO1表达水平高于模型组,apr-YTF中、高剂量组心肌组织中TNFαIP2表达水平低于apr-YTF低剂量组,而apr-YTF中、高剂量组心肌组织中TNFαIP2、MIRO1表达水平比较差异无统计学意义,提示不同剂量apr-YTF均可有效减轻MIRI模型大鼠线粒体转运障碍,且中剂量(3.0 ml)、高剂量(6.0 ml)apr-YTF的效果相似,均优于低剂量(1.5 ml)apr-YTF。
综上所述,不同剂量apr-YTF均可有效改善MIRI模型大鼠心肌线粒体代谢相关酶,进而减轻线粒体能量代谢功能障碍,其还可减轻线粒体转运障碍;且中剂量(3.0 ml)、高剂量(6.0 ml)apr-YTF的效果相似,均优于低剂量(1.5 ml)apr-YTF。但本研究为基础实验,样本量较小,尚需要大样本量的临床试验进一步验证本研究结论。
作者贡献:尹梦影进行研究的构思与设计、实施与可行性分析,论文撰写及修订,数据分析;曹伟、胡鑫进行数据收集;郑景辉、莫云秋负责质量控制及审校;莫云秋对文章整体负责,监督管理。
本文无利益冲突。

