贵州省串核桃雌花芽分化期生理特性变化
李小永 田小琴

摘要 本研究通過测定串核桃雌花芽分化过程中抗氧化酶、可溶性蛋白、糖和淀粉等营养物质,揭示其花芽分化过程中生理特性的变化规律,为串核桃花芽分化时期营养调控提供科学依据。结果表明,串核桃雌花芽分化进程中POD活性自4月中旬穗状花序原基开始分化时逐渐增强,5月中旬花柄和雌花原基开始分化时,POD活性达到最大值,在7月中旬苞片和花被分化期有所下降,随着气温下降,POD活性迅速降低,第2年气温回升时POD活性又有所上升。SOD活性在整个花芽分化时期处于一个较为稳定的状态,对花芽分化的影响不明显。可溶性淀粉含量在进入休眠时达积累最大值,随着气温逐渐下降,早春淀粉又重新积累,在4月底至5月初出现一个积累小高峰之后,于7月份又不断下降。可溶性糖含量在4月中下旬逐渐降低,5月中下旬开始上升,此高含量的状况一直持续到7月中下旬,在此阶段中雌花芽进行了一系列的花芽分化。
关键词 串核桃;雌花芽;生理特性
中图分类号 S664.101 文献标识号 A
文章编号 1007-7731(2023)08-0090-04
Changes of Physiological Characteristics during Female Flower Bud Differentiation of
Walnut in Guizhou Province
LI Xiaoyong1 TIAN Xiaoqin2*
(1Guizhou Forestry Survey and Planning Institute, Guiyang Guizhou 550005;
2Guizhou Walnut Research Institute, Guiyang Guizhou 550005)
Abstract In this study, the changes of antioxidant enzymes, soluble protein, sugar content, starch and other nutrients in the process of female flower bud differentiation of Chuanwalnut were measured to reveal the changes of physiological characteristics in the process of flower bud differentiation. It provides a research basis for exploring the regulation of flowering stage of Chuanwalnut in production. The results showed that the POD activity in the process of female flower bud differentiation of Walnut increased gradually since the spike primordium began to differentiate in the middle of April. When the flower stalk and female flower primordium began to differentiate in the middle of May, the POD activity reached the maximum value. In the middle of July, the bud and perianth differentiation period decreased. With the decrease of air temperature, the POD activity rapidly decreased, and the POD activity increased when the temperature rose in the next year. SOD activity was in a relatively stable state during the whole flower bud differentiation period, and had no obvious effect on flower bud differentiation. The content of soluble starch reached the maximum when it entered dormancy. With the temperature decreasing, it gradually decreased, and starch accumulated again in early spring. At the end of April and the beginning of May, there was a small accumulation peak, and then it continued to decline in July. The content of soluble sugar gradually decreased in the middle and late April, and began to increase in the middle and late May. This high content continued until the middle and late July. In this stage, the female flower buds underwent a series of flower bud differentiation.
Keywords walnut; female flower bud; physiological characteristics
花芽生理分化主要是积累组建花芽的营养物质以及激素调节物质、遗传物质等共同协调作用的过程,是各种物质在生长点细胞群中,从量变到质变的过程,是为形态分化奠定的物质基础[1]。超氧物歧化酶(SOD)和过氧化物酶(POD)广泛存在于植物体中,是活性较高的一种酶,与植物的呼吸作用、光合作用及花芽分化都有关系,在植物生长的不同阶段SOD、POD活性不断发生变化[2]。李兴军等[3]对杨梅小年树花芽孕育的研究中发现,POD到花芽分化盛期活性达到高峰。蒋欣梅等[4]在研究低温处理青花菜萌动种子对花芽分化促进作用时发现,多次低温处理绿体春化过程中,叶片中POD活性较低,当植株进入花芽分化临界期时,活性开始明显上升。可溶性糖是植物新陈代谢的基础,是植物在生长发育过程中重要的能量来源,可为植物的生长发育提供能量,是植物生长发育和基因表达的重要调节因子[5]。可溶性蛋白作为重要的营养物质和渗透调节物质,它们的增加和积累能提高细胞的保水能力,对细胞的生命物质及生物膜起到保护作用。研究发现,草莓在开花前可溶性糖和淀粉含量处于高水平,随着顶芽转入花芽分化状态,被大量消耗,在第二花序分化前又升高,进入第二花序原始体大量分化时又再次降低[6]。樊卫国等[7]对刺梨进行花芽分化的研究发现,在花芽分化各个时期,花芽中的淀粉和可溶性糖的含量都明显高于叶芽。吴月燕等[8]也指出可溶性糖和淀粉的含量与花芽分化有很大的相关性,叶片中淀粉积累有利于花芽分化。郑焕娣等[9]指出花芽分化需要较高的可溶性糖,在花芽分化期可溶性糖呈连续上升趋势,在分化末期达到一个高水平。李兴军等[3]研究发现,杨梅花芽分化前叶片内可溶性总糖等营养为花芽发端提供了物质基础。钟晓红等[10]在奈李的花芽分化研究中发现,叶片中可溶性糖的含量在生理分化期出现高峰,一旦进入形态分化期则大量消耗。郭金丽等[11]研究发现,在苹果梨花芽生理分化期,成花短枝中可溶性蛋白质大量上升,在形态分化期花芽各个花器官原基富含大量蛋白质,而成花短枝中蛋白质含量开始下降。
串核桃是贵州乡土品种的一个优良类型,又名葡萄核桃,每雌花序着生5~30朵雌花,穗状果序,最多可达30个以上[12]。目前,串核桃生产中存在严重的落花落果现象,其中一个重要的原因是在花芽分化过程中雌花芽数量没有雄花芽数量多,雄花芽分化及发育过程中消耗了大量的树体养分,从而进一步限制了雌花芽的生长发育,导致坐果率低。前人对串核桃的分布已进行了相关描述[13-22],但对于串核桃雌花芽分化期生理特性尚未进行系统研究。为此,笔者前期开展了串核桃雌花芽分化不同时期外观特性、雌花芽分化内部结构变化、雌花芽分化内源激素和多胺含量变化等相关研究[15-17]。本研究在前期研究的基础上,对串核桃雌花芽不同分化时期可溶性蛋白和酶活性等生理指标进行了测定,旨在弄清串核桃抗氧化酶与营养物质等生理指标与雌花芽分化的关系,为串核桃花芽分化时期的营养调控提供科学指导。
1 材料与方法
1.1 试验材料
在贵州省串核桃代表地选择生长正常、无病虫害的串核桃植株。取样时间为:①3月上旬至5月下旬,1次/10 d,6~10 粒/次;②6月上旬至9月上旬,1次/30 d,6~10 粒/次;③9月中旬至次年2月下旬采1次,1次/30 d,6~10 粒/次。采集的花芽用冰袋带回实验室。
1.2 试验方法
1.2.1 串核桃雌花芽分化时期的确定。串核桃雌花芽分化时期的确定参照文献[16]。
1.2.2 可溶性蛋白、糖和淀粉的测定。可溶性蛋白用考马斯亮蓝法进行测定,考马斯亮蓝G-250測定蛋白质含量属于染料结合法的一种。考马斯亮蓝G-250在游离态下呈红色,当它与蛋白质的疏水区结合后变为青色,前者最大光吸收在465 nm,后者在595 nm。在一定蛋白质浓度范围内,蛋白质—色素结合物在595 nm波长下的光吸收与蛋白质含量成正比。可溶性糖和淀粉含量的测定采用蒽酮比色法,在强酸条件下,蒽酮与可溶性糖(包括还原性糖和非还原性糖)作用生成蓝绿色糖醛衍生物,该蓝绿色颜色深浅与含糖量成正比,可在625 nm下进行比色测定。
1.2.3 植物抗氧化酶指标的测定。超氧物歧化酶(SOD)抑制氮蓝四唑(NBT)在光下的还原作用来确定酶活性大小;过氧化物酶(POD)能使愈创木酚氧化,生成茶褐色物质,该物质在470 nm处有最大吸收,可用分光光度计测量470 nm的吸光度变化,测定过氧化物酶活性。
1.2.4 数据处理。采用Excel 2007和SPSS软件对数据进行统计分析。
2 结果与分析
2.1 SOD总活性和POD活性变化
由图1可以看出,串核桃雌花芽分化进程中POD活性自4月中旬穗状花序原基开始分化时逐渐增强,5月中旬花柄和雌花原基开始分化时,POD活性达到最大值,表明POD活性增强有利于其雌花原基和花柄原基的分化;在7月中旬苞片和花被分化期有所下降,随着气温下降,雌花花芽分化相继进入休眠状态,POD 活性迅速降低,第2年气温回升时,雌蕊分化开始直至雌花开放,POD活性有所上升。SOD活性在整个花芽分化时期相比POD处于一个较为稳定的状态,穗状花序原基开始分化至花柄和雌花原基开始分化时,SOD活性升高,到苞片和花被分化期时轻微下降,雌花开放时期迅速下降。
2.2 可溶性蛋白、糖和淀粉含量的变化
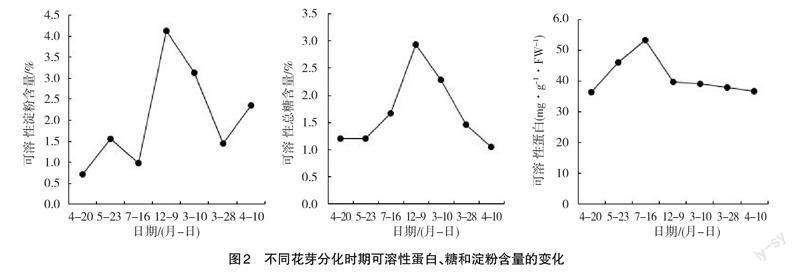
串核桃雌花芽穗状花序原基开始分化时可溶性淀粉含量最低,花柄和雌花原基分化期有所升高,苞片和花被分化期又降低,树体休眠期可溶性淀粉含量达到峰值。春季解除休眠萌芽后,雌蕊开始分化,雌花继续膨大,雌花芽中可溶性淀粉含量开始下降,直至雌花分化完成可溶性淀粉含量才开始上升。高含量的可溶性糖是串核桃雌花花芽分化的重要能量基础,高含量的可溶性糖保证了高质量成花。可溶性总糖含量从雌花芽穗状花序原基开始分化时逐渐开始上升,至休眠期达峰值,雌蕊分化期至雌花开放期总糖含量逐渐下降(图2)。
4月中下旬穗状花序原基开始分化时,可溶性糖含量逐渐降低,可溶性蛋白质分解为可溶性糖提供花芽分化过程中所需的能量,在5月中下旬花柄和雌花原基开始分化时,为保证花芽分化时花器官各原基形态分化进程的顺利进行蛋白质在花芽中开始大量积累。这种高含量的状况一直持续到7月中下旬苞片和花被分化期,这时期雌花芽进行了一系列的花芽分化,说明高含量的可溶性蛋白质是串核桃雌花芽分化顺利进行的物质基础。此后随着气温下降,雌花芽分化相继进入休眠状态,其含量下降,第2年雌花形成和开放时,可溶性蛋白含量持续下降直到5月中旬才开始大量积累。
3 结论与讨论
串核桃雌花芽在休眠期时可溶性淀粉含量出现峰值,第2年春年气温开始回升后淀粉又重新开始积累。这是因为休眠时期串核桃花芽分化暂时停止,消耗能量减少,在4月底至5月初出现一个积累小高峰之后在7月份又不断下降,猜测此时光合作用很弱,合成的可溶性糖少,需要可溶性淀粉转化为可溶性糖来满足花芽分化过程中需要的能量,从而导致淀粉含量持续下降。该期间串核桃雌花芽花萼原基陆续进入分化状态,需要大量的可溶性糖提供能量,而此时串核桃叶片光合作用弱,不能及时合成花芽分化所需的大量可溶性糖,为保障串核桃雌花芽分化的正常进程,需要可溶性淀粉水解为糖以提供能量。蛋白质是植物花器官形态建成的重要物质基础,4月中下旬,叶片光合作用弱,可溶性糖含量逐漸降低,可溶性蛋白质分解为可溶性糖提供花芽分化过程中所需的能量,5月中下旬,蛋白质在花芽中开始大量积累,保证花芽分化时花器官各原基形态分化进程的顺利进行,此高含量的状况一直持续到7月中下旬,此时期雌花芽进行了一系列的花芽分化。这说明高含量的可溶性蛋白质是花芽分化顺利进行的物质基础;随着气温下降,雌花的花芽分化相继进入休眠状态,其含量下降,第2年雌花形成和开放时,可溶性蛋白含量持续下降直到5月中旬才开始大量积累。POD活性增强有利于其雌花原基和花柄原基的分化,SOD活性在整个花芽分化时期处于一个较为稳定的状态,对花芽分化影响不明显。
目前,对植物花芽分化过程中生理生化指标的含量变化规律的研究虽然很多,但是在花芽分化过程中,蛋白质、淀粉、可溶性糖、核酸等含量变化各有规律,不同植物差异也比较大,尚未形成一个具有普遍指导意义的理论,故此关于花芽生理分化机理的研究至今还不明晰[16]。
4 参考文献
[1] 陈晨,喻方圆.林木花芽分化研究进展[J].林业科学,2020(9):119-129.
[2] 邹琦.植物生理学实验指导[M].北京:中国农业出版社,2000.
[3] 李兴军,李三玉,汪国云,等.杨梅花芽孕育期间叶片酸性蔗糖酶活性及糖类含量的变化[J].四川农业大学学报,2000,18(2):164-166.
[4] 蒋欣梅,于锡宏.低温处理青花菜萌动种子对花芽分化的促进作用[J].生物学学报,2004,30(4):421-427.
[5] 朱德民.植物生长与耐盐性[J].科学农业(台),1982,30(3-4):202.
[6] 罗充,彭抒昂,马林涛.草莓成花过程中Ca,Ca M及成花物质含量变化[J].山地农业生物学报,2000,9(4):266-271.
[7] 樊卫国,刘国琴,安花明,等.刺梨花芽分化期芽中内源激素和碳、氮营养的含量动态[J].果树学报,2003,20(1):40-43.
[8] 吴月燕,李培民,吴秋峰.葡萄叶片内碳水化合物及蛋白质代谢对花芽分化的影响[J].浙江万里学院学报,2002,15(4):54-57.
[9] 郑焕娣,陈善娜,田育天,等.香荚兰花芽分化期与萌发期可溶性糖和蔗糖的变化[J]. 云南大学学报:自然科学版,2001,23(植物学专辑):93-95.
[10] 钟晓红,罗先实,陈爱华.奈李花芽分化与体内主要代谢物含量的关系[J].湖南农业大学学报,1999,25(1):31-35.
[11] 郭金丽,张玉兰.苹果梨花芽分化期蛋白质、淀粉代谢的研究[J].内蒙古农牧学院学报,1999,20(2):80-82.
[12] 郗荣庭,张毅萍.中国果树志·核桃卷[M]. 北京:中国林业出版社,1996.
[13] 裴东,鲁新政.中国核桃种质资源[M].北京:中国林业出版社,2011.
[14] 范永林,陈军,余绍亮,等.红花串核桃种类型(品种)特性及育种策略[J].贵州林业科技,2012,40(1):36-39.
[15] 田小琴,冷天凤,娄丽,等.贵州省串核桃花期与果实特性分析[J].种子,2019,38(6):76-77.
[16] 田小琴,娄丽,冷天凤.串核桃雌花芽分化外观特性与内部结构的关系[J].江苏农业科学,2021,49(5):133-136.
[17] 田小琴,娄丽,冷天凤.串核桃雌花芽分化内源激素和多胺含量变化的研究[J].贵州林业科技,2021,49(1):7-11.
[18] 刘崇欣,谢永贵,谢恩云.黔西北串核桃丰产栽培技术[J].林业实用技术,2009(11):12-13.
[19] 国家标准总局.谷类、油料作物种子粗脂肪测定方法:GB2906—82[S].北京:中国标准出版社,1982.
[20] 余光英,胡国珍,王凌翔.贵州核桃[J].贵州林业科技,1988(2):38-46.
[21] 余光英,胡国珍,李忠洪.贵州省核桃农家品种资源调查研究[J].贵州林业科技,1987(2):1-17.
[22] 西北农业大学.基础生物化学实验指导[M].西安:陕西科学技术出版社,1986. (责编:张宏民)
基金项目 黔林科合〔2022〕12号,贵州省科技厅基金项目(黔科合基础〔2018〕1092号)。
作者简介 李小永(1987—),男,吉林长春人,高级工程师,从事林业调查规划工作。
收稿日期 2022-11-23

