猪主要腹泻病毒多重RT-PCR检测方法的建立及初步应用
闫晓光,丁庆文,任豪杰,张宇航,李泽辉,胡 慧,2*
(1.河南农业大学 动物医学院,河南 郑州 450002;2.河南省动物性食品安全重点实验室,河南 郑州 450002)
在引起猪肠道腹泻的主要病毒中,猪δ冠状病毒(porcine deltacoronavirus,PDCoV)、猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)、猪传染性胃肠炎病毒(transmissible gastroenteritis virus of swine,TGEV)、猪萨佩罗病毒(porcine sapelovirus,PSV)在猪场中的感染率居高不下,这4种病毒均可引起猪不同程度腹泻。PDCoV、PEDV、TGEV属于冠状病毒,其中PEDV属于α属冠状病毒,常引起仔猪急性腹泻、脱水和呕吐等消化道症状,死亡率高,自20世纪70年代在欧洲发现后[1],迅速在世界各地扩散开来。本病在国内最初报道于上世纪70年代后期,在2010年底,中国大部分省份暴发与PEDV相似症状的急性腹泻,经证实属于PEDV强毒株G2型[2]。2013年,美国暴发的PEDV疫情,导致生猪产量下降10%[3]。TGEV属于α属冠状病毒,可感染不同年龄段的猪群,以2周龄以下的仔猪为主,常表现为呕吐、严重腹泻等消化道症状,死亡率高达100%[4]。PDCoV属于δ属冠状病毒,可引起腹泻、呕吐等消化道症状,死亡率在30%~40%之间,在我国香港于2012年首次发现[5]。本病于2014年在美国暴发了大范围的流行,随后在世界其他国家也陆续发现[6-9]。PSV是小RNA病毒科、萨佩罗病毒属中无囊膜的单股正链RNA病毒,呈球形,PSV基因组全长7.5~8.3 kb,是最小的RNA病毒[10]。PSV自1960年在英国首次报道后,世界各地都有发现PSV引起的感染流行。该病毒最初是从呈现严重腹泻症状的猪肠道组织中分离得到,命名为猪肠道病毒8型(PEV-8),后经序列分析将其归类为萨佩罗病毒属[11]。PSV可感染不同阶段的猪,导致腹泻、肺炎、繁殖障碍等症状, 2周龄以下的哺乳仔猪感染后死亡率为100%,5周龄以上的猪死亡率极低[12]。
丁庆文等[13]对临床上采集的92份粪便样品进行检测,发现PEDV、PDCoV和PSV的三者混合感染率为3.26%,PEDV分别与PSV和PDCoV的感染率均在22.00%以上。韦学雷等[14]对采集的176份猪粪便样品进行检测发现PEDV、PDCoV和TGEV三者混合感染率为1.13%。针对这4种病毒之间混合感染的现象,通过临床诊断和病理变化不易区分,需要借助实验室检测方法进行鉴别诊断。
目前临床上常用的诊断方法包括RT-PCR、荧光定量PCR、ELISA等,但没有发现针对这4种猪主要腹泻病毒建立的多重RT-PCR检测方法。本试验针对PSV、TGEV、PDCoV和PEDV 4种病毒的保守基因片段设计相应的引物,通过对反应条件和体系进行优化,建立了猪主要腹泻病毒多重RT-PCR检测方法。并对该方法的特异性、灵敏性和重复性进行试验。利用建立的检测方法对临床上收集的48份病料进行检测,进一步评价该方法的实用性。试验旨在为PSV、TGEV、PDCoV和PEDV的流行病学调查和疾病防控提供技术支持。
1 材料与方法
1.1 病毒及病料样品来源PDCoV、PEDV、TGEV、PSV和猪细小病毒(porcine parvovirus,PPV)毒株以及猪伪狂犬病病毒(porcine pseudorabies virus,PRV)、猪圆环病毒(porcine circovirus,PCV)的阳性病料均是由河南省动物性食品安全重点实验室鉴定和保存;猪瘟病毒(swine fever virus,CSFV)和猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)疫苗购自哈尔滨维科生物技术公司。病料样品来自2018—2021年河南、山西和湖南养殖场猪的肠道组织和粪便共48份。
1.2 主要试剂TransZol试剂购自全氏金生物公司;PCR相关试剂、pMD18-T载体、DNA Marker、DNA凝胶回收试剂盒均购自北京庄盟国际生物基因科技有限公司;质粒抽提纯化试剂盒购自美国OMEGA生物技术公司;DMEM液体培养基购自武汉博士德生物工程有限公司;反转录试剂盒、组织基因组 DNA提取试剂盒均购自南京诺唯赞生物科技有限公司等。
1.3 引物的设计与合成从GenBank中下载PSV、TGEV、PDCoV和PEDV的基因序列,通过MEGA软件进行基因序列比对,针对PSV VP1基因、TGEV M基因、PDCoV N基因和PEDV N基因的保守片段分别设计相应的引物(表1),引物由河南尚亚生物技术有限公司合成。

表1 引物信息
1.4 病毒核酸的提取以及反转录利用TransZol试剂提取PSV、TGEV、PDCoV、PEDV 4种病毒液和CSFV、PRRSV 2种疫苗中的RNA,用反转录试剂盒将RNA反转录为cDNA;将PRV、PCV-2的阳性样品研磨后,在4℃离心机中离心(5 000 r/min,10 min),吸取上清提取DNA,PPV的病毒液可直接用于DNA的提取。
1.5 阳性标准品的制备分别以PSV、TGEV、PDCoV和PEDV的cDNA为模板,用相应的引物经过PCR变温扩增,得到4种病毒的目的片段。反应体系:酶13.0 μL,上、下游引物各0.5 μL,水9.0 μL,模板2.0 μL,共25.0 μL体系。扩增程序:95℃ 5 min;95℃ 30 s,56℃ 30 s,72℃ 30 s,35个循环;72℃ 10 min,4℃保存。用1%琼脂糖凝胶进行核酸电泳,将胶回收后的产物分别与pMD18-T载体连接,再转化到DH-5α感受态细胞中,构建重组质粒,并经菌液PCR鉴定,经鉴定正确的重组质粒送往河南尚亚生物技术有限公司进行测序。测序结果比对正确,进行扩大培养,按照质粒提取试剂盒说明书提取质粒。
用紫外分光光度计测出4种病毒的质粒浓度,根据公式:拷贝数=质粒浓度×10-9×6.02×1023/(660×质粒总长度),计算出拷贝数。
1.6 猪主要腹泻病毒多重RT-PCR检测方法的建立
1.6.1单一PCR扩增 分别以4种病毒的阳性质粒为模板,参考1.5的PCR反应条件和程序进行扩增,扩增结束后,于1%的琼脂糖凝胶上进行电泳。
1.6.2多重RT-PCR反应体系和条件的优化 以混合的4种阳性质粒为模板,参考1.5的PCR反应条件和程序,进行退火温度的优化(50,52,54,56,58,60℃),对4种病毒引物不同终浓度之间的组合(0.25,0.50,0.75 μmol/L)进行筛选,确定优化后的多重RT-PCR反应体系和条件。
1.6.3多重RT-PCR检测方法的特异性试验 分别以PSV、TGEV、PDCoV、PEDV、CSFV、PRRSV的cDNA 和PPV、PRV、PCV-2的DNA为模板,用1.6.2确定后的反应条件和体系进行PCR扩增,同时设置阴性对照,判断该方法的特异性。
1.6.4多重RT-PCR检测方法的灵敏性试验 将4种阳性质粒混合,进行10倍倍比稀释,以稀释后的混合阳性质粒(109~100拷贝/μL)为模板,用1.6.2确定后的反应条件和体系进行PCR扩增,评价该方法的灵敏性。
1.6.5多重RT-PCR检测方法的重复性试验 分别以104拷贝/μL的混合阳性质粒和4种单一阳性质粒为模板,用1.6.2确定后的反应条件和体系进行PCR扩增,重复3次(每间隔3 d重复1次),评价该方法的重复性。
1.6.6临床样品检测 对采集的48份临床病料进行预处理,粪便用DMEM稀释,进行震荡,在4℃离心机中离心;对于肠道组织的处理,在EP管中依次加入小钢珠、DMEM和黄豆大小的组织块,再在机器上进行碾磨,于4℃离心机中离心(5 000 r/min,10 min),取上清,用TRIzol 裂解法对样品中的RNA进行提取,反转录cDNA,进行PCR扩增。利用建立的多重RT-PCR和单一RT-PCR检测方法对临床样品进行检测,根据检测结果计算两者的符合率。
2 结果
2.1 单一PCR扩增结果及阳性质粒的鉴定分别以PDCoV、PEDV、TGEV、PSV 4种病毒的阳性质粒为模板,用1.5中的反应体系和条件,进行普通PCR 扩增,PCR产物在1%的琼脂糖凝胶上进行电泳。结果显示,均扩增出与目的片段大小一致的条带(图1),将质粒送往相关公司进行测序,序列比对均正确,表明成功构建了4种病毒的阳性质粒。
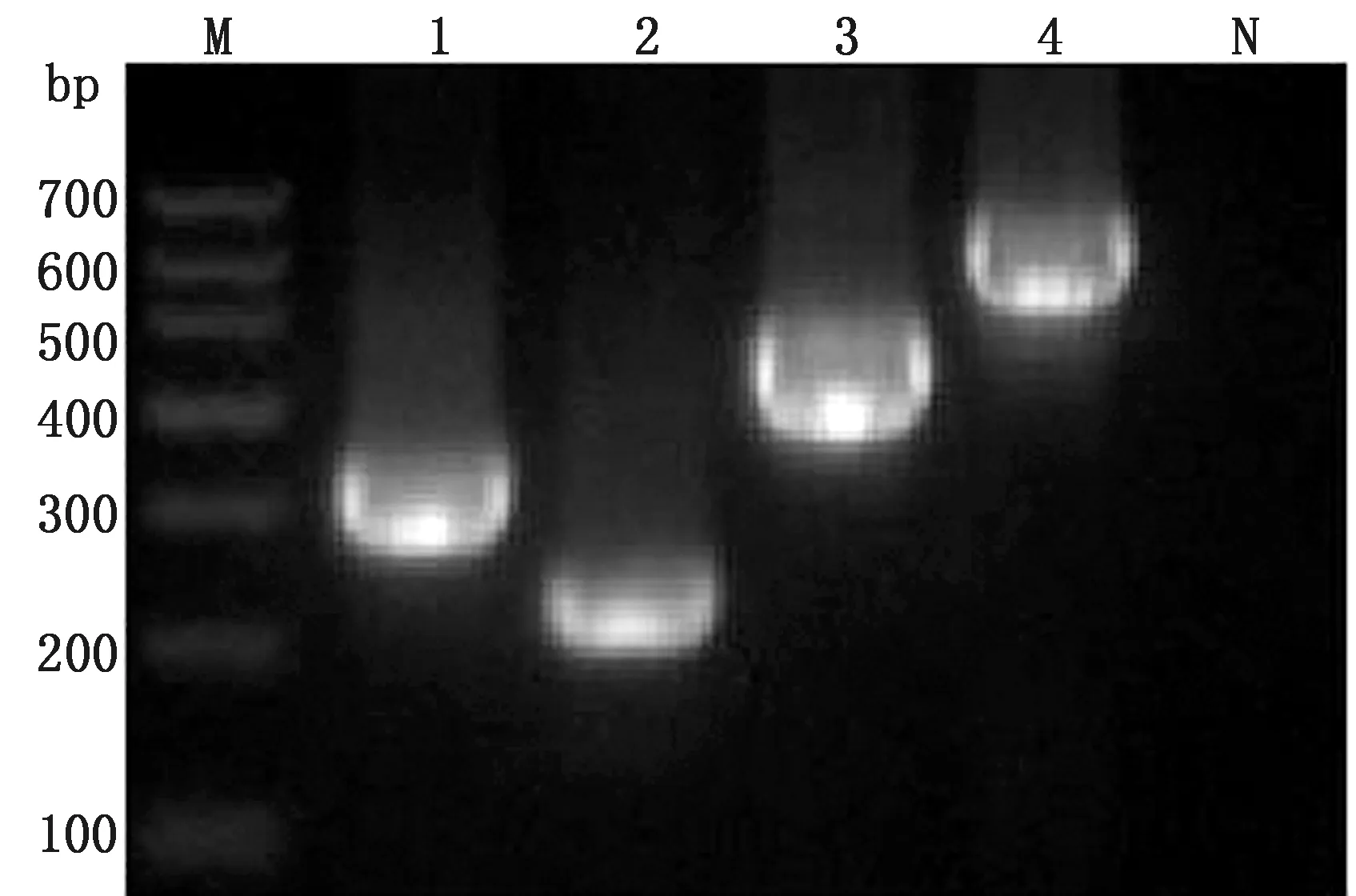
M.DL700 DNA Marker;1~4:PDCoV、PEDV、TGEV、PSV;N.阴性对照
2.2 多重RT-PCR反应体系和条件的优化通过对不同退火温度(图2)和4种引物不同浓度的组合(图3)进行筛选,确定多重PCR的反应体系为2×Taq DNA Master Mix 15.00 μL,PSV-F/R(10 μmol/L)各0.50 μL,TGEV-F/R(10 μmol/L)各0.25 μL,PDCoV-F/R(10 μmol/L)各0.25 μL,PEDV-F/R(10 μmol/L)各0.25 μL,cDNA为2.00 μL,补水至25.00 μL。最终确定的反应条件为95℃ 5 min;95℃ 30 s,56℃ 30 s,72℃ 30 s,35个循环;72℃ 10 min,4℃结束反应。
2.3 多重RT-PCR检测方法的特异性试验分别以PSV、TGEV、PDCoV、PEDV、CSFV、PRRSV的cDNA 以及PPV、PRV、PCV-2的DNA为模板,进行PCR扩增,同时设置阴性对照。结果显示,该方法能够扩增出PSV、TGEV、PDCoV、PEDV的目的基因,同时与CSFV、PRRSV、PPV、PRV、PCV-2无交叉反应,证明该方法特异性良好(图4)。

M.DL700 DNA Marker;1~6.退火温度依次为50,52,54,56,58,60℃;N.阴性对照
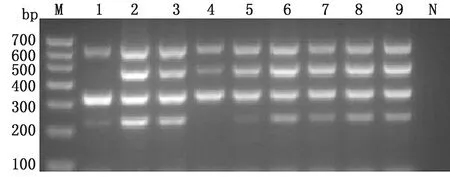
M.DL700 DNA Marker;1~3.PEDV、PDCoV均为0.25 μmol/L,TGEV为0.25 μmol/L,PSV为0.25,0.50,0.75 μmol/L;4~6.PEDV、PDCoV均为0.25 μmol/L,TGEV为0.50 μmol/L,PSV为0.25,0.50,0.75 μmol/L;7~9.PEDV、PDCoV均为0.25 μmol/L,TGEV为0.75 μmol/L,PSV引物终浓度依次为0.25,0.50,0.75 μmol/L;N.阴性对照

M.DL700 DNA Marker;1.混合的4种阳性质粒;2~5.PSV、TGEV、PDCoV、PEDV的阳性质粒;6~10.PRV、PCV、PPV、PRRSV、CSFV;N.阴性对照
2.4 多重RT-PCR检测方法的灵敏性试验将同一浓度的4种阳性质粒混合,进行10倍倍比稀释,以稀释后的阳性质粒(109~100拷贝/μL)为模板,进行PCR扩增。结果显示,该检测方法对PSV、TGEV、PDCoV、PEDV的灵敏性分别为1.37×102,1.44×102,1.51×102和1.56×102拷贝/μL(图5),证明本试验建立的多重RT-PCR检测方法灵敏性较高。
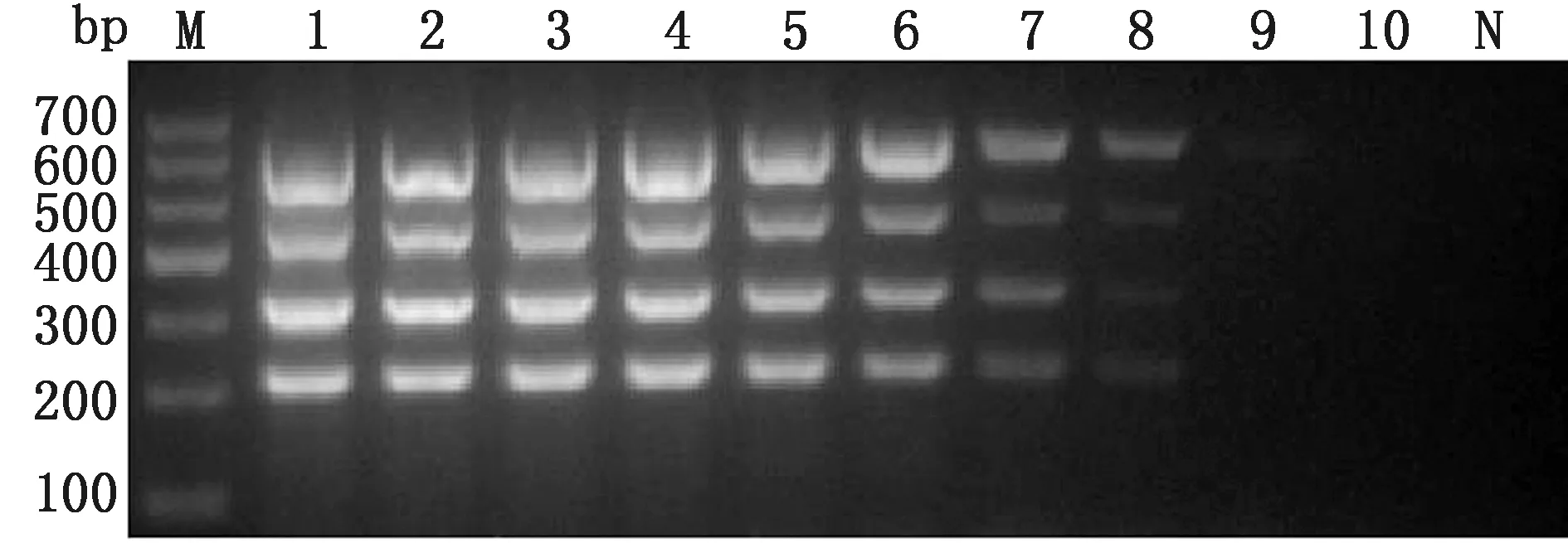
M.DL700 DNA Marker;1~10.依次为109~100 拷贝/μL阳性质粒的PCR扩增;N.阴性对照
2.5 多重RT-PCR检测方法的重复性试验分别以104拷贝/μL的混合阳性质粒和4种单一阳性质粒为模板,进行PCR扩增,重复3次(每间隔3 d重复1次)。结果显示,该方法重复性良好(图6)。
2.6 临床样品检测利用建立的检测方法对收集的48份临床病料进行检测,多重RT-PCR检测出PSV、TGEV、PDCoV、PEDV的阳性样品分别有2,0,7,11份,单一RT-PCR检测出PSV、TGEV、PDCoV、PEDV的阳性样品分别有3,2,9,12份,2种检测方法的总符合率为91.66%(表2)。选择了2个阳性样品的PCR产物进行克隆测序,通过同源性分析,发现6#阳性样品的基因序列与参考PEDV毒株序列同源性范围在98.7%~99.1%之间(表3),29#阳性样品的基因序列与参考PDCoV毒株序列同源性范围在99.1%~100.0%之间(表4),测序结果证明该检测方法可特异性扩增出病毒的目的基因。本试验建立的多重RT-PCR检测方法可用于临床上对PSV、TGEV、PDCoV、PEDV的检测。
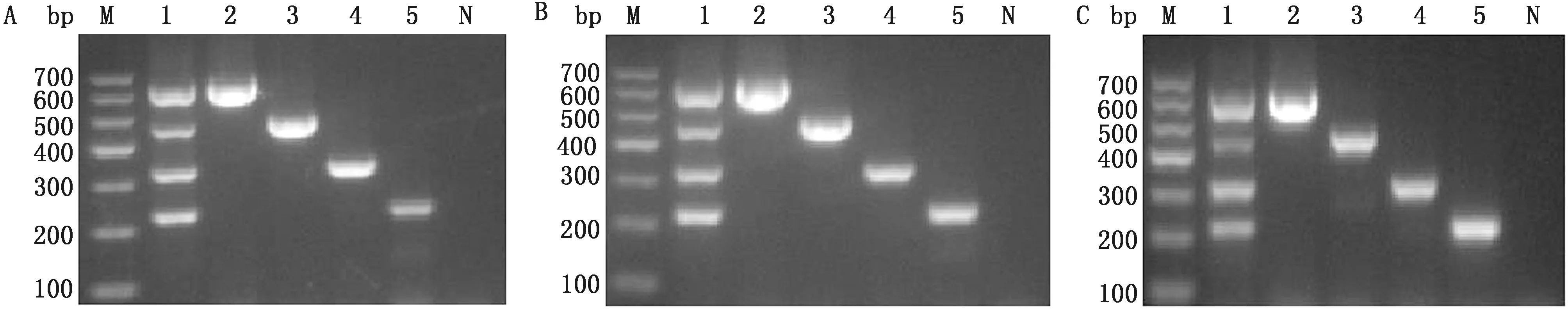
A.第1次;B.第2次;C.第3次。M.DL700 DNA Marker;1.混合的4种阳性质粒;2~5.PSV、TGEV、PDCoV、PEDV各单一阳性质粒;N.阴性对照
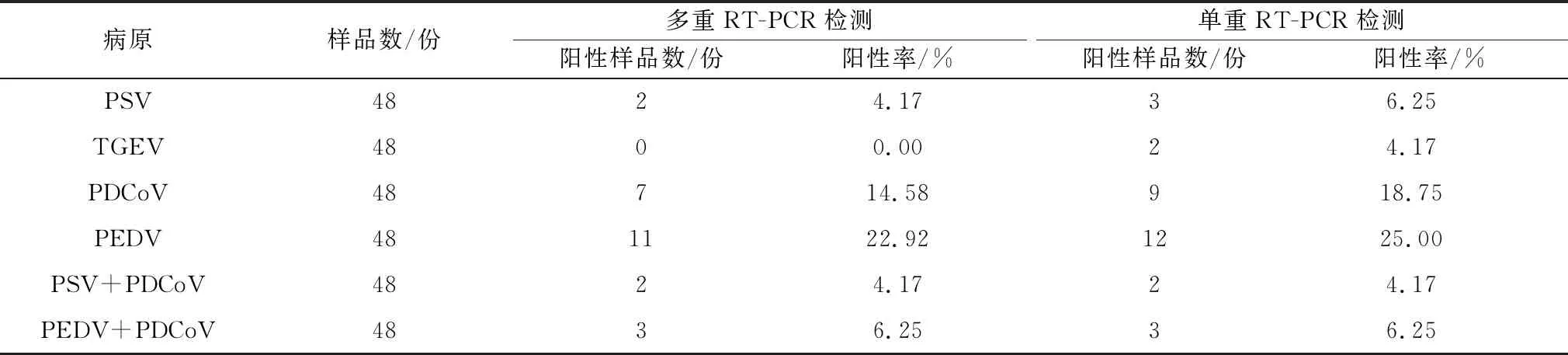
表2 临床样品检测结果
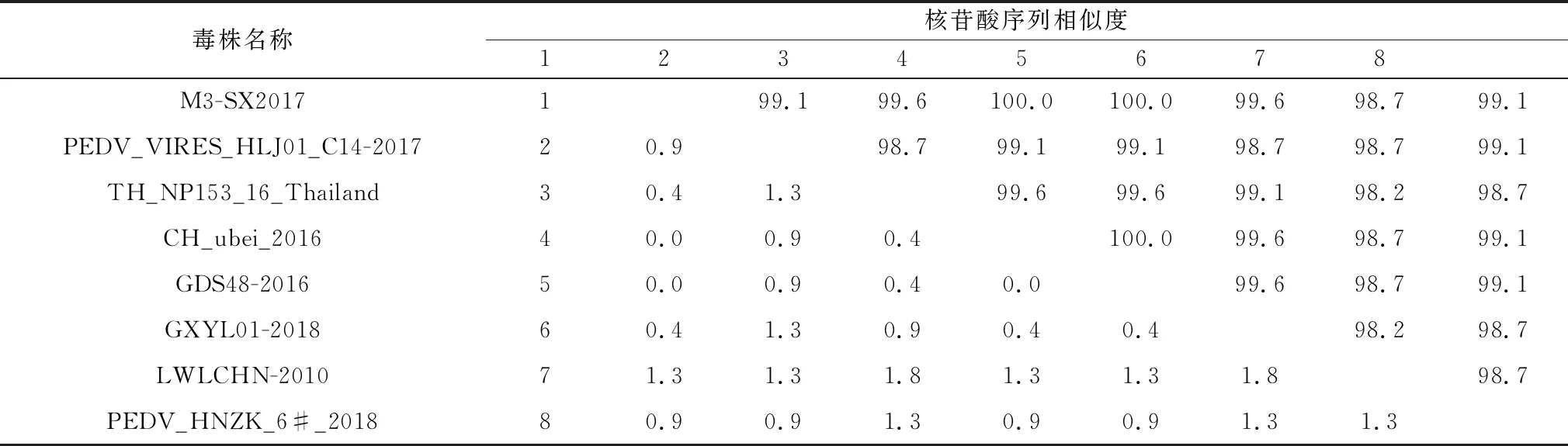
表3 PEDV同源性分析 %

表4 PDCoV同源性分析 %
3 讨论
猪腹泻病毒在我国流行时间长,造成的经济损失难以估量。PSV、TGEV、PDCoV、PEDV均可引起猪肠道腹泻,临床症状相似,难以区分。目前检测方法有病毒分离、ELISA、q-PCR、RT-PCR、RPA等。病毒分离培养对试验操作要求比较高,需要用特定的细胞系来进行分离培养,耗时长,同时要求无菌环境,不适用于临床快速诊断。ELISA是利用抗原和抗体特异性结合的特性进行检测,但由于需要制备专一的抗体,花费时间长,在检测过程中速度较慢,操作步骤较多不适用于快速检测。恒温扩增技术可以在某个恒定温度下大量扩增病毒核酸,相比于聚合酶链式反应,无需改变样品温度,操作简便,结果可视化,由于对引物和靶标序列的选择性要求比较高,导致其应用范围受限制。多重RT-PCR可一次性检测多种病毒,同时成本和操作技术相对较低。因此,多重RT-PCR在检测病毒混合感染方面应用比较广泛。
本试验建立的多重RT-PCR检测方法,基于PSV、TGEV、PDCoV和PEDV的保守片段设计了4对引物。在PCR扩增过程中,引物的设计是至关重要,首先对设计出的引物进行筛选,保证引物之间不会出现同源性和互补现象,对筛选出的引物进行比对,要初步确保依据该引物建立的检测方法具有良好特异性;验证单个引物能否扩增出目的片段,再通过筛选出的引物进行组合,看能否同时扩增出4种病毒的目的片段,接着摸索最佳引物浓度以及退火温度,建立猪主要腹泻病毒多重RT-PCR检测方法。该检测方法可扩增出PSV、TGEV、PDCoV和PEDV的目的基因,对CSFV、PRRSV、PPV、PRV和PCV-2无交叉反应,该方法特异性良好。韦学雷等[14]针对TGEV、PDCoV和PEDV建立的三重RT-PCR检测方法,对TGEV、PDCoV和PEDV的检测限分别为3.68×102,3.14×103和3.88×104拷贝/μL。本试验建立的检测方法对PSV、TGEV、PDCoV、PEDV的检测限分别为1.37×102,1.44×102,1.51×102和1.56×102拷贝/μL,比上述检测方法灵敏度高。
利用本试验建立的检测方法对临床上收集的48份样品进行检测,共检测出2份PSV、7份PDCoV和11份PEDV,与单重RT-PCR检测结果的总符合率为91.66%。根据临床检测结果,发现猪场中PEDV感染率最高,并且还存在着病毒混合感染的现象,2份病料呈现PSV和PDCoV混合感染,3份病料呈现PEDV和PDCoV混合感染。通过对其中2份阳性样品的PCR产物进行克隆测序,测序结果发现6#样品和29#样品分别为PEDV感染和PDCoV感染,与检测结果相符合。
综上所述,本试验成功建立用于检测PSV、TGEV、PDCoV和PEDV 4种猪主要腹泻病毒多重RT-PCR检测方法,该方法具有良好的特异性和灵敏性,为临床上对这4种病毒的检测和流行病学调查提供了技术保障。

