氟中毒对肉鸡促红细胞生成素和红细胞膜ATP酶的影响
刘玲玲,李德印,李先芳,沈永恕,张 磊
(河南牧业经济学院 动物医药学院,河南 郑州 450046)
氟是动物机体必需的微量元素之一,在自然环境中广泛存在,具有蓄积毒性,对动物的危害主要表现在其对机体的多器官、多系统性损伤等,能造成多种机能和形态的异常改变[1,2]。近年来,人畜氟中毒的报道日益增多,氟污染已经严重威胁到当地畜禽和人类的健康[3]。大量研究表明,氟中毒会引起机体发生贫血[4,5],能够显著降低肉仔鸡血细胞数、血清溶菌酶和补体C3、C4含量[6]。促红细胞生成素(EPO)作为调控红细胞生成的重要糖蛋白激素,在抵抗外界因素对动物机体红细胞的损伤过程中发挥着重要作用[7,8],目前有关氟中毒对肉鸡EPO含量的影响尚未见报道,本试验通过构建肉鸡氟中毒模型,观察氟中毒对肉鸡的血液学相关指标的影响,探讨氟中毒对肉鸡红细胞的毒性以及EPO在其致肉鸡贫血中的作用。
1 材料与方法
1.1 试验动物与主要试剂
1日龄健康萨索肉鸡购自郑州雪霞农业科技有限公司;分析纯氟化钠(NaF)购自于Sigma公司;煌焦油蓝染液、Ca2+-Mg2+-ATPase试剂盒、Na+-K+-ATPase试剂盒均购自于南京建成生物工程研究所;EPO检测试剂盒购自于美国ADL公司;全自动血细胞分析仪购自深圳迈瑞医疗器械有限公司。
1.2 试验方案
选取240只1日龄健康萨索肉鸡,试验方法参考黄俊祥等[6]方法进行,随机分为4组,每组60只。对照组饲喂基础日粮(F,11 mg/kg,以实际氟含量计,下同),试验组分别在基础日粮中添加不同剂量的NaF:高氟1组(F,300 mg/kg)、高氟2组(F,600 mg/kg)、高氟3组(F,900 mg/kg),常规雏鸡饲养管理,自由采食与饮水,分别于试验第14天、28天和42天进行心脏采血用于检测。
1.3 指标测定
1.3.1 血液学指标检测
采用全自动血细胞分析仪测定血液中血红蛋白(Hb)、红细胞压积(HCT)、红细胞平均体积(MCV)、红细胞平均血红蛋白含量(MCH)和平均红细胞血红蛋白浓度(MCHC)等指标。
1.3.2 网织红细胞数目检测
心脏采血后,取一滴全血加入含有煌焦油蓝染液的玻片上,混匀,室温静置5~10 min。取适量的混匀液制备血涂片,置于油镜下观察。选取红细胞分布均匀且染色质量较好的部分进行计数,统计每1000个红细胞中网织红细胞的数目。
1.3.3 红细胞膜的ATP酶活性检测
采用无机磷比色法进行红细胞膜的ATP酶活性检测。按照试剂盒说明书进行操作,分别检测红细胞膜的Na+-K+-ATPase和Ca2+-Mg2+-ATPase活性。
1.3.4 红细胞渗透脆性的检测
采用浓度梯度法测定红细胞对不同浓度的低渗氯化钠溶血的抵抗力,即红细胞渗透脆性。取30 μL肝素抗凝血,分别加入到不同浓度(0.65%、0.60%、0.55%、0.50%、0.45%、0.40%、0.35%、0.30%、0.25%)的低渗氯化钠溶液试管中,室温静置2 h后,于分光光度计510 nm波长处比色,与完全溶血管进行比较,计算溶血度。溶血的判定标准如表1所示。

表1 红细胞渗透脆性试验溶血的判定标准
1.3.5 促红细胞生成素(EPO)含量的检测
分离血清后,参考EPO检测试剂盒说明书进行操作,将酶标仪的波长设置为450 nm,该条件下测定标准品和样品的吸光度(OD)值,标准品浓度及OD值绘制标准曲线,计算出样品中EPO的含量。
1.4 数据统计与分析
试验数据以平均值±标准差表示,采用SPSS 22.0统计学软件One way-ANOVA分析比较各组数据间的差异显著性,并用LSD法进行多重比较,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 氟中毒后血液学指标的变化
如表2所示,与对照组相比,试验第14天时高氟1组Hb升高,无显著差异(P>0.05),HCT、MCV和MCHC降低,无显著差异(P>0.05),MCH显著降低(P<0.05);高氟2组HCT和MCHC显著降低(P<0.05),MCV无显著差异(P>0.05),Hb和MCH极显著降低(P<0.01)。试验第28天和42天,除高氟2组在28天时MCV与对照组相比,无显著降低(P>0.05)外,高氟1组和高氟2组其余血液学指标与对照组相比显著或极显著降低(P<0.05或P<0.01);试验期间,试验组血液学指标与对照组相比极显著降低(P<0.01)。
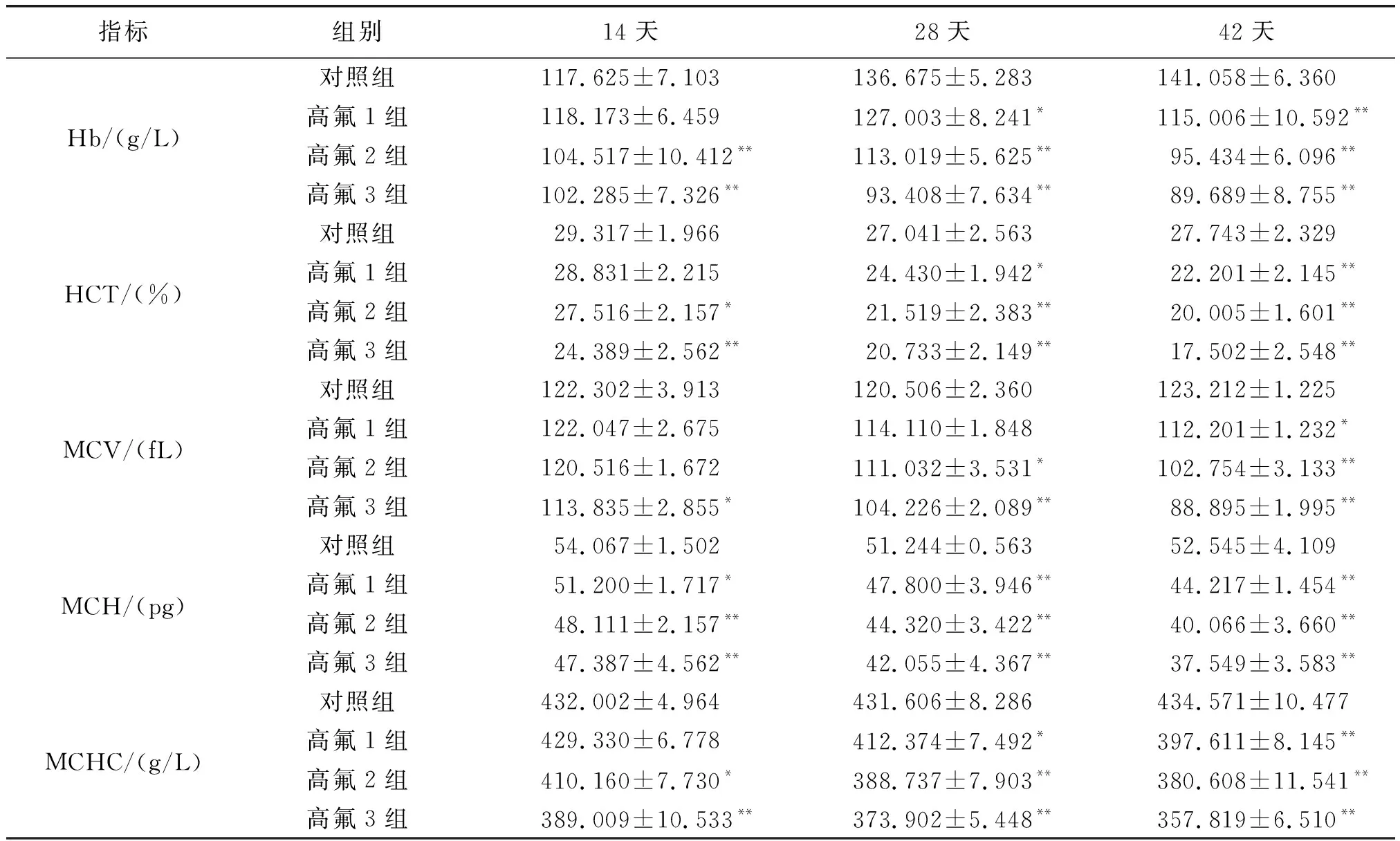
表2 氟中毒后血液学指标的变化
2.2 氟中毒后血液中网织红细胞的变化
如表3所示,与对照组相比,试验第14天时高氟1组血液网织红细胞数显著升高(P<0.05),高氟2组和高氟3组血液网织红细胞数降低,差异显著或极显著(P<0.05或P<0.01);试验第28天和42天,各试验组血液网织红细胞数与对照组相比显著或极显著降低(P<0.01)。

表3 氟中毒后血液中网织红细胞的变化 %
2.3 氟中毒后红细胞膜ATP酶活性的变化
如表4所示,整个试验期间,与对照组相比,高氟1组红细胞膜Na+-K+-ATPase活性显著降低(P<0.05),高氟2组和高氟3组红细胞膜Na+-K+-ATPase活性显著降低(P<0.01)。

表4 氟中毒后红细胞膜ATP酶活性的变化 U/mL
试验第14天,与对照组相比,高氟1组红细胞膜Ca2+-Mg2+-ATPase活性降低,无显著差异(P>0.05),高氟2组红细胞膜Ca2+-Mg2+-ATPase活性显著降低(P<0.05),高氟3组红细胞膜Ca2+-Mg2+-ATPase活性显著降低(P<0.01)。试验第28天,高氟1组红细胞膜Ca2+-Mg2+-ATPase活性显著降低(P<0.05),高氟2组和高氟3组红细胞膜Ca2+-Mg2+-ATPase活性显著降低(P<0.01);试验第42天,各试验组红细胞膜Ca2+-Mg2+-ATPase活性显著降低(P<0.05)。
2.4 氟中毒后红细胞渗透脆性的变化
如表5所示,与对照组相比,试验第14天,高氟1组红细胞渗透脆性无显著升高(P>0.05),高氟2组红细胞渗透脆性显著升高(P<0.05),高氟3组红细胞渗透脆性显著升高(P<0.01)。试验第28天,与对照组相比,高氟1组红细胞渗透脆性显著升高(P<0.05),高氟2组和高氟3组红细胞渗透脆性显著升高(P<0.01);试验第42天,各试验组红细胞渗透脆性与对照组相比显著升高(P<0.01)。

表5 氟中毒后红细胞渗透脆性的变化 g/L
2.5 氟中毒后促红细胞生成素(EPO)含量的变化
如表6所示,试验第14天,与对照组相比,高氟1组血清EPO含量显著升高(P<0.05),高氟2组和高氟3组血清EPO含量显著降低(P<0.05或P<0.01);试验第28天和42天,各试验组血清EPO含量显著降低(P<0.01)。

表6 氟中毒后促红细胞生成素(EPO)含量的变化 mIU/mL
3 讨论
研究证实,氟在体内的蓄积是引起机体代谢性贫血的原因之一[9,10]。本试验结果显示,氟中毒导致Hb含量显著降低,结合王美玲等[11]报道的氟中毒会导致肉鸡血液红细胞数目的降低,表明氟中毒会引起肉鸡发生贫血。高氟1组在染毒后第14天时,引起肉鸡血液红细胞数目和网织红细胞数目的上升,推测可能是由于过量氟的摄入,导致机体动员其它血液储备器官释放红细胞,同时骨髓新生成的网织红细胞数会暂时升高。随着染毒剂量的加大及持续时间延长,毒性作用超过了机体自身代偿能力,导致机体红细胞数、血红蛋白含量以及网织红细胞数目会表现明显降低,直接影响到机体的造血功能。
本研究数据表明,肉鸡氟中毒降低了红细胞膜Ca2+-Mg2+-ATPase和Na+-K+-ATPase活性,增加了红细胞的渗透脆性,与多项研究结果一致[12-14]。细胞膜ATP酶活性受到抑制,一方面改变细胞膜的抗氧化酶系统,引起机体细胞的ATP活力明显下降;另一方面会导致细胞内外离子与水分的调控失衡、膜电位的改变,最终红细胞膜脆性明显增大,加剧肉鸡贫血的发生[15,16],这与本试验中Hb及渗透脆性的变化结果相一致。
EPO是一种由肾脏产生的调控红细胞生成的糖蛋白激素,它能够刺激并加快肉鸡各发育阶段的幼红细胞分裂,促进红细胞成熟。另外,EPO还具有抗氧化,稳定红细胞膜的功能等作用[17]。氟中毒严重损伤了动物机体的肾脏功能,从而影响了EPO的生成[18-20]。本试验中高氟1组随着染毒时间的延长,肉鸡血清EPO含量先略微增加后又降低,而高氟2组和3组血清EPO含量显著降低,说明肉鸡血清EPO含量与染毒的剂量和中毒时间有密切关系,且氟在动物机体内有较强的蓄积毒性。此外,EPO能够平衡细胞膜内外的正常渗透压,血清中EPO减少会导致机体的红细胞膜流动性降低,完整性被破坏,从而影响红细胞的生成,加重肉鸡的溶血性贫血症状。

