外源性心肌球样细胞外囊泡Y RNA片段改善小鼠心肌缺血再灌注损伤的作用机制研究
刘德昭,罗小志,黄锋
心肌梗死是较常见、致死率较高的一种心血管疾病,救治心肌梗死的关键是尽快恢复缺血心肌血供。然而,冠状动脉血流恢复后的再灌注可能导致更严重的缺血心肌急性损伤,称为心肌缺血再灌注损伤(myocardial ischemia-reperfusion injury,MIRI)[1]。MIRI 的机制包括炎症反应、氧化应激、线粒体功能障碍和钙超载等[2]。MIRI 会导致心脏炎症级联反应,出现恶性心律失常、无复流或心肌顿抑,心肌坏死面积进一步扩大甚至死亡。Y RNA是一类长度约100 nt 的非编码RNA,参与调控细胞生命周期的重要过程,包括DNA 复制起始、抑制RNA 结合蛋白Ro60等,其在组蛋白前体mRNA加工和细胞损伤修复中起重要作用[3-4]。最近有研究表明,心肌球样细胞(cardiosphere-derived cells,CDCs)外囊泡在心脏保护、抗炎、血管新生中发挥重要作用。而CDCs 外囊泡富含细胞外囊泡Y RNA 片段(extracellular vesicles Y RNA fragments,EV-YF),其中EV-YF1 含量最丰富[5-7]。本课题组前期提取CDCs外囊泡EVYF1 进行分析,并人工合成EV-YF1,使用EV-YF1干预肥厚型心肌病小鼠,可介导巨噬细胞极性而抑制炎症反应、减轻心肌细胞肥大及间质纤维化[8]。但EV-YF1对心肌缺血再灌注损伤作用机制仍不明确,本研究将探讨EV-YF1是否减轻小鼠MIRI。
1 材料与方法
1.1 材料 SPF 级成年雄性C57BL/6J 小鼠18 只,8 周龄,体质量23~28 g,购自广西医科大学动物实验中心,动物生产许可证号:SCXK(桂)2020-0003,伊文思蓝和TTC 染色液购自北京索莱宝生物公司;HE组织病理染液盒和TUNEL 试剂盒购自武汉赛维尔生物科技公司;白细胞介素(IL)-1β、IL-6、肿瘤坏死因子-α(TNF-α)酶联免疫吸附试验(ELISA)试剂盒购自上海酶联生物公司;cDNA 反转录试剂盒和实时荧光定量PCR(qPCR)试剂盒购于日本Takara公司;兔抗B淋巴细胞瘤-2 基因(Bcl-2)抗体、兔抗Bcl-2 相关的X 蛋白(Bax)抗体购自美国Cell Signaling Technology 公司、兔抗胱天蛋白酶-3(Caspase-3)抗体、鼠抗甘油醛-3-磷酸脱氢酶(GAPDH)抗体购自英国Abcam公司,化学发光仪购自美国Protein Simple公司。Mini-Vent845小动物呼吸机购自美国哈佛仪器公司,电泳仪和荧光定量PCR 仪购自美国伯乐生命医学产品有限公司,DharmaFECT4(一种专门为转染siRNA 而优化的转染试剂,可以满足小片段RNA的高效转染要求)购自赛默飞世尔科技有限公司。
1.2 方法
1.2.1 EV-YF1 配制 EV-YF1 委托上海艾博思生物科技公司合成,核苷酸序列:5'-GGCUGGUCCGAUGGUAGUGGGUUAUCAGAACUUAUUAACAUUAGUGUCACUAAAGU-3';EV-YF1 及DharmaFECT4(3∶1,避免EV-YF1 发挥作用前降解)分别加入适量无血清的培养基中,室温放置5 min 后混匀,室温再放置20 min后备用。
1.2.2 MIRI 模型建立及分组 将小鼠按随机数字表法分为Sham组、MIRI组、EV-YF1组,每组6只。按0.02 mL/g经腹腔注射1.2%三溴乙醇适度麻醉。气管切开插管后连接呼吸机,设置参数:频率120次/min,吸呼比4∶5,潮气量1 mL。Sham组穿针过左前降支下方不结扎,45 min 后关闭胸腔;MIRI 组与EV-YF1组左前降支结扎处放聚乙烯软管,打活结。缺血45 min 后,松开活结开放前降支,左心室前壁苍白心肌变鲜红色,表明心肌组织恢复再灌注;再灌注10 min后夹闭主动脉;EV-YF1组左心室心腔内注射5µg EV-YF1确保足够的EVYF1 进入到冠状动脉;MIRI 组左心室注射等体积不含EVYF1的DharmaFECT4,20 s后松开主动脉夹。关闭胸腔,小鼠恢复自主呼吸后拔出气管导管,醒后放回饲养处。
1.2.3 伊文思蓝/TTC双染色检测心肌梗死面积 再灌注24 h后,将麻醉状态小鼠接入呼吸机,充分暴露心脏及主动脉,沿结扎线同一切迹再次结扎左前降支,经右心室缓慢注射2%伊文思蓝,直到左心耳组织全部蓝染后停止注射,用血管钳夹闭主动脉数秒,用无齿镊轻夹心脏促进染液灌注。待小鼠心脏完全停跳,关闭呼吸机,迅速剪取心脏,浸入PBS 中冲洗,纱布裹干,滴加冰冻包埋液覆盖心脏放入-20 ℃冰箱冷冻固定。心脏固定期间,将1%TTC 染液于恒温箱内温育至37 ℃。固定液颜色变白后取出心脏,沿左心室表面结扎线下缘水平,切取2 mm厚度的横截面组织,用PBS将组织摇洗片刻,稍压平卷曲的组织片。将组织片放入1%TTC 染液中避光下浸润10 min,中间翻面一次使脱氢酶充分反应。用PBS冲洗组织片残余染液,放入4%多聚甲醛中固定24 h。通过Image J 软件测量MIRI 后危险区域比值及梗死面积比值,其中蓝染部分为正常组织,未蓝染部分为心肌缺血危险区域,无法浸染呈灰白色部分为梗死区域。
1.2.4 HE染色观察心肌组织病理学形态 将心肌组织固定于4%多聚甲醛,梯度乙醇脱水,常规石蜡包埋,切成厚度约5µm的切片,二甲苯中常规脱蜡,梯度乙醇水化。使用苏木素染色10 min,冲洗掉表面多余染液,1%盐酸-乙醇分化数秒,再加入伊红染色液染色1 min,经梯度乙醇脱水与二甲苯透明后,使用中性树胶封片,在光学显微镜下观察并拍照。
1.2.5 ELISA 检测外周血清IL-1β、IL-6、TNF-α 再灌注24 h后,给予小鼠过量麻醉(标准用量1倍以上),再次气管插管接呼吸机,经右心室采集静脉血约0.8 mL,室温下将其静置30 min,离心机以1 500 r/min 低温离心10 min,分离出血清,采用ELISA 试剂盒检测小鼠外周血清中IL-1β、IL-6、TNF-α的表达水平。
1.2.6 qPCR 检测心肌组织中IL-1β、IL-6、TNF-α mRNA 表达 取20 mg 心肌组织,加入TRIzol 试剂提取总RNA,测定RNA 浓度,并进行扩增反应。取1 µg 总RNA 反转录生成cDNA,反应体系为20µL:5×gDNA Eraser Buffer 2µL,gDNA Eraser 1 µL,Total RNA 1 µg,PrimeScript RT Enzyme Mix I 1µL,RT Primer Mix I 1µL,5×PrimeScript Buffer 4µL,RNase Free dH2O 10µL;反应条件为37 ℃15 min,85 ℃5 s。PCR引物由生工生物工程(上海)股份有限公司合成,序列见表1。反应条件:95 ℃预变性30 s;95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸30 s,40个循环。通过检测熔解曲线曲线来验证引物的特异性。采用2-ΔΔCt法计算IL-1β、IL-6、TNF-α 经内参GAPDH标化后的相对表达量,每个样本重复3次取平均值。

Tab.1 Primer sequences for qPCR表1 qPCR引物序列
1.2.7 Western blot 检测Bax、Bcl-2、Caspase-3蛋白表达 使用RIPA裂解液提取心肌组织中的总蛋白后使用BCA法进行定量,上样于10%预制的SDS-PAGE 凝胶中进行电泳及转膜。5%BSA溶液室温封闭1 h,4 ℃孵育一抗10~14 h,洗膜后室温下孵育二抗1 h,使用化学发光仪曝光得到蛋白条带,使用Image J系统分析条带灰度。
1.2.8 心肌细胞凋亡的TUNEL 染色检测 心脏取材后,沿左心室表面结扎线下缘水平切取心肌组织进行包埋,石蜡切片进行常规脱蜡、水化,蛋白酶K消化处理,滴加TUNEL反应混合液,置于湿盒内,37 ℃避光孵育60 min。滴加DAPI溶液染核2 min。在荧光显微镜下观察并记录组织切片TUNEL核染阳性细胞数。
1.3 统计学方法 采用GraphPad Prism 8.0.2进行数据分析,计量资料以表示,2组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间多重比较采用Tukey 法。P<0.05为差异有统计学意义。
2 结果
2.1 EV-YF1对小鼠心肌缺血再灌注后梗死面积的影响 伊文思蓝/TTC双染色结果显示,Sham组仅可见造模穿刺点附近轻微白色梗死灶,MIRI 组、EVYF1 组均可见明显梗死区域;与MIRI 组相比,EVYF1组小鼠MIRI后梗死面积比值缩小(P<0.05),各组间小鼠MIRI后危险区域比值差异无统计学意义,见图1、表2。
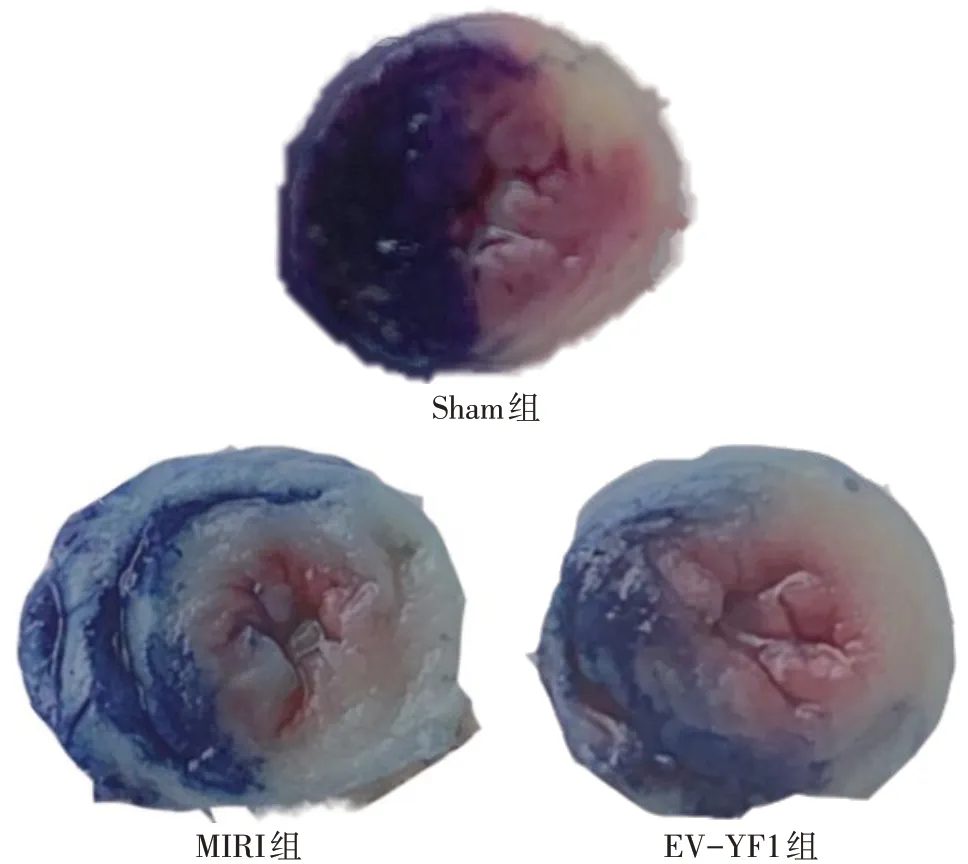
Fig.1 Changes of risk area and infarct size in mice after MIRI in each group(Evans Blue/TTC double staining)图1 各组小鼠MIRI后危险区域与梗死面积变化(伊文思蓝/TTC双染色)
Tab.2 Comparison of infarct area ratio and risk area ratio after MIRI between the three groups of mice表2 各组小鼠MIRI后梗死面积比值与危险区域比值比较(n=6,%,)

Tab.2 Comparison of infarct area ratio and risk area ratio after MIRI between the three groups of mice表2 各组小鼠MIRI后梗死面积比值与危险区域比值比较(n=6,%,)
**P<0.01;a 与Sham 组比较,b 与MIRI 组比较,P<0.05;表3—5同。
组别Sham组MIRI组EV-YF1组F梗死面积比值2.89±0.38 48.48±1.21a 33.86±0.86ab 693.900**危险区域比值56.92±1.35 57.42±1.44 58.59±0.67 0.508
2.2 EV-YF1 对IR 小鼠心肌组织病理学形态的影响 HE 染色结果显示,Sham 组心肌组织结构未见异常,纤维核饱满居中,呈椭圆形,细胞无肿胀、脂肪变性及坏死等改变;MIRI 组心肌组织损伤明显,表现为大量纤维核溶解消失,核碎片不规则分布,肌纤维明显肿胀,呈波浪形,部分肌纤维发生断裂,肌浆凝集,组织间隙疏松。与MIRI组相比,EV-YF1组心肌损伤减轻,见图2。
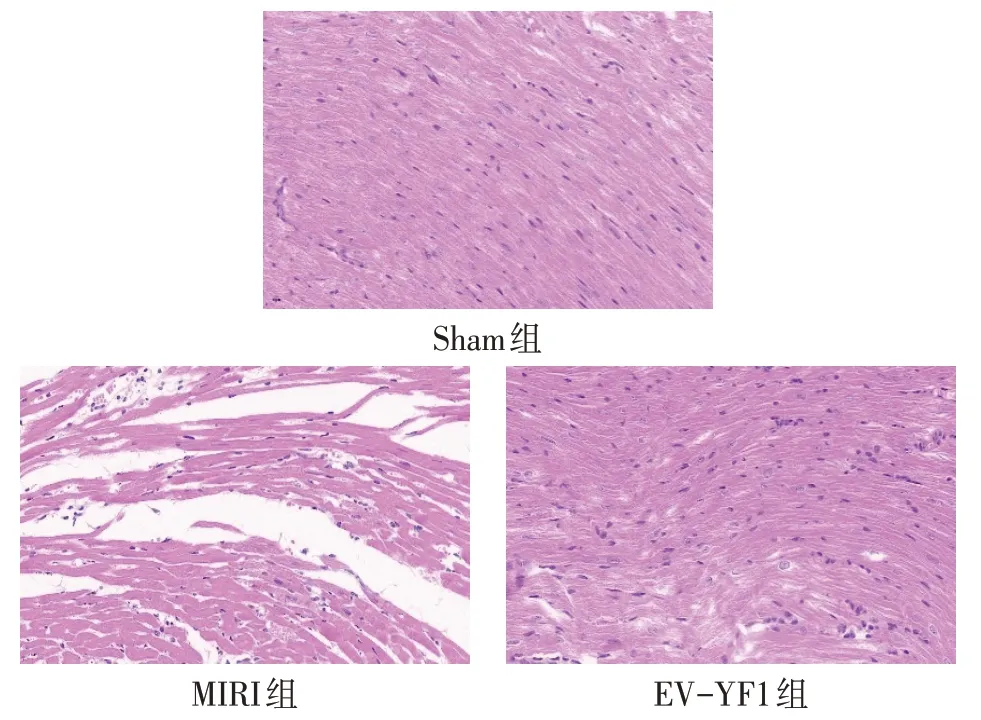
Fig.2 HE staining of mouse hearts in three groups(×200)图2 各组小鼠心脏HE染色(×200)
2.3 EV-YF1对小鼠心肌缺血再灌注后血清和心肌组织炎性因子水平的影响 与Sham 组比较,MIRI组小鼠血清中IL-1β、IL-6 和TNF-α 水平上调(P<0.05);与MIRI 组比较,EV-YF1 组IL-1β、IL-6 和TNF-α 水平降低,见表3。qPCR 结果显示,与Sham组相比,MIRI 组小鼠心肌组织中IL-1β、IL-6 和TNF-α mRNA 表达升高(P<0.05);EV-YF1 组心肌组织中IL-1β、IL-6、TNF-α mRNA表达水平较MIRI组下降(P<0.05),见表4。
Tab.3 Comparison of inflammatory factors in peripheral blood between the three groups of mice表3 各组小鼠外周血炎性因子水平比较(n=6,ng/L,)

Tab.3 Comparison of inflammatory factors in peripheral blood between the three groups of mice表3 各组小鼠外周血炎性因子水平比较(n=6,ng/L,)
组别Sham组MIRI组EV-YF1组F IL-1β 86.2±5.9 482.3±35.8a 350.1±21.0ab 69.480**IL-6 257.7±25.9 753.7±31.5a 494.8±25.8ab 79.230**TNF-α 235.5±19.4 815.6±28.1a 516.7±34.4ab 107.600**
Tab.4 Comparison of mRNA expression levels of IL-1β,IL-6 and TNF-α in myocardial tissue between the three groups of mice表4 各组小鼠心肌组织IL-1β、IL-6和TNF-α mRNA表达水平比较(n=6,)

Tab.4 Comparison of mRNA expression levels of IL-1β,IL-6 and TNF-α in myocardial tissue between the three groups of mice表4 各组小鼠心肌组织IL-1β、IL-6和TNF-α mRNA表达水平比较(n=6,)
组别Sham组MIRI组EV-YF1组F 1.00±0.08 8.98±0.42a 2.29±0.31ab 197.900**1.00±0.13 2.43±0.01a 1.39±0.04ab 56.190**1.00±0.26 3.93±0.45a 1.56±0.22ab 22.630**IL-1βIL-6TNF-α
2.4 EV-YF1 对小鼠心肌组织Bax、Caspase-3 和Bcl-2 蛋白水平的影响 蛋白免疫印迹实验结果显示,与Sham组比较,MIRI组Bcl-2、Bax、Caspase-3蛋白表达水平均升高(P<0.05);与MIRI 组比较,EVYF1 组Bcl-2 蛋白表达水平升高,而Bax 和Caspase-3 蛋白表达水平降低(P<0.05),见图3、表5。TUNEL 染色结果显示,Sham 组未见TUNEL 核染阳性细胞;与Sham组相比,MIRI组TUNEL核染阳性细胞数量明显增多;与MIRI 组相比,EV-YF1 组TUNEL核染阳性细胞数量减少,见图4。

Fig.3 Bax,Bcl-2,Caspase-3 protein expression levels in mouse myocardial tissue图3 小鼠心肌组织中Bax、Bcl-2、Caspase-3蛋白表达水平
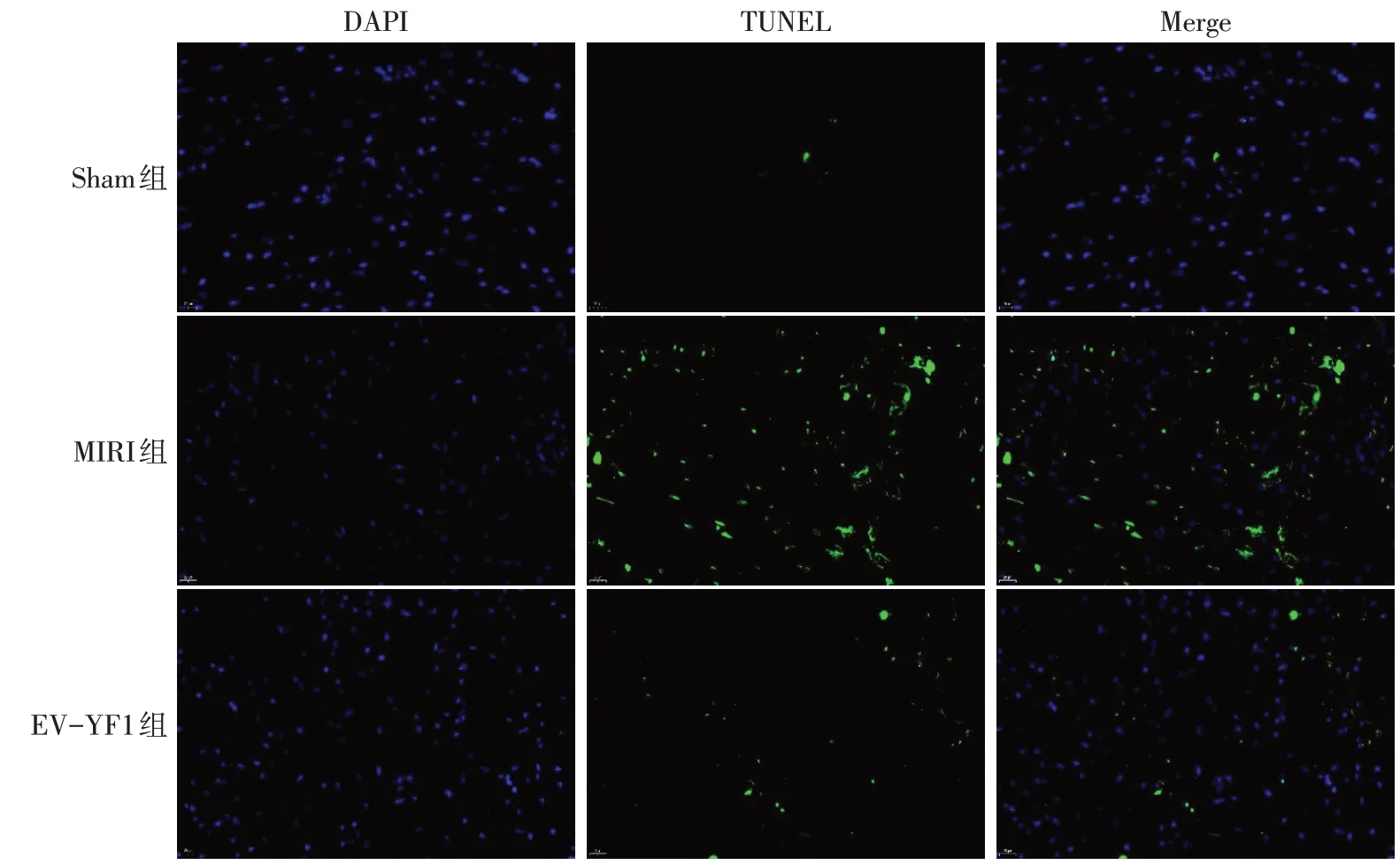
Fig.4 TUNEL staining results of myocardial tissue in each group(×400)图4 各组心肌组织TUNEL染色结果(×400)
Tab.5 Comparison of relative expression of apoptosisrelated proteins in myocardial tissue between the three groups of mice表5 各组小鼠心肌组织凋亡相关蛋白相对表达量比较(n=6,)
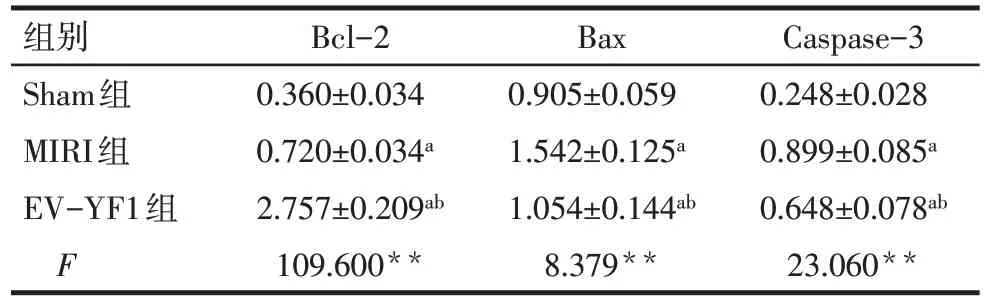
Tab.5 Comparison of relative expression of apoptosisrelated proteins in myocardial tissue between the three groups of mice表5 各组小鼠心肌组织凋亡相关蛋白相对表达量比较(n=6,)
组别Sham组MIRI组EV-YF1组F Bcl-2 0.360±0.034 0.720±0.034a 2.757±0.209ab 109.600**Bax 0.905±0.059 1.542±0.125a 1.054±0.144ab 8.379**Caspase-3 0.248±0.028 0.899±0.085a 0.648±0.078ab 23.060**
3 讨论
MIRI是一个复杂的病理过程,越来越多的证据表明,炎症和凋亡反应在MIRI过程中扮演着重要角色[9-10]。因此,抑制MIRI 后炎症反应和细胞凋亡具有重要意义。CDCs 是第二心区发育过程中残留的细胞,该类细胞外形小、圆且明亮,形成类似克隆样的心肌球;当心脏发育成熟后这些细胞可继续存在成体心脏细胞间质中;心肌损伤后,CDCs 参与心脏的自我修复和更新。多项临床研究证明CDCs 治疗心肌梗死及扩张型心肌病患者具有较好的安全性和有效性[11-13]。研究表明,CDCs 能通过分泌EV-YF1抑制心肌炎症、减轻心肌细胞凋亡和纤维化,并促进血管生成[14-16]。EV-YF1 虽然来源于先前存在的非编码RNA,但其本身可能具有生物活性。
炎症反应是再灌注损伤的关键。MIRI 后的炎症反应主要以巨噬细胞浸润为主。活化的促炎型M1 巨噬细胞会通过吞噬和降解方式清除坏死的细胞碎片,并分泌IL-1β、IL-6、TNF-α 等炎性细胞因子[17]。研究表明,对心肌梗死大鼠心腔注射10 µg EV-YF1 可调控巨噬细胞分化为修复型M2 巨噬细胞,促进受损心肌表达和分泌抗炎因子IL-10,同时抑制促炎细胞因子TNF、IL-6的释放,减少梗死面积并引发抗凋亡反应[18]。此外,对肥厚型心肌病以及高血压引起的心血管疾病给予EV-YF1治疗均发现EV-YF1 可诱导巨噬细胞快速激活,抑制促炎因子分泌,从而减轻心脏的炎症[8,16]。据此笔者推测EVYF1 在抑制MIRI 炎症中可能发挥同样的作用。本研究结果提示,与Sham组相比,MIRI 组小鼠血清和心肌组织中炎性因子IL-6、IL-1β 和TNF-α 表达水平明显增加,而使用EV-YF1 干预可降低TNF-α、IL-1β 和IL-6 的表达,提示EV-YF1 可抑制炎症反应,保护缺血心肌细胞。
细胞凋亡是细胞程序化死亡的主要模式,在组织内稳态的发展和维持中发挥着重要作用。凋亡蛋白激酶Caspase-3 是凋亡途径中的关键效应物,TNF-α、IL-1β 等多种炎性因子可以与相应的受体结合,激活Caspase-3,引起细胞凋亡[19-20];线粒体凋亡分子中的Bcl-2 家族包括抗凋亡基因Bcl-2 和促凋亡基因Bax,它们均参与了再灌注损伤的凋亡过程[21]。Gallet等[5]研究表明,向心肌梗死后的猪心脏输注CDCs 外囊泡可以改善症状,减少受损心肌凋亡;CDCs 外囊泡可降低损伤心肌细胞中Caspase-3表达,抑制细胞凋亡[22]。然而,对于外囊泡中发挥有益作用的成分仍不明确。本研究结果提示,在MIRI小鼠心肌组织Bcl-2,Bax、Caspase-3 的表达均明显升高,而EV-YF1 降低MIRI 小鼠Bax、Caspase-3 凋亡因子表达水平,上调抗凋亡因子Bcl-2 的表达水平。此外,TUNEL 染色证实EV-YF1 可明显抑制心肌细胞凋亡。根据这一结果笔者推测EV-YF1可能在改善心脏细胞凋亡中发挥有益作用。
综上所述,CDCs外囊泡Y RNA片段EV-YF1可抑制IL-1β、IL-6、TNF-α 炎性因子相关通路,抑制MIRI 后的细胞凋亡,进而维持心肌细胞活性,改善小鼠MIRI。本研究为进一步的机制探讨提供了参考依据和方向,为MIRI的防治提供了新的精准干预靶点。

