CircCDR1as调节miR-671-5p/CBX4轴对NSCLC细胞生物学行为的影响
杜文峰,周玲,李琪
肺癌发病率高、死亡率高,已成为全球肿瘤相关死亡的主要因素[1]。肺癌包括非小细胞肺癌(NSCLC)和小细胞肺癌,其中85%的肺癌病例被诊断为NSCLC[2]。在过去的几十年里,全球在NSCLC的预防、诊断和治疗方面取得了一定进展[3]。之前由于筛查方案不完善,临床症状发现较晚,NSCLC患者确诊时大多处于中晚期,预后较差,5年生存率低于20%[4]。近期发现的肺癌多为超早期,说明肺癌的早期诊断技术在不断提高,但依然有不少患者不能在超早期被确诊[5]。因此,寻找早期诊断标志物和新的、有效的NSCLC治疗方法势在必行。有研究显示,部分环状RNA(CircRNAs)异常表达与包括NSCLC 在内的肺癌等肿瘤发生与进展相关[6-7]。越来越多的证据表明,CircRNAs 反义小脑变性相关蛋白1转录本(CircRNA antisense cerebellar degenerationrelated protein 1 transcript,CircCDR1as)可促进前列腺癌[8]和胰腺癌[9],抑制膀胱癌[10]和卵巢癌[11]的发生发展。有研究表明,CircCDR1as 作为一种致癌基因,促进了NSCLC 的发展[12]。然而,CircCDR1as 参与NSCLC进展的机制尚不清楚。StarBase 预测显示CircCDR1as 可能调控miR-671-5p 表达。既往研究表明,沉默miR-671-5p 表达可促进NSCLC 的进展[13]。此外,多梳蛋白(polycomb group,PcG)家族在人类癌症进展的多个过程中至关重要[14]。染色盒同源物4(chromobox 4,CBX4)是PcG 家族表观遗传调控因子中的一员,可能驱动肺癌的恶性进展[15]。既往研究表明,在结肠癌细胞中,CBX4是miR-671-5p的靶基因,且过表达CBX4 能够逆转miR-671-5p 上调对细胞增殖、转移的抑制作用[16],但是在NSCLC细胞中是否有同样的调控作用还不清楚。本研究探讨了CircCDR1as 在NSCLC 中的生物学功能及其与miR-671-5p 和CBX4 的关系,为深入了解NSCLC 进展的分子机制提供依据。
1 材料与方法
1.1 主要试剂与仪器 CircCDR1as、CBX4 过表达载体及其阴性对照pcDNA3.1 载体(pcDNA),CircCDR1as 小干扰RNA(si-CircCDR1as)及阴性对照(si-NC)、miR-671-5p mimic 及阴性对照(miR-NC)、miR-671-5p inhibitor(anti-miR-671-5p)及阴性对照(anti-NC)由生工生物工程(上海)股份有限公司合成。DMEM 培养基、Trizol 试剂购自Sigma-Aldrich;RNase R 购自Abcam 公司;cDNA 第一链合成试剂盒、BCA 蛋白测定试剂盒、四甲基偶氮唑盐(MTT)溶液、二甲基亚砜、结晶紫、硝酸纤维素膜购自上海碧云天生物技术有限公司;SYBR Green、甲醇、Lipofectamine 3000 及兔抗人CBX4、GAPDH 抗体、山羊抗兔IgG 二抗(HRP)购自美国Thermo Fisher;总蛋白提取试剂盒购自武汉艾美捷科技有限公司;Western 阻断缓冲液购自上海华雅思创生物科技有限公司;增强的化学发光试剂购自上海谷研实业有限公司;Transwell嵌套24 孔板购自上海凌仪生物科技有限公司;Matrigel 胶购自北京萌壮科技有限公司;Annexin V-荧光素异硫氰酸盐(FITC)和碘化丙啶(PI)购自北京索莱宝科技有限公司;双荧光素酶测定系统购自Promega。酶标仪购自北京普天新桥技术有限公司;显微镜购自奥林巴斯;流式细胞仪购自艾力特生命科学(上海)有限公司。
1.2 方法
1.2.1 细胞培养和转染 人支气管上皮样细胞(HBE)和人NSCLC细胞株(NCI-H524、NCI-H1734、Calu-3和A549)购自上海ATCC细胞库,在含10%胎牛血清和1%青霉素-链霉素的DMEM中培养。使用Lipofectamine 3000对A549细胞进行24 h 的寡核苷酸或载体转染,并分成Control 组(正常培养)、si-NC 组(转染si-NC)、si-CircCDR1as 组(转染si-CircCDR1as)、si-CircCDR1as+anti-miR-NC 组(共转染si-CircCDR1as和anti-miR-NC)、si-CircCDR1as+anti-miR-671-5p组(共转染si-CircCDR1as和anti-miR-671-5p)、pcDNA组(转染pcDNA)、CircCDR1as 组(转染CircCDR1as)、miR-NC组(转染miR-NC)、miR-671-5p组(转染miR-671-5p)、miR-671-5p+pcDNA 组(共转染miR-671-5p 和pcDNA)、miR-671-5p+CBX4 组(共转染miR-671-5p 和CBX4)、anti-miRNC 组(转染anti-miR-NC)和anti-miR-671-5p 组(转染antimiR-671-5p)。
1.2.2 实时定量聚合酶链反应(qRT-PCR)检测CircCDR1as、miR-671-5p和CBX4 mRNA表达水平 用Trizol试剂裂解细胞,分离总RNA。提取CircRNA 时,RNA 经RNase R 进一步处理,利用cDNA 第一链合成试剂盒逆转录生成互补DNA(cDNA),与SYBR Green和特异性引物混合后用于qRT-PCR检测。CircCDR1as 引物正向5'-CCCAGTCTTCCATCAACTGG-3',反向5'-ACCTTGACACAGGTGCCATC-3',196 bp;CBX4 引物正向5'-TGGAGTATCTGGTGAAATGGA-3';反向5'-ACGACGGGCAAAGGTAGGCAC-3',218 bp;miR-671-5p引物正向5'-AGGAAGCCCTGGAGG-3',反向5'-GAACATGTCTGCGTATCTC-3' ,207 bp;GAPDH 引物正向5'-CAGCCTCAAGATCATCAGCA-3',反向5'-GTCTTCTGGGTGGCAGTGAT-3',235 bp;U6引物正向5'-AAAGCAAATCATC-GGACGACC-3',反向5'-GTACAACACATTGTTTCCTCGGA-3',224 bp。PCR 反应体系:cDNA 5µL,SYBR Green 10µL,正、反向引物各0.4 µL,H2O 4.2 µL。扩增条件:95 ℃30 s;95 ℃10 s,60 ℃15 s,共38 个循环。GAPDH 或U6 作为内部对照,采用2-ΔΔCt法计算目的基因相对表达量。
1.2.3 Western blot 分析CBX4 蛋白的相对表达 用总蛋白提取试剂盒制备蛋白样品,用BCA蛋白测定试剂盒测定蛋白浓度,98 ℃变性10 min。对等量的蛋白质进行SDS-PAGE和硝酸纤维素膜转移。用Western阻断缓冲液阻断非特异性结合位点后,用CBX4 或GAPDH 一抗和相应二抗孵育膜,化学发光试剂显色。采用Quantity One 软件,以GAPDH 为内参,对灰度值进行半定量分析。
1.2.4 双荧光素酶报告基因分析验证miR-671-5p 与CircCDR1as 或CBX4 的关系 通过StarBase(http://starbase.sysu.edu.cn/index.php)预测miR-671-5p 与CircCDR1as 或CBX4 的潜在结合位点。克隆含有miR-671-5p 结合位点的CircCDR1as 或CBX4 3'-UTR 序列,然后将其连接至psiCHECK-2 双荧光素酶载体上,生成野生型荧光素酶报告基因载体(CircCDR1as-WT 和CBX4-WT)和相应的突变体(CircCDR1as-MUT 和CBX4-MUT)。然后,将构建的荧光素酶报告基因载体和miR-671-5p 或miR-NC 转染A549 细胞。转染24 h后,用双荧光素酶测定系统测定萤火虫和海肾的荧光素酶活性。各组萤火虫荧光素酶活性归一化为海肾荧光素酶活性,实验组相对荧光素酶活性归一化为对照组。
1.2.5 MTT 实验评估细胞活力 转染后,收集A549 细胞,调整细胞密度至3×104个/mL。于96 孔板中加入细胞悬液(100 µL/孔),分别培养0、1、2、3 d。在指定的时间点,添加MTT溶液(10µL/孔)再孵育4 h。然后除去培养基,每孔加入100µL 二甲基亚砜溶解晶体,通过酶标仪测定490 nm 波长下的光密度(OD)值。
1.2.6 克隆形成实验分析细胞增殖能力 A549 细胞(每孔300 个细胞)接种于6 孔板。培养10 d 后,用甲醇固定细胞,1%结晶紫染色,显微镜下计数克隆形成情况。
1.2.7 流式细胞术评估细胞凋亡 A549 细胞(每孔1×105个)接种于24 孔板,培养3 d。将细胞重悬于结合缓冲液中,用5µL FITC和PI避光染色10 min。流式细胞仪检测凋亡细胞。凋亡率以右上、下象限细胞占总细胞数的百分比表示。
1.2.8 Transwell法评价细胞迁移、侵袭 采用Transwell嵌套24 孔板测试其迁移和侵袭能力。Transwell 小室上室预涂Matrigel 胶用于侵袭实验,未处理的Transwell 小室用于迁移实验。转染后,用无血清DMEM 制备3×105个/mL 的A549 细胞悬液,并将100µL的细胞悬液放入上室。下室加入含10%血清的DMEM。孵育24 h 后,将迁移或侵袭的细胞固定,用0.1%结晶紫染色,然后在100倍显微镜下选取3个视野观察。
1.3 统计学方法 采用GraphPad Prism 7 进行统计分析,符合正态分布的计量资料以均数±标准差()表示。2组间比较采用t检验,多组间比较采用单因素方差分析,组间多重比较行SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 NSCLC 细胞中CircCDR1as、CBX4 表达上调,miR-671-5p 表达下调 与HBE 细胞相比,CircCDR1as 在4 种NSCLC 细胞系中的表达增加,miR-671-5p 表达降低,CBX4 mRNA 和蛋白水平升高(P<0.05),见图1、表1。且A549细胞中CircCDR1as的表达最高(F=328.965,P<0.05),故选择该细胞进行后续实验。
Tab.1 CircCDR1as,miR-671-5p and CBX4 levels in HBE cells and NSCLC cell lines表1 HBE细胞和NSCLC细胞系中CircCDR1as、miR-671-5p、CBX4表达水平 (n=6,)

Tab.1 CircCDR1as,miR-671-5p and CBX4 levels in HBE cells and NSCLC cell lines表1 HBE细胞和NSCLC细胞系中CircCDR1as、miR-671-5p、CBX4表达水平 (n=6,)
**P<0.01;a与HBE比较,P<0.05。
细胞系HBE NCI-H524 NCI-H1734 Calu-3 A549 F CircCDR1as 1.00±0.01 3.92±0.14a 4.09±0.21a 4.15±0.19a 4.29±0.28a 328.965**miR-671-5p 1.00±0.02 0.59±0.05a 0.52±0.06a 0.41±0.04a 0.32±0.02a 243.424**CBX4 mRNA 1.00±0.02 2.86±0.14a 2.95±0.18a 3.18±0.23a 3.32±0.25a 160.266**CBX4蛋白1.00±0.03 2.54±0.11a 2.63±0.14a 2.75±0.21a 2.89±0.16a 175.065**

Fig.1 CBX4 protein expression in HBE cells and NSCLC cell lines图1 HBE细胞和NSCLC细胞系中CBX4蛋白的表达
2.2 CircCDR1as 在NSCLC 细胞中靶向调控miR-671-5p CircCDR1as 和miR-671-5p 的预测结合位点见图2。与miR-NC+CircCDR1as-WT 组相比,miR-671-5p+CircCDR1as-WT 组相对荧光素酶活性降低(1.00±0.02vs.0.39±0.01,n=6,t=66.822,P<0.05);miR-NC+CircCDR1as-MUT 组与miR-671-5p+CircCDR1as-MUT 组相对荧光素酶活性差异无统计学意义(1.00±0.01vs.1.02±0.04,n=6,t=1.188,P>0.05)。此外,在A549细胞中,与pcDNA组相比,CircCDR1as 组miR-671-5p 表达降低(1.00±0.03vs.0.36±0.02,n=6,t=43.479,P<0.05);与si-NC 组相比,si-CircCDR1as 组miR-671-5p 表达升高(1.01±0.05vs.2.14±0.11,n=6,t=22.907,P<0.05)。
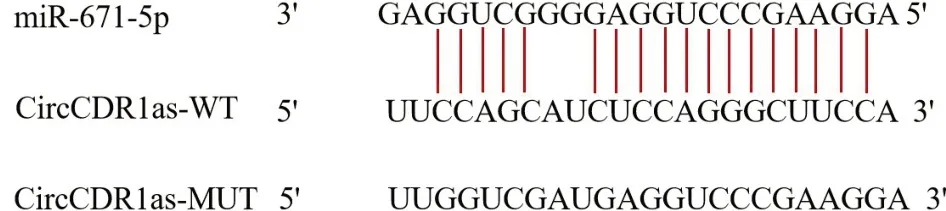
Fig.2 The binding sites of CircCDR1as and miR-671-5p predicted by starBase图2 通过starBase预测CircCDR1as和miR-671-5p的结合位点
2.3 miR-671-5p的敲低可减弱CircCDR1as沉默对NSCLC 细胞生物学行为的影响 与Control 组和si-NC组相比,si-CircCDR1as组CircCDR1as表达降低,miR-671-5p 表达升高,细胞活力降低,克隆形成数减少,凋亡率增高,迁移和侵袭细胞数减少(P<0.05);与si-CircCDR1as 组、si-CircCDR1as+antimiR-NC 组相比,si-CircCDR1as+anti-miR-671-5p组CircCDR1as 表达升高,miR-671-5p 表达下降,细胞活力增高,克隆形成数增多,凋亡率降低,迁移和侵袭细胞数增多(P<0.05),见图3、表2。
Tab.2 Comparison of NSCLC cell viability,number of clone formation,apoptosis rate,migration and number of invasive cells between the five groups表2 各组NSCLC细胞活力、克隆形成数、凋亡率、迁移侵袭细胞数比较(n=6,)

Tab.2 Comparison of NSCLC cell viability,number of clone formation,apoptosis rate,migration and number of invasive cells between the five groups表2 各组NSCLC细胞活力、克隆形成数、凋亡率、迁移侵袭细胞数比较(n=6,)
**P<0.01;a与Control组比较,b与si-NC组比较,c与si-CircCDR1as组比较,d与si-CircCDR1as+anti-miR-NC组比较,P<0.05。
组别Control组si-NC组si-CircCDR1as组si-CircCDR1as+anti-miR-NC组si-CircCDR1as+anti-miR-671-5p组F CircCDR1as 1.00±0.03 1.00±0.02 0.38±0.03ab 0.39±0.02 0.91±0.05cd 611.941**miR-671-5p 1.00±0.02 0.99±0.03 1.78±0.06ab 1.75±0.08 1.26±0.05cd 328.761**细胞活力(OD490值)1.18±0.21 1.17±0.19 0.49±0.07ab 0.47±0.06 0.99±0.12cd 36.693**克隆形成数(个)91.45±7.62 91.38±7.49 38.62±3.51ab 38.67±3.48 80.59±6.72cd 121.564**凋亡率(%)10.02±0.91 10.01±0.89 33.45±2.62ab 33.48±2.14 14.13±1.06cd 315.182**迁移细胞数(个)94.38±8.12 94.29±7.91 40.15±10.03ab 40.18±10.06 79.84±9.21cd 55.305**侵袭细胞数(个)97.56±6.89 97.54±6.85 41.32±8.74ab 41.35±6.95 80.69±7.24cd 90.091**
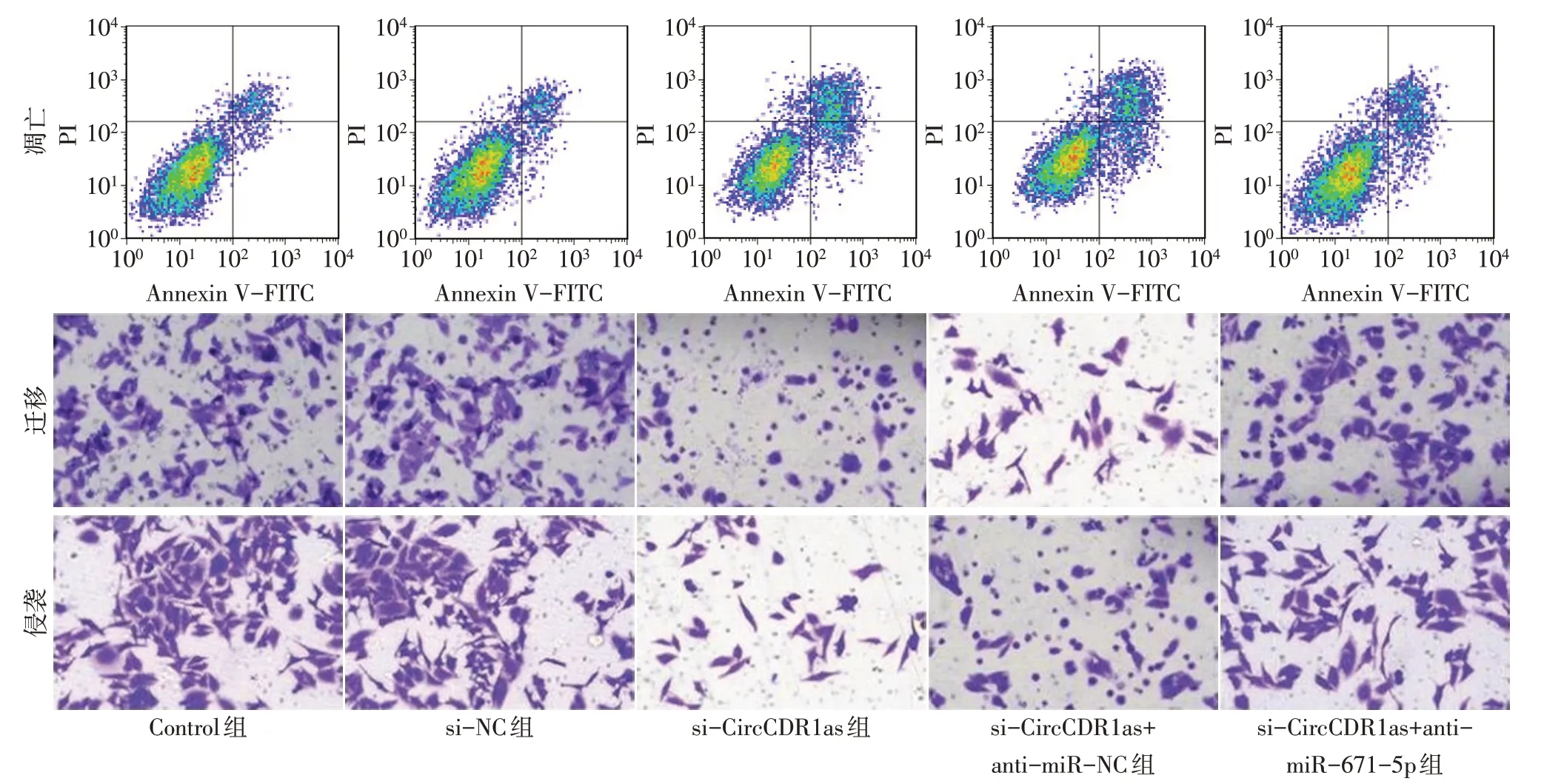
Fig.3 Apoptosis,migration and invasion of NSCLC cells in each group(crystal violet staining,×200)图3 各组NSCLC细胞凋亡、迁移和侵袭情况(结晶紫染色,×200)
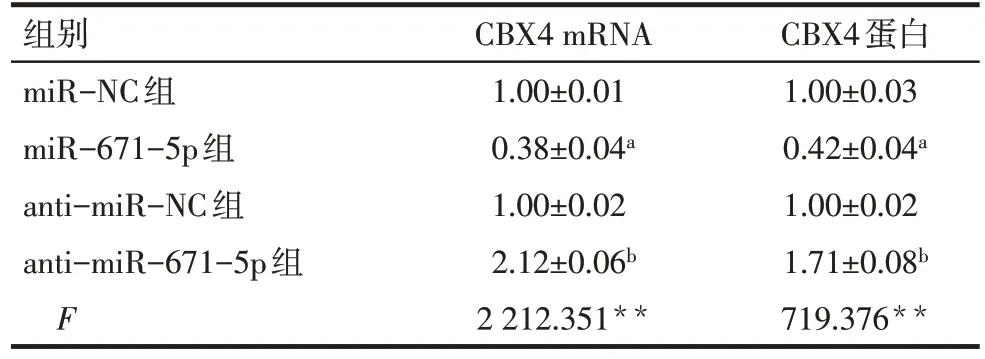
2.4 CBX4 是miR-671-5p 在NSCLC 细胞中的靶点 StarBase 预测结果显示miR-671-5p 与CBX4 有潜在结合位点,见图4。与miR-NC+CBX4-WT组相比,miR-671-5p+CBX4-WT组相对荧光素酶活性降低(1.00±0.03vs.0.41±0.02,n=6,t=40.083,P<0.05);miR-671-5p+CBX4-MUT 组与miR-NC+CBX4-MUT组相对荧光素酶活性差异无统计学意义(1.02±0.03vs.1.00±0.05,n=6,t=0.840,P>0.05)。此外,miR-671-5p 组与miR-NC 组相比,CBX4 的mRNA和蛋白表达水平下降(P<0.05);anti-miR-671-5p组与anti-miR-NC 组相比,CBX4的mRNA 和蛋白表达水平增高(P<0.05),见图5、表3。
Tab.3 Comparison of mRNA and protein levels of CBX4 in A549 cells between the four groups表3 各组A549细胞中CBX4的mRNA和蛋白水平比较(n=6,)
Tab.3 Comparison of mRNA and protein levels of CBX4 in A549 cells between the four groups表3 各组A549细胞中CBX4的mRNA和蛋白水平比较(n=6,)
**P<0.01;a与miR-NC组比较,b与anti-miR-NC组比较,P<0.05。
组别miR-NC组miR-671-5p组anti-miR-NC组anti-miR-671-5p组F CBX4 mRNA 1.00±0.01 0.38±0.04a 1.00±0.02 2.12±0.06b 2 212.351**CBX4蛋白1.00±0.03 0.42±0.04a 1.00±0.02 1.71±0.08b 719.376**
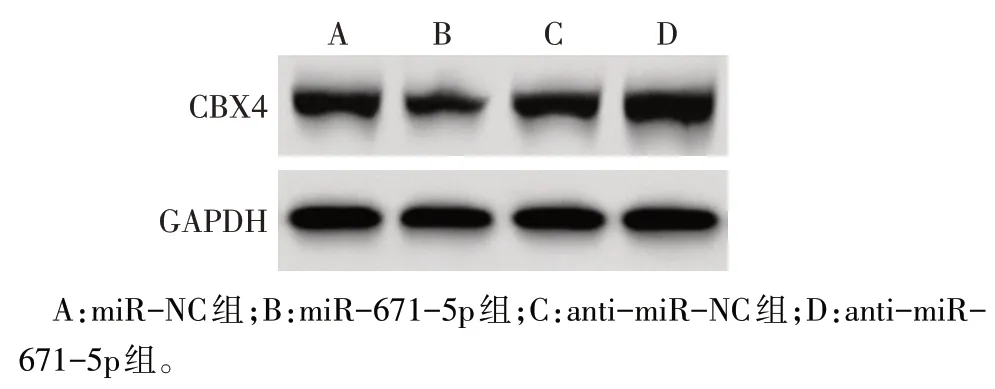
Fig.5 CBX4 protein expression in A549 cells of each group图5 各组A549细胞中CBX4蛋白表达

Fig.4 The binding sites of miR-671-5p and CBX4 predicted by StarBase图4 StarBase预测miR-671-5p和CBX4的结合位点
2.5 miR-671-5p 通过降低NSCLC 细胞中CBX4 抑制细胞活力、迁移和侵袭,促进凋亡 与miR-NC组和Control 组相比,miR-671-5p 组CBX4 mRNA 和蛋白表达降低,细胞活力降低,克隆形成数减少,凋亡率增高,迁移和侵袭细胞数减少(P<0.05);与miR-671-5p 组、miR-671-5p+pcDNA 组相比,miR-671-5p+CBX4 组CBX4 mRNA 和蛋白表达升高,细胞活力增高,克隆形成数增多,凋亡率降低,迁移和侵袭细胞数增多(P<0.05),见图6、7,表4。
Tab.4 Comparison of NSCLC cell viability,number of clone formation,apoptosis rate,migration and number of invasive cells between the five groups表4 各组NSCLC细胞活力、克隆形成数、凋亡率、迁移和侵袭细胞数比较(n=6,)
**P<0.01;a与Control组比较,b与miR-NC组比较,c与miR-671-5p组比较,d与miR-671-5p+pcDNA组比较,P<0.05。
组别Control组miR-NC组miR-671-5p组miR-671-5p+pcDNA组miR-671-5p+CBX4组F CBX4 mRNA 1.00±0.02 0.99±0.03 0.36±0.03ab 0.37±0.02 0.84±0.05cd 613.941**CBX4蛋白1.00±0.03 1.01±0.05 0.33±0.02ab 0.32±0.04 0.81±0.05cd 455.051**细胞活力(OD值)1.09±0.15 1.07±0.13 0.46±0.05ab 0.48±0.06 1.03±0.11cd 55.276**克隆细胞数97.68±5.49 97.75±5.63 39.54±2.16ab 39.57±2.13 82.36±4.25cd 297.408**凋亡率(%)8.24±0.13 8.26±0.15 34.52±2.31ab 34.39±2.46 13.64±1.02cd 441.727**迁移细胞数86.34±3.52 86.38±3.61 40.15±2.03ab 40.19±2.05 81.23±3.12cd 412.551**侵袭细胞数78.69±2.63 78.72±2.62 35.42±1.89ab 35.51±1.92 67.49±2.01cd 585.024**

Fig.6 Expression of CBX4 protein in A549 cells of each group图6 各组A549细胞中CBX4蛋白表达

Fig.7 Apoptosis,migration and invasion of NSCLC cells in each group(crystal violet staining,×200)图7 各组NSCLC细胞凋亡、迁移和侵袭情况(结晶紫染色,×200)
2.6 沉默CircCDR1as通过调控miR-671-5p来降低NSCLC 细胞中CBX4 的表达 与Control 组和si-NC组相比,si-CircCDR1as 组CBX4 mRNA 和蛋白表达显著降低(P<0.05);与si-CircCDR1as 组、si-CircCDR1as+anti-miR-NC 组相比,si-CircCDR1as+anti-miR-671-5p组CBX4 mRNA和蛋白表达显著增高(P<0.05),见图8、表5。
Tab.5 Comparison of CBX4 expression in NSCLC cells between the five groups表5 各组NSCLC细胞CBX4表达的比较(n=6,)
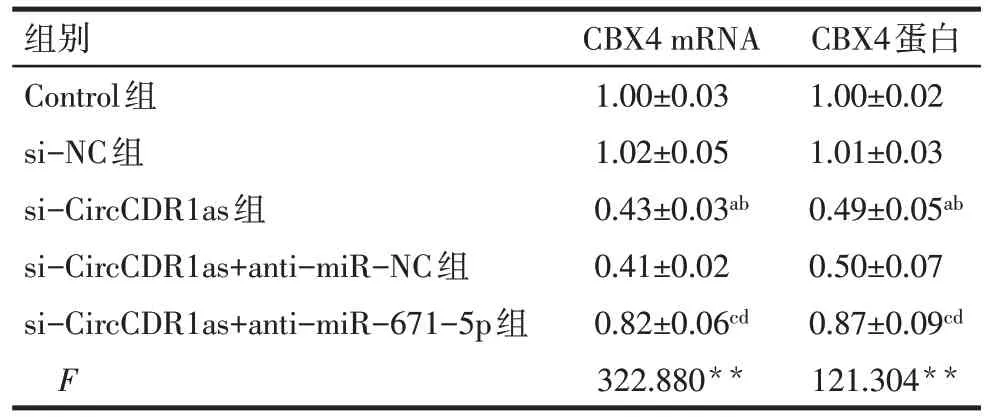
Tab.5 Comparison of CBX4 expression in NSCLC cells between the five groups表5 各组NSCLC细胞CBX4表达的比较(n=6,)
**P<0.01;a与Control组比较,b与si-NC组比较,c与si-CircCDR1as组比较,d与si-CircCDR1as+anti-miR-NC组比较,P<0.05。
组别Control组si-NC组si-CircCDR1as组si-CircCDR1as+anti-miR-NC组si-CircCDR1as+anti-miR-671-5p组F CBX4 mRNA 1.00±0.03 1.02±0.05 0.43±0.03ab 0.41±0.02 0.82±0.06cd 322.880**CBX4蛋白1.00±0.02 1.01±0.03 0.49±0.05ab 0.50±0.07 0.87±0.09cd 121.304**

Fig.8 CBX4 protein expression in A549 cells of each group图8 各组A549细胞中CBX4蛋白表达
3 讨论
CircRNAs 在癌细胞中异常表达,可能是癌症诊断和治疗的潜在靶点[17]。由于肿瘤微环境的改变,CircCDR1as可以在不同的癌症中作为致癌或抑癌基因发挥作用[8-11]。Zhang 等[12]报道了CircCDR1as 在NSCLC 中的异常表达。然而,CircCDR1as 在NSCLC发展中的作用机制尚不明确。本研究在体外验证了CircCDR1as 基因沉默对NSCLC 发展的抑制作用并揭示了CircCDR1as/miR-671-5p/CBX4 在NSCLC 细胞中的调节机制。
CircRNAs 在肺癌的肿瘤发生中发挥了关键作用。本研究发现,CircCDR1as在NSCLC 细胞中的表达明显增高,提示CircCDR1as 高表达可能导致NSCLC的恶性进展。肿瘤生长和转移是肺癌恶性进展的两个关键调控因素[18]。为了探讨CircCDR1as在NSCLC治疗中的潜在价值,本研究通过功能缺失实验发现CircCDR1as沉默可抑制NSCLC细胞活力,减少克隆形成数和迁移、侵袭细胞数,提高细胞凋亡率,这与既往Zhang 等[12,19]的报道相似,提示CircCDR1as 沉默在NSCLC 细胞中发挥抗癌作用。上皮细胞向间充质细胞的转化被认为是调节肺癌发生转移的重要机制[20]。因此,CircCDR1as 可否通过诱导上皮-间充质转化来促进细胞生长、迁移和侵袭还有待进一步研究。
CircRNAs 可以作为miRNAs的“海绵”参与癌症的发展[21]。一些报道已经证明CircCDR1as 可以通过调节下游miRNA 的水平来调控肿瘤进展的过程[11,22]。此前的研究发现,CircCDR1as 通过吸附miR-671-5p 促进口腔鳞状细胞癌细胞自噬[23]。与此一致的是,本研究通过双荧光素酶报告基因检测证实CircCDR1as在NSCLC细胞中是miR-671-5p的“海绵”。本研究还发现miR-671-5p 在NSCLC 细胞中的表达下降,其过表达抑制了NSCLC 细胞活力,降低了克隆形成数和迁移、侵袭细胞数,升高了细胞凋亡率,这也与之前的研究[24]一致。这表明miR-671-5p在NSCLC中的抗癌作用。此外,本研究数据显示,CircCDR1as沉默对NSCLC 进展的抑制作用被miR-671-5p抑制剂削弱,揭示了CircCDR1as可能通过海绵吸附miR-671-5p 促进NSCLC 发展的可能性。
为了进一步阐明CircCDR1as 的作用机制,本研究分析了miR-671-5p 的靶点。以往的研究已经证实miR-671-5p 在不同条件下具有多种靶点,如MFAP3L、TUFT1 等[12,25]。本研究证实了miR-671-5p 和CBX4 在NSCLC 细胞中的靶向关系。CBX4 是一种SUMO E3连接酶,也被称为HPC2,其作为一种相对保守的PcG 蛋白,参与肿瘤发生和细胞周期调控[26]。本研究发现,CBX4 在NSCLC 细胞中的表达增加,提示CBX4 的高表达可能促进了NSCLC 的发生发展,这与Hu等[15]的研究结果类似。在常氧条件下,CBX4 在乳腺癌[27]和胃癌[28]等多种肿瘤中具有促增殖、促转移和抑凋亡作用。同样,本研究也发现CBX4 的高表达可以促进细胞的增殖、迁移和侵袭,并抑制细胞凋亡,与之前的研究[15]一致。同时,本研究结果显示,CBX4 逆转了miR-671-5p 对NSCLC 进展的抑制作用,提示miR-671-5p 通过靶向CBX4 抑制NSCLC 进展。 此外,本研究发现,下调CircCDR1as 可以通过调控miR-671-5p 在NSCLC 细胞中水平来降低CBX4的表达。由于体外细胞培养条件不能完全模拟体内肿瘤微环境,后续研究应利用小鼠肺癌模型进行临床前分析。
综上所述,CircCDR1as 在NSCLC 细胞中均高表达。沉默CircCDR1as可能通过上调miR-671-5p、降低CBX4表达来抑制细胞增殖、迁移和侵袭,促进细胞凋亡,进而抑制NSCLC 的进展,这可能有助于深入了解NSCLC恶性进展的机制。

