白藜芦醇调控Nrf2-GPX4通路对H2O2诱导肺泡上皮细胞铁死亡的影响
李艳萍,王协涛,史立彬,刘琼
根据独特的形态特征,细胞死亡主要被分为细胞凋亡、自噬性细胞死亡以及坏死[1]。2012 年,Dixon提出铁死亡的概念,这种细胞死亡方式是基于脂质活性氧物质的积累而引起的铁依赖性调节的细胞死亡形式,具有不同于其他形式的分子特征[2],在器官损伤以及肿瘤、神经退行性病变等疾病中起着关键作用[3]。铁死亡不仅表现为线粒体变小、膜密度增高和嵴减少,还表现为脂质过氧化升高。研究表明铁死亡也与肺部疾病密切相关[4]。白藜芦醇(Resveratrol,RES)是一种天然植物抗毒素多酚,可从浆果、葡萄皮及花生中提取,具有抗氧化、调节线粒体呼吸、抗炎及抗癌等特性[5-6]。然而,RES 对过氧化氢(H2O2)诱导的肺泡上皮细胞损伤的影响尚不清楚。研究表明,核因子E2 相关因子2(nuclear factor E2 related factor 2,Nrf2)是调节抗氧化反应的关键因素之一,谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)4 是受Nrf2 调控的基因之一,且Nrf2-GPX4 通路对铁死亡的调节发挥重要作用[7]。研究表明,激活Nrf2-GPX4通路、抑制铁死亡可改善尿毒症引起的急性肺损伤[8]。但该通路在H2O2处理的肺泡上皮细胞中是否具有同样的作用尚未得到证实。本研究以H2O2处理肺泡上皮细胞A549,通过检测铁死亡相关指标,探究RES对H2O2诱导A549细胞铁死亡以及Nrf2-GPX4信号通路的影响。
1 材料与方法
1.1 材料 A549 细胞购自中国科学院上海细胞库。RES(上海源叶生物科技有限公司);H2O2溶液(上海赫澎生物科技有限公司);Nrf2抑制剂ML385(北京百奥莱博科技有限公司);MTT 试剂(上海泽叶生物技术有限公司);丙二醛(MDA)、还原型谷胱甘肽(GSH)、超氧化物歧化酶(SOD)酶联免疫吸附试验(ELISA)试剂盒(上海酶联生物科技有限公司);铁离子试剂盒(浙江奥的特生物技术有限公司);兔抗人Nrf2、GPX4、血红素加氧酶(HO-1)、β-actin 一抗及羊抗兔IgG 二抗(Abcam 公司)。CO2培养箱、Talos F200X S/TEM 透射电子显微镜(Thermo scientific公司)。
1.2 研究方法
1.2.1 细胞培养、分组及干预 将A549 细胞使用含10%胎牛血清的DMEM 培养基接种,置于37 ℃、5%CO2培养箱中培养,待细胞生长至80%~90%融合时进行传代。取对数生长期细胞,按随机数字表法分为对照组、H2O2组、RES 低浓度(RES-L)组、RES中浓度(RES-M)组、RES高浓度(RES-H)组、ML385 组、RES-H+ML385 组。除对照组外,其余各组均经0.5 mmol H2O2处理细胞[9]。24 h后,RES-L组、RES-M组、RES-H组分别设置培养基中RES浓度为50、100、150 µmol/L干预[10];ML385 组设置培养基中ML385 浓度为2 µmol/L干预[11];RES-H+ML385组设置培养基中RES、ML385浓度分别为150µmol/L、2µmol/L干预,干预48 h后进行指标分析。
1.2.2 MTT法检测细胞活力 取各组对数生长期A549细胞接种于96 孔板,避光条件下每孔加入10µL MTT 试剂,室温孵育4 h后,加入150µL DMSO,采用酶标仪在490 nm波长处测量光密度(OD490)。细胞存活率(%)=(实验组OD490/对照组OD490)×100%。
1.2.3 铁离子含量的检测 取各组细胞,使用离心机以3 000 r/min离心15 min,留取上清液,严格按照铁离子试剂盒说明书检测铁离子含量。
1.2.4 线粒体形态变化观察 将各组细胞使用2.5%戊二醛固定,定位后制备50~70 nm超薄切片,利用枸橼铅酸染色,于透射电子显微镜下观察。
1.2.5 ELISA 测定细胞内氧化应激水平 收集各组细胞,严格按照ELISA 试剂盒方法测定各组细胞中MDA、SOD、GSH含量。
1.2.6 Western blot 法检测细胞中Nrf2、GPX4、HO-1 蛋白表达水平 蛋白提取试剂盒提取各组细胞总蛋白,定量后,进行电泳分离、转膜,脱脂奶粉封闭,依次加入Nrf2、GPX4、HO-1、β-actin 一抗(均1∶1 000),4 ℃恒温箱过夜;次日加入二抗(1∶2 000),以ECL 发光试剂、凝胶成像仪进行检测,以βactin为内参,分析细胞中不同蛋白的表达水平。
1.3 统计学方法 采用SPSS 22.0 软件进行数据分析,计量资料以均数±标准差()表示,2 组间均数比较行t检验,多组间比较采用单因素方差分析,组间多重比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 RES 对H2O2诱导的A549 细胞存活率和铁离子含量的影响 与对照组相比,H2O2组A549细胞存活率降低,铁离子含量增加(P<0.05);与H2O2组相比,RES-L组、RES-M组、RES-H组A549细胞存活率逐渐升高,铁离子含量逐渐降低(P<0.05),但ML385组A549细胞存活率明显降低,铁离子含量增加(P<0.05);与RES-H 组相比,RES-H+ML385 组A549 细胞存活率降低,铁离子含量升高(P<0.05);与ML385 组相比,RES-H+ML385 组A549 细胞存活率升高,铁离子含量降低(P<0.05),见表1。
Tab.1 Comparison of survival rate and iron content of A549 cells between different groups表1 各组A549细胞存活率和铁离子含量比较(n=6,)

Tab.1 Comparison of survival rate and iron content of A549 cells between different groups表1 各组A549细胞存活率和铁离子含量比较(n=6,)
**P<0.01;a与对照组比较,b与H2O2组比较,c与RES-L 组比较,d与RES-M组比较,e与RES-H组比较,f与ML385组,P<0.05。
组别对照组H2O2组RES-L组RES-M组RES-H组ML385组RES-H+ML385组F细胞存活率(%)100.00±0.00 36.27±1.88a 51.15±2.34b 66.29±2.61bc 95.82±2.87bcd 21.35±1.25b 37.01±1.69ef 1 368.036**铁离子含量(µg/g)95.12±9.51 238.61±23.84a 182.36±18.23b 142.31±14.23bc 95.72±9.57bcd 279.64±27.94b 236.12±23.61ef 86.010**
2.2 RES 对H2O2诱导A549 细胞内氧化应激水平的影响 与对照组相比,H2O2组A549 细胞内SOD、GSH 含量降低,MDA 含量增加(P<0.05);与H2O2组相比,RES-L 组、RES-M 组、RES-H 组A549 细胞内SOD、GSH 含量依次增加,MDA 含量依次降低(P<0.05),但ML385 组A549 细胞内SOD、GSH 含量降低,MDA 含量增加(P<0.05);与RES-H 组相比,RES-H+ML385组A549细胞内SOD、GSH含量降低,MDA 含量增加(P<0.05);与ML385 组相比,RESH+ML385 组A549 细胞内SOD、GSH 含量增加,MDA含量降低(P<0.05),见表2。
Tab.2 Comparison of oxidative stress levels in A549 cells between different groups表2 各组A549细胞内氧化应激水平比较(n=6,)
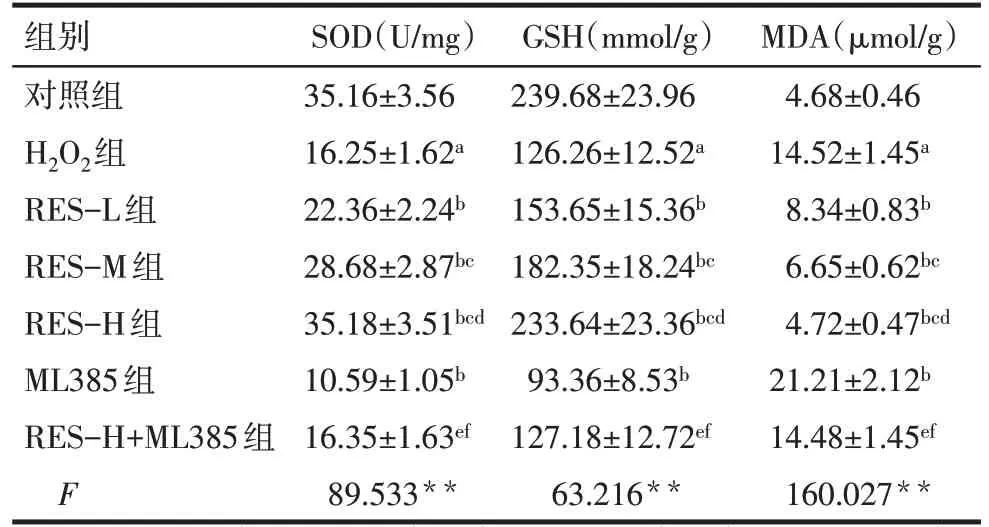
Tab.2 Comparison of oxidative stress levels in A549 cells between different groups表2 各组A549细胞内氧化应激水平比较(n=6,)
**P<0.01;a与对照组比较,b与H2O2组比较,c与RES-L 组比较,d与RES-M组比较,e与RES-H组比较,f与ML385组,P<0.05。
组别对照组H2O2组RES-L组RES-M组RES-H组ML385组RES-H+ML385组F SOD(U/mg)35.16±3.56 16.25±1.62a 22.36±2.24b 28.68±2.87bc 35.18±3.51bcd 10.59±1.05b 16.35±1.63ef 89.533**GSH(mmol/g)239.68±23.96 126.26±12.52a 153.65±15.36b 182.35±18.24bc 233.64±23.36bcd 93.36±8.53b 127.18±12.72ef 63.216**MDA(µmol/g)4.68±0.46 14.52±1.45a 8.34±0.83b 6.65±0.62bc 4.72±0.47bcd 21.21±2.12b 14.48±1.45ef 160.027**
2.3 RES 对H2O2诱导A549 细胞线粒体形态变化的影响 与对照组相比,H2O2组A549细胞线粒体发生膜皱缩、密度增加、面积缩小等形态损伤;与H2O2组相比,RES-L组、RES-M组、RES-H组线粒体形态损伤现象逐渐得到改善,但ML385 组线粒体形态损伤进一步加重;与RES-H组相比,RES-H+ML385组线粒体形态损伤明显加重;与ML385组相比,RES-H+ML385组损伤程度轻微改善,见图1。

Fig.1 Mitochondrial morphological changes of A549 cells in each group(×10 000)图1 各组A549细胞线粒体形态变化(×10 000)
2.4 RES 对H2O2诱导A549 细胞Nrf2、GPX4、HO-1蛋白表达水平的影响 与对照组相比,H2O2组Nrf2、GPX4、HO-1 蛋白表达水平降低(P<0.05);与H2O2组相比,RES-L 组、RES-M 组、RES-H 组Nrf2、GPX4、HO-1 蛋白表达水平依次增加(P<0.05),但ML385组Nrf2、GPX4、HO-1蛋白表达水平依次降低(P<0.05);与RES-H 组相比,RES-H+ML385 组Nrf2、GPX4、HO-1 蛋白表达水平降低(P<0.05);与ML385 组相比,RES-H+ML385 组Nrf2、GPX4、HO-1蛋白表达水平增加(P<0.05),见图2、表3。
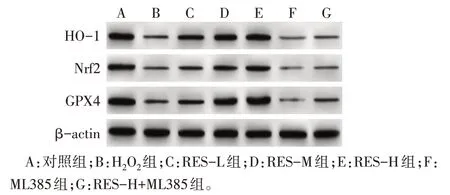
Fig.2 Western blot results of Nrf2,GPX4 and HO-1 proteins in A549 cells of each group图2 各组A549细胞中Nrf2、GPX4、HO-1蛋白免疫印迹图
Tab.3 Comparison of protein expression levels of Nrf2,GPX4 and HO-1 in A549 cells between different groups表3 各组A549细胞中Nrf2、GPX4、HO-1蛋白表达水平比较(n=6,)

Tab.3 Comparison of protein expression levels of Nrf2,GPX4 and HO-1 in A549 cells between different groups表3 各组A549细胞中Nrf2、GPX4、HO-1蛋白表达水平比较(n=6,)
**P<0.01;a与对照组比较,b与H2O2组比较,c与RES-L 组比较,d与RES-M组比较,e与RES-H组比较,f与ML385组,P<0.05。
组别对照组H2O2组RES-L组RES-M组RES-H组ML385组RES-H+ML385组F Nrf2 0.76±0.07 0.28±0.03a 0.42±0.04b 0.59±0.06bc 0.73±0.07bcd 0.11±0.01b 0.26±0.02ef 160.317**HO-1 0.89±0.09 0.31±0.03a 0.56±0.05b 0.72±0.07bc 0.87±0.08bcd 0.18±0.02b 0.28±0.03ef 149.344**GPX4 0.94±0.09 0.35±0.03a 0.54±0.05b 0.73±0.07bc 0.92±0.09bcd 0.16±0.02b 0.37±0.03ef 147.147**
3 讨论
了解肺脏上皮干/祖细胞的调控网络有助于研究肺损伤等呼吸系统疾病进展的机制[12]。肺泡细胞是肺脏上皮干/祖细胞的一种,研究影响肺泡细上皮胞氧化损伤的机制对于呼吸系统疾病的治疗意义重大。
铁元素在人体中发挥重要作用,正常状态下,细胞中铁含量处于平衡状态,参与细胞的正常发育和存活,而铁含量一旦超出细胞可容纳的范围时则标志着铁死亡的发生。铁死亡诱导因子可通过不同途径直接或间接影响GPX 表达,导致细胞内抗氧化能力下降、脂质活性氧积累,最终导致细胞发生氧化损伤。近年来的研究表明,铁死亡与血液疾病、缺血再灌注损伤、肿瘤、神经系统疾病、肾损伤等多种疾病的病理生理过程密切相关,因此通过抑制铁死亡来治疗相关疾病已成为当前研究的热点[13]。铁死亡涉及的因素较多,包括顺铂、细颗粒物等。H2O2作为一种强氧化剂,可以破坏细胞分子,使其处于氧化应激状态,产生脂质过氧化物,造成铁离子过度积累,最终使细胞受损死亡[3,14]。本研究采用H2O2诱导A549细胞,结果发现H2O2组线粒体形态较对照组受损严重,细胞存活率、SOD、GSH 含量均明显降低,铁离子、MDA含量明显增加,提示H2O2可使A549细胞产生铁死亡。
RES是一种多酚,具有抗氧化应激特性,可通过抑制铁死亡来保护脑出血大鼠免受神经损伤[15]。Li等[16]研究证实RES通过抑制氧化应激、铁死亡,对氧葡萄糖剥夺/复氧(OGD/R)诱导的H9c2 细胞起保护作用。Zhang 等[17]研究发现RES 可以缓解内质网应激,抑制丙烯醛诱导的铁死亡。本研究发现,与H2O2组相比,随着RES剂量的增加,线粒体形态损伤状况得到改善,细胞存活率、SOD、GSH含量逐渐增加,铁离子、MDA 含量逐渐下降,表明RES 尤其高剂量RES可以提高抗氧化应激水平,抑制细胞损伤,避免铁死亡。
Nrf2-GPX4信号通路可影响与铁死亡相关的酶和蛋白质的转录调节[18]。Wu 等[19]研究发现激活Nrf2信号通路可促进下游HO-1、GPX4水平表达,抑制葡萄糖诱导的系膜细胞铁死亡。Liu 等[20]研究发现淫羊藿苷可通过激活Nrf2/HO-1 信号通路,抑制缺氧/复氧诱导的心肌细胞铁死亡。本研究结果显示,H2O2组Nrf2、GPX4、HO-1 蛋白表达较对照组均降低,说明H2O2诱导的A549细胞中Nrf2-GPX4信号通路处于阻滞状态;与H2O2组相比,RES随着剂量的增加,Nrf2、GPX4、HO-1 蛋白表达逐渐增加,表明RES 可能通过激活Nrf2-GPX4 信号通路,降低氧化应激水平,减轻H2O2诱导的A549细胞铁死亡。为进一步验证该猜想,本研究使用Nrf2 抑制剂ML385 处理H2O2诱导的A549 细胞,结果发现细胞存活率、SOD、GSH 含量以及Nrf2、GPX4、HO-1 蛋白表达较H2O2组均降低,铁离子、MDA含量增加,同时可逆转RES对A549细胞的保护作用,说明RES可通过激活Nrf2-GPX4通路,减轻H2O2诱导的A549细胞中氧化应激以及铁死亡。
综上所述,RES 可以降低氧化应激水平,减轻H2O2诱导的A549 细胞铁死亡,作用机制与Nrf2-GPX4信号通路的激活有关,但本研究仅在体外证实了RES对H2O2诱导的A549细胞铁死亡的影响机制,在体内的作用机制还需继续探索。

