LncRNA SNHG11通过抑制miR-184/CARM1信号轴促进卵巢癌生长
李少儒,李燕,刘珊,户瑞丽
卵巢癌是女性常见的恶性肿瘤,手术联合辅助化疗是其主要治疗方案,但存在肿瘤易复发、转移及产生耐药的缺点,患者5年生存率为35%~38%,分子靶向治疗为卵巢癌治疗的一个新方向[1-2]。研究认为,肿瘤的转移、侵袭与基因表达失调有关,LncRNA在参与调控肿瘤进展及转移方面发挥重要作用[3]。研究发现,LncRNA SNHG11在前列腺癌组织中表达水平异常升高,LncRNA SNHG11 可通过抑制miR-184 表达,上调胰岛素样生长因子受体-1(insulinlike growth factor receptor 1,IGF-1R)表达,从而促进前列腺癌细胞的增殖、迁移与侵袭[4]。miR-184 在上皮性卵巢癌(epithelial ovarian cancer,EOC)组织与细胞中表达下调,且在晚期(Ⅲ/Ⅳ)EOC组织中表达水平明显较低,miR-184 低表达的患者5 年生存率明显下降;体外研究显示,过表达miR-184可抑制EOC 细胞增殖及炎症反应,诱导EOC 细胞凋亡[5]。共激活相关精氨酸甲基转移酶1(coactivatorassociated arginine methyltransferase 1,CARM1)在卵巢癌中高表达,其高表达与患者预后差有关[6]。目前,有关LncRNA SNHG11在卵巢癌中的作用尚不清楚。生物信息学分析显示,miR-184与CARM1有结合位点,推测LncRNA SNHG11 可能通过调节miR-184/CARM1 轴影响卵巢癌的发生、发展。本研究旨在探讨LncRNA SNHG11 对卵巢癌细胞增殖、凋亡、迁移及侵袭的影响及可能机制,为卵巢癌新的靶向治疗提供理论依据。
1 材料与方法
1.1 材料 选取2019 年5 月—2021 年6 月于新乡医学院第一附属医院手术治疗的EOC 患者33 例,其中浆液性腺癌22例、黏液性腺癌8 例、子宫内膜样腺癌3 例,术中留取患者卵巢癌组织及癌旁组织(距离癌组织>3 cm),研究经本院伦理委员会批准(批准文号:2019-00316)。SPF级BALB/c雌性裸鼠48 只,4~6 周龄,体质量18~22 g,购自北京维通利华实验动物技术有限公司,动物生产许可证号:SCXK(京)2016-0009。人卵巢正常上皮细胞IOSE80 及卵巢癌细胞系Hey、ES2、SKOV3、A2780 购自美国ATCC 细胞库。LncRNA SNHG11 干扰质粒(si-SNHG11)及阴性对照(si-NC)、miR-184 抑制剂(anti-miR-184)及阴性对照(anti-NC)、miR-184模拟物(miR-184 mimics)及阴性对照(miR-NC)、CARM1 过表达质粒及阴性对照(pcDNA)、引物序列(miR-184、LncRNA SNHG11、CARM1)均购自广州锐博生物科技有限公司;总RNA 提取试剂(R1100)、One Step SuperRT-PCR Mix Ki(tT2240)购自北京索莱宝科技有限公司;Lipo6000™转染试剂、SYBR Green qPCR Mix、Dual-Lumi™Ⅱ双荧光素酶报告基因检测试剂盒购自碧云天生物科技有限公司;CCK-8试剂盒购自AbMole 公司;Annexin V-FITC/PI 细胞凋亡检测试剂盒购自翌圣生物科技股份有限公司;兔抗人CARM1、E-cadherin、N-cadherin抗体购自英国Abcam公司。
1.2 研究方法
1.2.1 细胞培养及分组 IOSE80及Hey、ES2、SKOV3、A2780细胞接种至含10%胎牛血清的DMEM培养基培养48 h,提取细胞总RNA,检测细胞LncRNA SNHG11 与miR-184 表达。将对数生长期的SKOV3 细胞接种于6 孔板中,将细胞分为si-NC 组(转染si-NC)、si-SNHG11 组(转染si-SNHG11)、si-SNHG11+anti-NC 组( 转染 si-SNHG11+anti-NC)、si-SNHG11+anti-miR-184组(转染si-SNHG11+anti-miR-184)、miR-NC 组(转染miR-NC)、miR-184 mimics 组(转染miR-184 mimics)、miR-184 mimics+pcDNA 组(转染miR-184 mimics+pcDNA)、miR-184 mimics+CARM1 组(转染miR-184 mimics+pcDNA-CARM1),每组设置6 个复孔,细胞融合至60%时,按照Lipo6000™转染试剂盒说明书转染48 h 后检验转染效率。
1.2.2 实时荧光定量PCR(real time quantitative PCR,qRTPCR)检测LncRNA SNHG11、miR-184及CARM1 mRNA 相对表达水平 卵巢癌组织、癌旁组织、卵巢癌细胞系及各组转染细胞经胰酶消化后制备成细胞悬液,提取总RNA,检测RNA 的纯度和浓度,使用One Step SuperRT-PCR Mix Kit 合成cDNA 并进行PCR 扩增。LncRNA SNHG11:上游5'-TGGGAGTTGTCATGTTGGGA-3' , 下 游 5'-ACTCGTCACTCTTGGTCTGT-3';miR-184:上游5'-GACGGAGAACT-GATAAGG-3' ,下游5'-GAACATGTCTGCGTATCTC-3' ;CARM1:上游5'-TCGCCACACCCAACGATTT-3',下游5'-GTACTGCACGGCAGAAGACT-3' ;GAPDH:上游5'-ATGTTCGTCATGGGTGTGAA-3',下游5'-CAGTGATGGCATGGACTGT-3';U6:上游5'-CTCGCTTCGGCAGCACATATACT-3',下游5'-ACGCTTCACGAATTTGCGTGTC-3'。反应条件:45 ℃反转录30 min;95 ℃预变性60 s,95 ℃变性15 s、62 ℃延伸45 s,40个循环。miR-184以U6为内参、LncRNA SNHG11和CARM1 mRNA以GAPDH为内参,采用2-ΔΔCt方法计算相对表达水平。
1.2.3 CCK-8法检测细胞增殖水平 转染后以每孔2×105个SKOV3 细胞接种至96 孔板中,于培养24、48、72 h 时,采用CCK-8 法检测细胞增殖活性,酶标仪测定450 nm 波长处光密度(OD)值,绘制生长曲线。
1.2.4 细胞凋亡检测 SKOV3 细胞转染48 h 后,胰酶消化,300×g、4 ℃离心5 min 收集细胞,磷酸盐缓冲液(PBS)洗涤,加入200µL的Binding Buffer,再加入5µL Annexin V-FITC和10µL的PI,避光孵育15 min,流式细胞仪分析细胞凋亡水平。
1.2.5 Transwell 小室法检测SKOV3 细胞迁移与侵袭 将无血清培养基稀释的SKOV3 细胞加入Transwell 上室中,侵袭实验Transwell 上室涂有Matrigel 基质胶,下室加入含10%胎牛血清的培养基,培养24 h后,70%乙醇固定,0.1%结晶紫染色,显微镜下随机抽取5个视野计算迁移与侵袭细胞数。
1.2.6 Western blot 检测CARM1、E-cadherin、N-cadherin 蛋白相对表达水平 提取转染后各组SKOV3细胞总蛋白,BCA法检测蛋白浓度,定量后取30µg蛋白煮沸变性,SDS-PAGE电泳并转膜,加入CARM1、E-cadherin、N-cadherin 一抗(1∶1 000),4 ℃孵育过夜,再加入HRP标记的IgG二抗(1∶1 500),室温孵育1 h,ECL试液显色,以β-actin为内参,Quantity One软件分析蛋白相对表达量。
1.2.7 裸鼠成瘤实验检测各组细胞在动物体内的成瘤能力 各组细胞培养24 h后,使用PBS调整细胞浓度1×107个/mL,分别皮下接种于裸鼠右前肢腋下,第21天脱颈处死小鼠,分离瘤体,测量体积并称质量,每组6只小鼠。
1.2.8 双荧光素酶活性检测 根据StarBase(https://starbase.sysu. edu. cn/starbase2/index. php)和TargetScan(http://www.targetscan.org/vert_72/)在线数据库分析LncRNA SNHG11、CARM1与miR-184有无靶向结合位点,将LncRNA SNHG11、CARM1 与miR-184 的结合位点与突变位点克隆至PmirGLO载体,构建LncRNA SNHG11、CARM1 野生型(SNHG11-wt、CARM1-wt)及突变型(SNHG11-mut、CARM1-mut)荧光素酶报告载体,分别与miR-NC、miR-184 mimics 共转染SKOV3细胞48 h,检测相对荧光素酶活性。
1.3 统计学方法 采用SPSS 25.0 和GraphPad Prism 8.0 软件进行数据分析。符合正态分布的计量数据以表示,多组间比较采用单因素方差分析,组间多重比较采用SNK-q检验,2组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 LncRNA SNHG11 在卵巢癌组织及癌旁组织中表达情况 LncRNA SNHG11 在卵巢癌组织(2.31±0.52)表达水平高于癌旁组织(1.05±0.12),差异有统计学意义(n=33,t=13.886,P<0.01)。
2.2 LncRNA SNHG11 与miR-184 在卵巢癌细胞系中表达 与人卵巢正常上皮细胞IOSE80比较,在卵巢癌细胞系Hey、ES2、SKOV3、A2780 中LncRNA SNHG11 表达水平升高,miR-184 表达水平降低(P<0.05),见表1。其中在SKOV3 细胞中,LncRNA SNHG11 与miR-184 表达水平差异最大,故选择SKOV3细胞进行后续实验。
Tab.1 Comparison of expression levels of LncRNA SNHG11 and miR-184 between different ovarian cancer cell lines表1 不同卵巢癌细胞系中LncRNA SNHG11与miR-184表达水平比较(n=6,)

Tab.1 Comparison of expression levels of LncRNA SNHG11 and miR-184 between different ovarian cancer cell lines表1 不同卵巢癌细胞系中LncRNA SNHG11与miR-184表达水平比较(n=6,)
**P<0.01;a 与IOSE80 比较,b 与Hey 比较,c 与ES2 比较,d 与SKOV3比较,P<0.05。
IOSE80 Hey ES2 SKOV3 A2780 F LncRNA SNHG11 1.01±0.10 1.66±0.32a 2.23±0.37a 3.25±0.54abc 1.93±0.41ad 28.717**miR-184 1.02±0.13 0.71±0.08a 0.47±0.05ab 0.23±0.04abc 0.52±0.06abd 84.242**
2.3 抑制LncRNA SNHG11表达后各组细胞生物学行为和瘤体大小比较 与si-NC组比较,si-SNHG11组SKOV3 细胞增殖活性下降,细胞凋亡率升高,迁移与侵袭细胞数下降,E-cadherin 蛋白表达水平升高,N-cadherin蛋白表达水平下降,瘤体质量与体积减小(P<0.05);与si-SNHG11+anti-NC 组比较,si-SNHG11+anti-miR-184 组SKOV3 细胞增殖活性升高,细胞凋亡率下降,迁移与侵袭细胞数升高,E-cadherin蛋白表达水平降低,N-cadherin蛋白表达水平升高,瘤体质量与体积增大(P<0.05),见图1—3、表2。

Fig.1 Effect of inhibiting the expression of LncRNA SNHG11 on the proliferation of SKOV3 cells图1 抑制LncRNA SNHG11表达对SKOV3细胞增殖的影响

Fig.2 Comparison of apoptosis,migration and invasion of SKOV3 cells between the four groups after inhibiting lncRNA SNHG11 expression图2 抑制LncRNA SNHG11表达后各组SKOV3细胞凋亡、迁移与侵袭比较
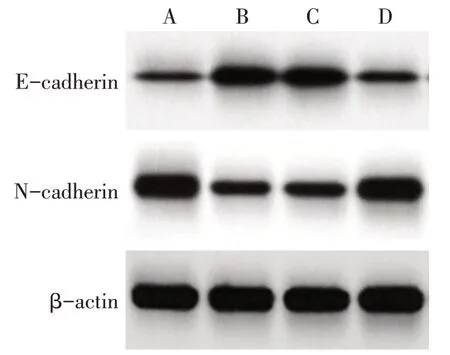
Fig.3 Comparison of E-cadherin and N-cadherin protein expression between the four groups after inhibiting LncRNA SNHG11 expression图3 抑制LncRNA SNHG11表达后各组E-cadherin、N-cadherin蛋白表达比较
Tab.2 Comparison of cell proliferation,apoptosis,migration and invasion,tumor mass and volume between the four groups after inhibition of LncRNA SNHG11 expression表2 抑制LncRNA SNHG11表达后各组细胞增殖、凋亡、迁移及侵袭、瘤体质量与体积比较 (n=6,)

Tab.2 Comparison of cell proliferation,apoptosis,migration and invasion,tumor mass and volume between the four groups after inhibition of LncRNA SNHG11 expression表2 抑制LncRNA SNHG11表达后各组细胞增殖、凋亡、迁移及侵袭、瘤体质量与体积比较 (n=6,)
**P<0.01;a与si-NC组比较,b与si-SNHG11组比较,c与si-SNHG11+anti-NC组比较,P<0.05;表3同。
组别si-NC组si-SNHG11组si-SNHG11+anti-NC组si-SNHG11+anti-miR-184组F细胞凋亡率(%)2.43±0.78 25.32±4.61a 23.65±3.82 12.47±2.66bc 62.853**迁移细胞数(个/视野)145.27±8.31 68.33±4.68a 65.27±4.75 123.63±8.47bc 207.937**侵袭细胞数(个/视野)126.53±7.23 54.37±4.36a 57.70±5.21 106.43±6.13bc 227.120**E-cadherin 0.21±0.04 0.87±0.08a 0.83±0.09 0.37±0.05bc 140.731**N-cadherin 1.13±0.12 0.51±0.07a 0.47±0.08 1.01±0.10bc 77.176**瘤体质量(g)1.53±0.32 0.81±0.25a 0.87±0.27 1.33±0.28bc 9.359**瘤体体积(mm3)1 258.62±35.46 423.68±20.46a 411.32±18.42 734.45±26.23bc 1 398.970**
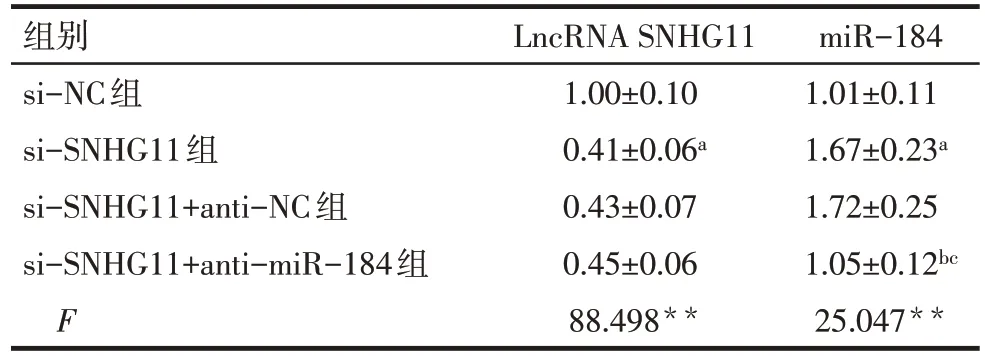
2.4 LncRNA SNHG11 与miR-184 的靶向关系验证 StarBase v2 软件预测显示,LncRNA SNHG11 与miR-184有结合位点,见图4。双荧光素酶检测结果显示,与miR-NC+SNHG11-wt 组(1.01±0.12)比较,miR-184 mimics+SNHG11-wt 组(0.35±0.06)荧光素酶活性降低(n=6,t=12.050,P<0.01),miR-NC+SNHG11-mut 组(1.03±0.13)与miR-184 mimics+SNHG11-mut 组(0.98±0.11)荧光素酶活性差异无统计学意义(n=6,t=0.719,P>0.05)。qRT-PCR 分析显示,与si-NC 组比较,si-SNHG11 组miR-184 表达水平升高(P<0.05);与si-SNHG11+anti-NC 组比较,si-SNHG11+anti-miR-184 组miR-184 表达水平降低(P<0.05),见表3。

Fig.4 Predicted binding sites of LncRNA SNHG11 and miR-184图4 LncRNA SNHG11与miR-184结合位点预测
Tab.3 Expression of LncRNA SNHG11 and miR-184 in SKOV3 cells in each group表3 各组SKOV3 细胞LncRNA SNHG11、miR-184相对表达水平比较(n=6,)
Tab.3 Expression of LncRNA SNHG11 and miR-184 in SKOV3 cells in each group表3 各组SKOV3 细胞LncRNA SNHG11、miR-184相对表达水平比较(n=6,)
组别si-NC组si-SNHG11组si-SNHG11+anti-NC组si-SNHG11+anti-miR-184组F LncRNA SNHG11 1.00±0.10 0.41±0.06a 0.43±0.07 0.45±0.06 88.498**miR-184 1.01±0.11 1.67±0.23a 1.72±0.25 1.05±0.12bc 25.047**
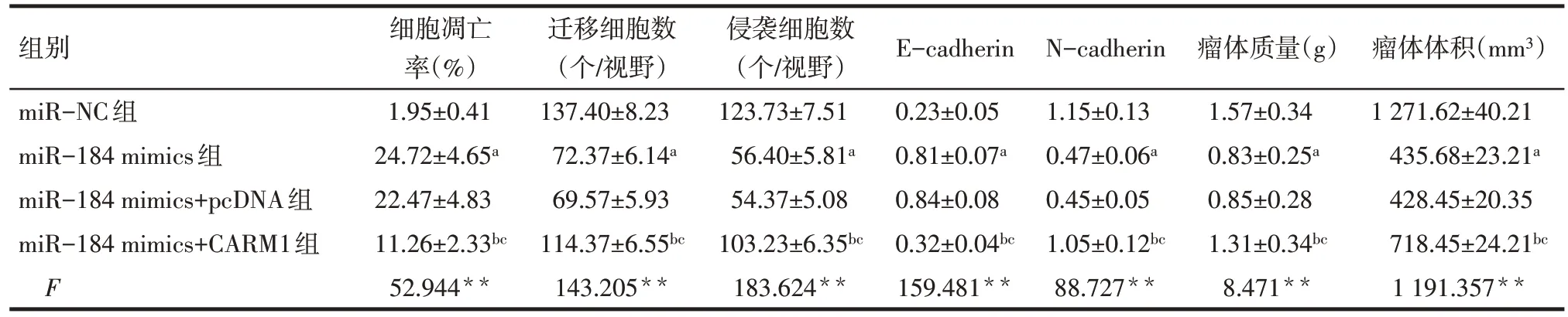
2.5 过表达miR-184 后各组SKOV3 细胞生物学行为和瘤体大小比较 与miR-NC 组比较,miR-184 mimics 组SKOV3细胞增殖活性降低,细胞凋亡率升高,迁移与侵袭细胞数降低,E-cadherin蛋白表达水平升高,N-cadherin蛋白表达水平下降,瘤体质量与体积减小(P<0.05);与miR-184 mimics+pcDNA 组比较,miR-184 mimics+CARM1组SKOV3细胞增殖活性升高,细胞凋亡率降低,迁移与侵袭细胞数升高,E-cadherin蛋白表达水平降低,N-cadherin蛋白表达水平升高,瘤体质量与体积增大(P<0.05),见图5—7、表4。
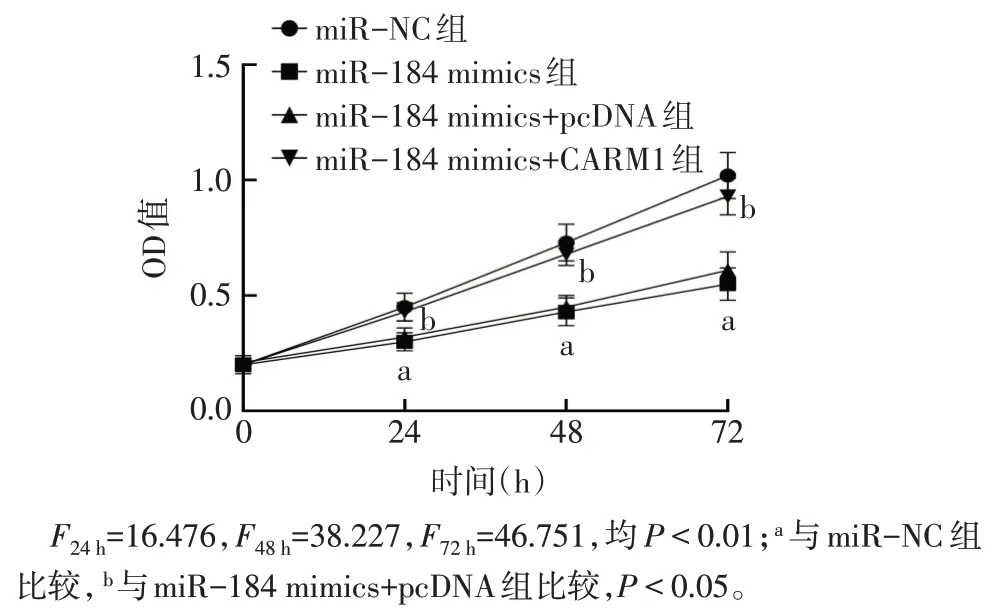
Fig.5 Effect of over-expression of miR-184 on proliferation of SKOV3 cells图5 过表达miR-184对SKOV3细胞增殖的影响
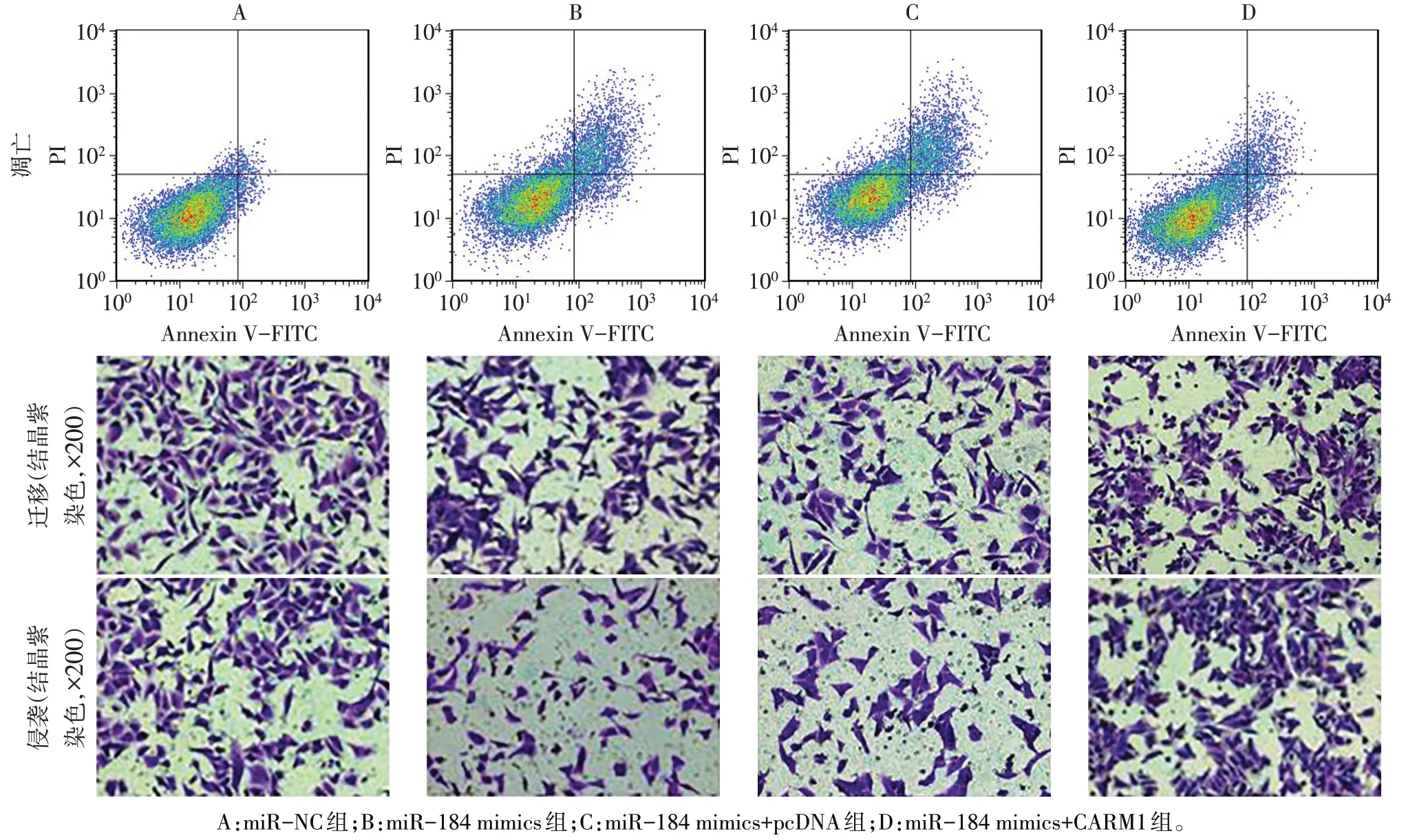
Fig.6 Comparison of apoptosis,migration and invasion of SKOV3 cells between the four groups after over-expression of miR-184图6 过表达miR-184后各组SKOV3细胞凋亡、迁移与侵袭比较
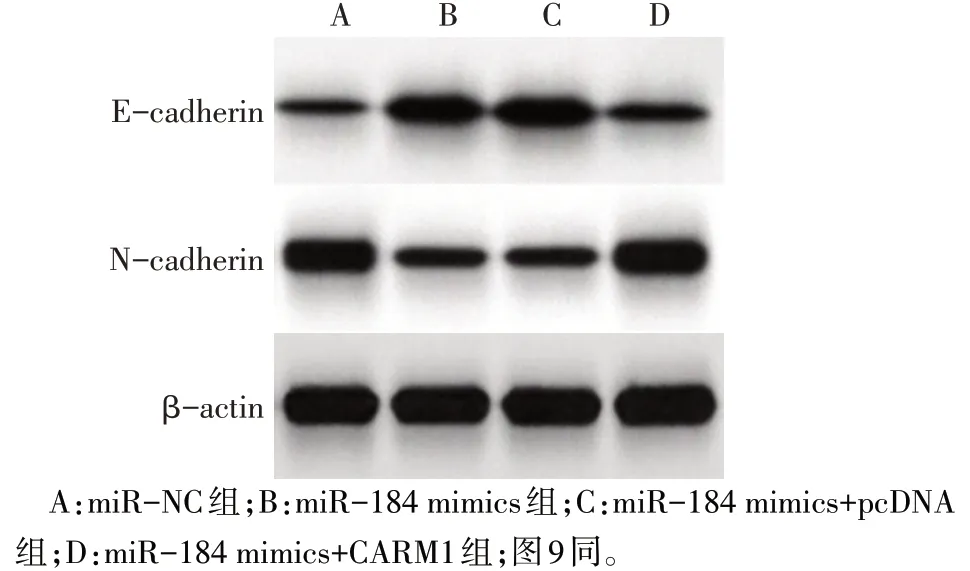
Fig.7 Comparison of E-cadherin and N-cadherin protein expression between the four groups after over-expression of miR-184图7 过表达miR-184后各组E-cadherin、N-cadherin蛋白表达比较
Tab.4 Comparison of proliferation,apoptosis,migration,invasion,tumor mass and volume of SKOV3 cells between the four groups after over-expressing miR-184表4 过表达miR-184后各组SKOV3细胞增殖、凋亡、迁移及侵袭、瘤体质量与体积比较(n=6,)
Tab.4 Comparison of proliferation,apoptosis,migration,invasion,tumor mass and volume of SKOV3 cells between the four groups after over-expressing miR-184表4 过表达miR-184后各组SKOV3细胞增殖、凋亡、迁移及侵袭、瘤体质量与体积比较(n=6,)
**P<0.01;a与miR-NC组比较,b与miR-184 mimics组比较,c与miR-184 mimics+pcDNA组比较,P<0.05。
组别miR-NC组miR-184 mimics组miR-184 mimics+pcDNA组miR-184 mimics+CARM1组F细胞凋亡率(%)1.95±0.41 24.72±4.65a 22.47±4.83 11.26±2.33bc 52.944**迁移细胞数(个/视野)137.40±8.23 72.37±6.14a 69.57±5.93 114.37±6.55bc 143.205**侵袭细胞数(个/视野)123.73±7.51 56.40±5.81a 54.37±5.08 103.23±6.35bc 183.624**E-cadherin 0.23±0.05 0.81±0.07a 0.84±0.08 0.32±0.04bc 159.481**N-cadherin 1.15±0.13 0.47±0.06a 0.45±0.05 1.05±0.12bc 88.727**瘤体质量(g)1.57±0.34 0.83±0.25a 0.85±0.28 1.31±0.34bc 8.471**瘤体体积(mm3)1 271.62±40.21 435.68±23.21a 428.45±20.35 718.45±24.21bc 1 191.357**
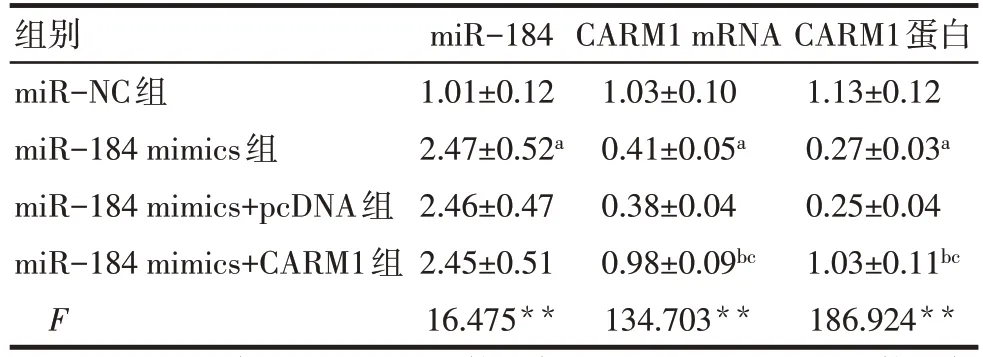
2.6 miR-184与CARM1的靶向关系验证 TargetScan预测显示,miR-184 与CARM1 基因有靶向结合位点,见图8。双荧光素酶实验结果显示,与miR-NC+CARM1-wt 组(1.00±0.10)比较,miR-184 mimics+CARM1-wt 组(0.41±0.05)荧光素酶活性显著降低(n=6,t=12.926,P<0.01)。miR-NC+CARM1-wt 组(0.98±0.11) 与 miR-184 mimics+CARM1-wt 组(1.01±0.12)荧光素酶活性差异无统计学意义(n=6,t=0.451,P>0.05)。在SKOV3 细胞中过表达miR-184 可显著下调CARM1 mRNA 及蛋白表达水平(P<0.05),见表5、图9。

Fig.8 Verification of the targeting relationship between miR-184 and CARM1图8 miR-184与CARM1的靶向关系验证
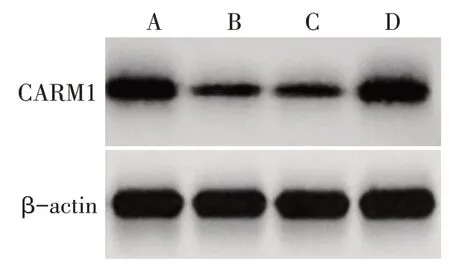
Fig.9 Comparison of CARM1 protein expression in SKOV3 cells between the four groups after over-expression of miR-184图9 过表达miR-184后各组SKOV3细胞CARM1蛋白表达比较
Tab.5 Comparison of miR-184,CARM1 mRNA and protein expression between the four groups after overexpression of miR-184表5 过表达miR-184后各组miR-184、CARM1 mRNA及蛋白表达比较(n=6,)
Tab.5 Comparison of miR-184,CARM1 mRNA and protein expression between the four groups after overexpression of miR-184表5 过表达miR-184后各组miR-184、CARM1 mRNA及蛋白表达比较(n=6,)
**P<0.01;a与miR-NC 组比较,b与miR-184 mimics 组比较,c与miR-184 mimics+pcDNA组比较,P<0.05。
组别miR-NC组miR-184 mimics组miR-184 mimics+pcDNA组miR-184 mimics+CARM1组F miR-184 1.01±0.12 2.47±0.52a 2.46±0.47 2.45±0.51 16.475**CARM1 mRNA 1.03±0.10 0.41±0.05a 0.38±0.04 0.98±0.09bc 134.703**CARM1蛋白1.13±0.12 0.27±0.03a 0.25±0.04 1.03±0.11bc 186.924**
3 讨论
在肿瘤领域LncRNA SNHGs 被广泛研究,如SNHG12、SNHG15、SNHG16等均已证实与肿瘤恶性进展有关[7]。研究显示,LncRNA SNHG11与多种肿瘤的发生密切相关,在三阴性乳腺癌(TNBC)组织与细胞中,LncRNA SNHG11高表达并可通过“海绵”效应降低miR-2355-5p 表达和上调CBX5 表达,促进TNBC 细胞的增殖和迁移[8]。在胶质瘤中,LncRNA SNHG11 通过靶向下调miR-154-5p 表达,从而促进胶质瘤细胞增殖、侵袭和迁移[9]。在结直肠癌中,LncRNA SNHG11 可通过上调HIF-1α 表达水平,促进缺氧条件下结肠癌细胞的迁移,并与结直肠癌患者的不良预后有关[10]。然而,目前有关LncRNA SNHG11在卵巢癌中作用的研究鲜见。本研究结果显示,LncRNA SNHG11在卵巢癌组织与细胞中表达水平升高,提示LncRNA SNHG11可能与卵巢癌的发生有关。本研究在SKOV3 细胞中抑制LncRNA SNHG11表达后,SKOV3细胞增殖活性下降,迁移与侵袭能力降低,瘤体质量与体积降低,细胞凋亡率升高,表明LncRNA SNHG11在卵巢癌中发挥促癌基因的作用。肿瘤细胞转移是肿瘤治疗的主要障碍之一,E-cadherin、N-cadherin是肿瘤细胞上皮-间质转化(EMT)的标志物,E-cadherin的减少与N-cadherin的增多均可促进肿瘤的迁移与侵袭[11]。本研究亦发现,抑制LncRNA SNHG11 表达后,SKOV3 细胞E-cadherin 表达水平升高,N-cadherin 表达水平降低,提示抑制LncRNA SNHG11 后,EMT 也可能受到抑制,进而抑制了SKOV3 细胞的迁移和侵袭。由此笔者推测,LncRNA SNHG11通过调控卵巢癌细胞增殖、迁移、侵袭与EMT,从而促进卵巢癌发生、发展。
LncRNA 通过海绵效应调控miRNA 而参与肿瘤的发生、发展[12]。Huang 等[13]研究表明,在肝癌中,LncRNA SNHG11 的高表达可下调miR-184 表达,升高Argonaute-2(AGO2)表达,从而促进肝癌细胞增殖、迁移,并抑制细胞凋亡。本研究证实,LncRNA SNHG11 与miR-184 存在靶向关系。在前列腺癌中,miR-184 通过直接抑制DLX1 基因表达,抑制前列腺癌细胞的增殖、迁移和侵袭[14]。在鼻咽癌中,miR-184 呈低表达,过表达miR-184 通过靶向Notch2 抑制鼻咽癌的侵袭、迁移和转移[15]。本研究显示,miR-184 在卵巢癌细胞中表达下调,过表达miR-184 可抑制卵巢癌细胞增殖、迁移、侵袭及EMT,提示miR-184在卵巢癌中发挥抑癌基因的作用,而抑制miR-184表达可逆转LncRNA SNHG11表达下调对卵巢癌细胞生物学行为的影响,提示LncRNA SNHG11 可靶向抑制miR-184表达促进卵巢癌发生、发展。
CARM1 属于蛋白质精氨酸甲基转移酶家族,参与转录、细胞周期和细胞自噬等多种生物学功能,在卵巢癌、乳腺癌、食管癌等肿瘤中高表达,其主要通过反式激活转录因子促进恶性肿瘤的进展[16-17]。本研究亦显示,miR-184 可靶向调节CARM1 表达,影响SKOV3 细胞的增殖、凋亡、迁移、侵袭及成瘤能力,miR-184 与CARM1 存在靶向关系,且SKOV3 细胞中过表达miR-184 可降低CARM1 表达水平,而过表达CARM1 可逆转过表达miR-184 对SKOV3 细胞增殖、迁移、侵袭及成瘤的影响。以上结果表明,抑制LncRNA SNHG11 表达可通过靶向调节miR-184/CARM1 轴,抑制SKOV3 细胞增殖、迁移与侵袭,诱导肿瘤细胞凋亡。
综上所述,LncRNA SNHG11 在卵巢癌组织与细胞中高表达,其通过调节miR-184/CARM1信号轴,促进卵巢癌生长。

