银屑病瘙痒的神经免疫机制
字佳琦 邓丹琪
昆明医科大学第二附属医院皮肤性病科,云南昆明,650101
银屑病是一种慢性、系统性、炎症性疾病,具有遗传背景,其特征是皮肤出现红斑、鳞屑和淋巴细胞浸润,影响全球超过1.25 亿人[1]。大约70%~90%的银屑病患者诉有瘙痒[2],不受控制的瘙痒会对身体、社会和心理健康产生不利影响。由于目前对银屑病相关瘙痒的发病机制仍不清楚,治疗瘙痒症状的选择有限。银屑病瘙痒涉及神经系统、免疫系统、内分泌系统和血管系统等,本文将重点介绍银屑病瘙痒的神经、免疫机制。
1 神经系统(图1)
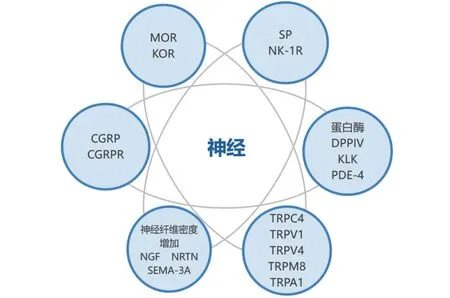
图1 银屑病瘙痒潜在神经因素
1.1 阿片受体的表达异常 阿片受体是中枢及外周神经系统瘙痒感觉的调节器,其分为四种类型: MOR、DOR、KOR、NOP受体,MOR受体诱导瘙痒,而KOR受体缓解瘙痒[3]。在咪喹莫特(IMQ)诱导的银屑病小鼠模型中,MOR在表皮、背根神经节(DRG)和脊髓中表达增加,而KOR在DRG中表达降低,在表皮中检测不到,使用MOR抑制剂(纳洛酮)以及KOR激动剂(ICI-199,441)可以抑制银屑病小鼠的抓挠行为[3]。该研究证明了阿片受体的表达异常与银屑病瘙痒有一定的相关性。纳曲酮(naltrexone)是一种长效阿片类拮抗剂,被证明有助于治疗银屑病、特应性皮炎等皮肤病的慢性瘙痒[4]。
1.2 神经肽
1.2.1 P物质(SP) 有研究发现,SP在银屑病患者的皮损中升高[5]。SP是典型的应激相关神经肽,在介导神经源性皮肤炎症和转导瘙痒和疼痛方面起着至关重要的作用,其中机制为:SP通过在角质形成细胞中合成IL-32等细胞因子参与炎症反应,促进银屑病皮损中促炎细胞因子的释放,促进肥大细胞的激活、脱颗粒并释放类胰蛋白酶、凝乳酶和组胺等炎症介质[5],从而诱导瘙痒。神经激肽-1受体(NK-1R)是一种SP的受体,与瘙痒和伤害性反应有关,NK-1R也在银屑病皮损中高表达[5]。NK-1R抑制剂阿瑞匹坦(aprepitant)已被报道能有效治疗慢性瘙痒[6]。舍洛匹坦(serlopitant)是另一种NK-1R拮抗剂,可减轻轻度至中度银屑病患者的瘙痒[7]。
1.2.2 降钙素基因相关肽(CGRP) CGRP参与了瘙痒的调节,严重瘙痒症患者的CGRP浓度显著升高[8]。有研究发现,在有瘙痒的银屑病患者中血浆CGRP及皮损CGRP受体水平较高且与瘙痒严重程度相关[9]。其中机制为:CGRP可以作用于各种免疫细胞引起神经炎症、神经源性血管扩张和免疫反应[8]。
1.3 蛋白酶 二肽基肽酶IV(DPPIV)是一种表达在活化的T细胞表面的跨膜丝氨酸肽酶。Komiya等[10]发现DPPIV可将全长SP1-11降解为SP5-11,银屑病患者的皮损中DPPIV及截短型SP水平升高显著加重了银屑病皮损,并与小鼠抓挠行为增加有关。使用DPPIV抑制剂西格列汀(Sitagliptin)可以抑制银屑病模型小鼠的抓挠行为[10]。
磷酸二酯酶-4(PDE-4)是一种介导炎性反应的酶,在银屑病中将其底物环磷酸腺苷降解为一磷酸腺苷,从而导致促炎介质的产生。口服和外用PDE-4抑制剂如阿普司特(apremilast)和罗氟司特(roflumilast)可有效治疗银屑病皮损、缓解银屑病患者瘙痒[12]。
1.4 神经纤维密度增加 银屑病患者皮肤中神经密度的增加(和)或瘙痒神经纤维的高度敏化降低了机体瘙痒阈值而促进瘙痒[9]。
1.4.1 神经营养生长因子 神经生长因子(NGF)是一种神经营养因子。有研究发现,在银屑病皮肤中NGF水平及其高亲和力受体酪氨酸激酶A( TrkA)表达升高[5]。Kupczyk等[13]研究发现,银屑病瘙痒皮损处角质形成细胞中神经标志物蛋白基因产物9.5(PGP 9.5)、NGF量、TrkA受体表达及PGP9.5阳性轴突神经末梢数量均显著高于非瘙痒皮肤组和健康对照组,表明了神经纤维密度的增加是瘙痒传递的主要因素。NGF与受体结合通过促进淋巴细胞增殖和肥大细胞释放组胺和类胰蛋白酶、促进血管生成、刺激SP和CGRP的合成、引起角质形成细胞的分化和过度增殖而促进皮肤炎症及瘙痒发生[5]。Roblin等[14]发现外用TrkA抑制剂CT 327可降低皮损神经末梢密度,缓解银屑病患者的瘙痒。
神经妥林(NRTN)是另一种神经营养因子,对非肽能感觉神经元的发育和维持非常重要。Sakai等[15]发现在银屑病小鼠皮肤中NRTN的表达使非肽能纤维密度增加,用NRTN中和抗体处理降低了表皮非肽能纤维密度并减少了小鼠自发性抓挠[15]。
1.4.2 信号素3A(SEMA-3A) SEMA-3A是一种可抑制感觉神经C纤维向外生长的轴突导向分子,Kou等[16]发现SEMA-3A在银屑病表皮中表达量降低,且降低程度与严重程度、瘙痒强度呈正相关。
1.5 瞬时受体电位 (TRP)离子通道 TRP离子通道是非选择性钙离子渗透性阳离子通道,根据序列同源性将其分为六个亚组:TRPC、TRPV、TRPM、TRPA、TRPP和TRPML[9]。TRPC4在银屑病患者DRG中高表达[9],Lee等[17]发现在银屑病小鼠DRG中特异性敲除TRPC4基因及局部皮内注射特定的TRPC4抑制剂ML204抑制了银屑病小鼠的瘙痒和炎症;TRPV1基因的过度表达被证明与银屑病瘙痒程度相关[9]。Lee等[18]发现从omega-3脂肪酸中提取的内源性脂质介质resolvin D3可以通过抑制TRPV1显著减轻银屑病动物模型的瘙痒和皮肤炎症;Yan等[19]发现在银屑病患者表皮和DRG中TRPV4表达增加且与银屑病的严重程度密切相关,提出TRPV4参与了银屑病的发生发展。升麻素(cimifugin)被证明通过抑制TRPV4通道的活性而显著减轻银屑病患者瘙痒症状[19]。综上,TRPC4、TRPV1和TRPV4在瘙痒中有促进作用。
冷却是止痒的,TRPM8在体感系统中充当冷刺激的传感器。既往研究中关于银屑病瘙痒皮损中TRPM8基因表达水平未得出一致结论,有研究发现降低[20],有研究发现升高[21]。TRPM8在银屑病瘙痒中的作用需在更多的研究中明确。最初有报道称,在银屑病小鼠模型中,局部应用IMQ使皮肤TRPA1的表达升高,TRPA1维持了银屑病模型真皮炎症和Th17相关细胞因子的表达[22]。然而Kemeny等[23]证明药物阻断或TRPA1的基因缺失小鼠炎性细胞因子水平更高、银屑病皮炎和瘙痒行为更频繁,从而表明TRPA1在银屑病中具有保护作用。所以TRPA1在银屑病瘙痒中的作用仍不明确。
2 免疫系统(图2)
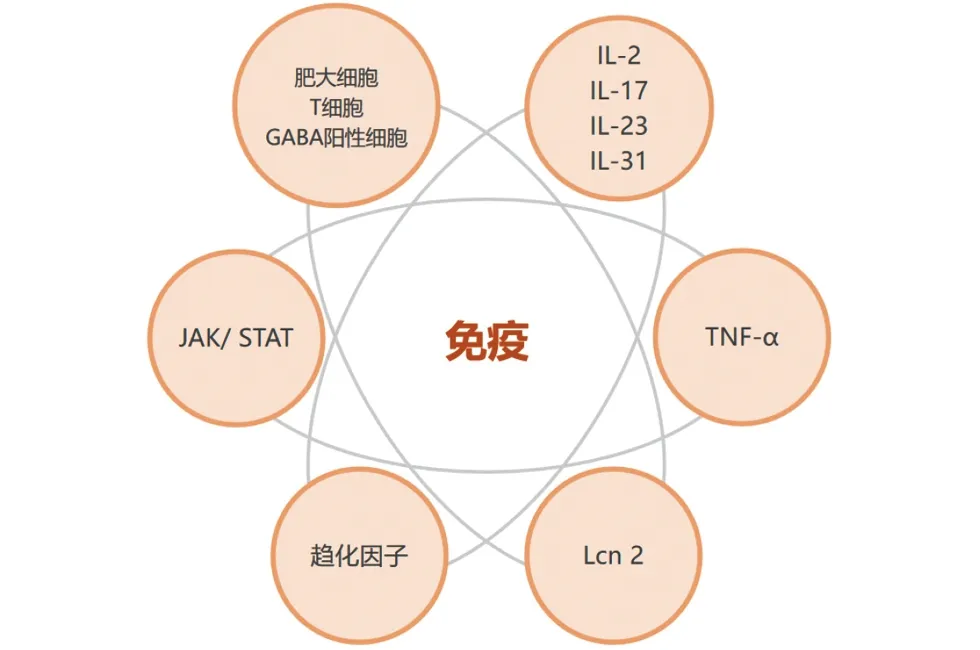
图2 银屑病瘙痒潜在免疫因素
2.1 肥大细胞(MC)及组胺 以往的研究表明肥大细胞(MC)和组胺在银屑病瘙痒发病机制中的参与有限[24]。最近有研究报道了伴随着MC数量的增加以及 NGF和神经肽的表达银屑病小鼠的自我抓挠行为增加[25]。另外,在头皮中,MC被认为是瘙痒的主要传导细胞之一[26],因为它能够通过与头皮毛囊的相互作用来触发神经源性炎症,激活外周下丘脑垂体肾上腺轴,从而调节、处理和整合瘙痒信号[26]。Mueller等[27]发现抗H1组胺药左西替利嗪可以迅速并显著降低瘙痒强度,是治疗银屑病相关瘙痒的一种有效且安全的选择。因此,MC及组胺在银屑病相关瘙痒中仍有重要作用。
为提高802.11n长距离无线链路的性能,必须解决两个问题:一是减少丢包,二是提高链路利用率.为此首先需要考察丢包的原因,提出针对性的解决方法.因此我们搭建了802.11n长距离无线mesh网络实验床,该实验床包含7条长距离链路,链路长度从3.5公里到20公里不等.本文在其中一条20公里的链路上开展了大量的实际测量工作,通过对实测数据的分析,发现了802.11n长距离无线链路中数据帧的CRC(Cyclic Redundancy Check)出错特征.据此可以设计帧内编码和帧间编码以提高数据帧的抗误码能力.
2.2 其他免疫细胞 Rishi等[28]在银屑病患者中观察到γ-氨基丁酸(GABA)阳性的巨噬细胞和表达GABA(A)受体的淋巴细胞的数量增加,并且炎症细胞的数量与瘙痒的严重程度相关。GABA可能调节各种免疫细胞的活性,并刺激它们分泌其他促瘙痒介质,如IL-2或IL-31[9]。另外,银屑病是一种T细胞介导的疾病,T细胞也可直接释放致痒介质(如组胺和IL-31)作用于瘙痒神经元,引发瘙痒[29]。靶向T细胞药物(如DAB389IL-2、alefacept、abatecept、CTLA4Ig)的使用被证明能促进皮损中T细胞的耗尽,使得患者的表皮增生减少,临床症状得到改善[30]。
2.3 细胞因子
2.3.1 IL-2 IL-2 被证明在瘙痒中具有调节作用[31]。银屑病瘙痒皮损中IL-2免疫反应细胞的数量高于非瘙痒皮损,表明IL-2至少在一定程度上与银屑病瘙痒有关[9]。
2.3.2 IL-17 IL-17介导的免疫在银屑病发病机制中起关键作用[32]。有研究发现,银屑病瘙痒皮肤与非瘙痒皮肤相比IL-17的表达增加,IL-17被认为能够调节DRG和脊髓神经元水平的瘙痒[33]。另外,在各种靶向不同因子的生物制剂中,针对IL-17A的单克隆抗体在治疗银屑病时似乎展现出最佳的止痒效果,司库奇尤单抗(Suckinumab)、依奇珠单抗(Ixekizumab)均是针对IL-17A的单抗,两者缓解银屑病瘙痒在临床试验中得到证实[34]。
2.3.3 IL-23 银屑病皮肤中树突状细胞(DC)激活会分泌IL-23,从而激活Th17产生IL-17来驱动促炎角质形成细胞反应[35]。Iwano等[36]提出口服雌激素受体α激动剂可以通过促进DC分泌IL-23显著加重IMQ诱导小鼠的银屑病样皮炎,与炎症和瘙痒反应直接相关。乌司奴单抗(Ustekinumab)是针对IL-12/23的抗体,能有效缓解银屑病患者的瘙痒症状[34]。而Pavlenko等[37]却发现将IL-23皮内注射到小鼠背部皮肤不会引起抓挠,所以IL-23在瘙痒中的作用需进一步研究。
2.3.4 IL-31 Nattkemper等[21]发现IL-31在瘙痒的银屑病皮肤中的基因转录水平升高。IL-31通过由IL-31受体α (IL-31Rα) 和抑瘤素M受体β (OSMRβ) 组成的异二聚体受体复合物发出信号,激活信号通路、刺激诱导趋化因子和促炎细胞因子的释放、促进神经纤维的延长,从而导致皮肤瘙痒[38]。一项针对伴有瘙痒的疾病患者(包括斑块型银屑病患者)的II期研究报道了抗OSMRβ的单抗KPL-716有改善瘙痒的疗效[39]。然而Purzycka-Bohdan等[38]的研究结果显示银屑病患者血清IL-31水平明显高于健康对照组,但与银屑病瘙痒程度无关,指出血清IL-31浓度可能不是银屑病瘙痒的可靠指标。所以IL-31在银屑病瘙痒中的作用有待进一步研究。
2.3.5 肿瘤坏死因子-α(TNF-α) Miao等[40]发现银屑病患者瘙痒的皮肤和血清中TNF-α水平升高,并与疾病的严重程度显著相关,TNF-α及其受体TNFR1信号传导是小鼠通过外周和中枢机制充分表达急性和慢性瘙痒所必需的。应用TNF-α抑制剂如依那西普(Etanercept)、英夫利昔单抗(Infliximab)、阿达木单抗(Adalimumab)等可改善银屑病皮损、缓解瘙痒症状[34]。
2.3.6 脂质运载蛋白-2(Lcn 2) Lcn2是一种主要由激活的中性粒细胞分泌的蛋白质,Aizawa等[41]的研究结果显示,银屑病患者血清Lcn2升高,且与瘙痒程度显著相关。Ren等[42]的研究表明Lcn2可加重银屑病病情, Lcn2受体可作为治疗银屑病的有效靶点,阻断Lcn2及其相关的信号通路可能缓解银屑病的症状。
2.3.7 其他 Nattkemper等[21]发现与健康人、特应性皮炎瘙痒的患者相比,一些趋化因子(如CCL4、CCL7、CCL8、CCL14、CCL20)以及细胞因子(如IL19、IL20、IL26、IL36A、IL36G)的基因表达水平仅在瘙痒性银屑病瘙痒皮肤中升高,这可能为未来银屑病瘙痒提供治疗靶点。
2.4 Janus激酶/信号转导及转录激活因子通路(JAK/STAT) 大多数与银屑病瘙痒相关的细胞因子都通过JAK-STAT途径传递信号,JAK抑制剂如枸橼酸托法替尼(Tofacitinib)、巴瑞替尼(Baricitinib)在改善银屑病皮损的同时可缓解瘙痒[34],JAK抑制剂的止痒作用可以通过以下途径来实现:减少参与感觉感知的JAK依赖的细胞因子(如IL-31、IL-4和IL-13)[43]、抑制TRPV1[43]、降低瘙痒相关的炎症细胞因子(如IL-22、IL-23和IL-31)的水平[44]和调节表皮神经支配[44]。
3 小结
综上,瘙痒是银屑病患者的主要症状之一 ,银屑病相关瘙痒的发病机制复杂,神经、免疫系统在其中发挥着重要作用。随着银屑病皮损的好转,瘙痒可得到改善,但单纯控制银屑病可能不能完全控制瘙痒,而需特异性、针对性的治疗,所以需要我们进一步研究阐明银屑病的确切瘙痒机制以找到更好的药物控制银屑病瘙痒。

