EGFR shRNA联合雷帕霉素对Colo-16细胞增殖、迁移及侵袭的影响
王 慧 杨 艳 李竹茜 展晓红 魏志平
1青岛市城阳区人民医院皮肤科,青岛,266109;2青岛大学附属医院病理科,青岛,266109;3徐州医科大学附属医院皮肤科,徐州,221002
皮肤鳞状细胞癌(cutaneous squamous cell carcinoma, CSCC)是一种以角质形成细胞过度增殖和分化水平的降低为特征的皮肤恶性肿瘤,其发病率仅次于基底细胞癌,恶性程度仅次于黑素瘤[1],目前,CSCC的治疗主要有Mohs显微外科、化疗、光动力疗法、放疗、生物疗法和免疫疗法[2,3]。大多数皮肤鳞癌可通过手术成功根除,但部分皮肤鳞癌具有较高的侵袭性、转移率和死亡率[3-6]。 EGFR/PI3K/AKT/mTOR是重要的信号通路之一,与肿瘤细胞的生长、侵袭、转移密切相关[7-9]。EGFR 及mTOR通路在分子水平存在交叉点,均与CSCC发展密切相关[10,11]。雷帕霉素(Rapamycin,RAPA)是从吸水性链霉菌提取出来的一种新型大环内酯类免疫抑制剂,是mTOR特异性抑制剂[12,13],本研究以人CSCC细胞Colo-16为研究对象,观察EGFR shRNA联合RAPA对Colo-16细胞增殖、迁移和侵袭的影响,探讨其可能机制,为CSCC的药物治疗提供新思路。
1 材料与方法
1.1 材料 Colo-16细胞株由中国医学科学院皮肤病研究所提供,胎牛血清来自杭州四季青生物材料有限公司,RPMI 1640培养液来自美国Gibco公司。阴性对照质粒shRNA-NC和EGFR shRNA质粒由上海吉玛制药有限公司构建,RAPA来自美国Sigma-Aldrich公司,细胞计数试剂盒(cell counting kit-8,CCK-8)购自上海碧云天生物科技有限公司;Transwell购自美国Costar公司, Lipofectamine2000试剂来自美国Invitrogen公司,细胞增殖核抗原Ki-67(Ki-67)、基质金属蛋白酶2(matrix metalloproteinase-2,MMP-2)、MMP-9、鼠抗人 β 肌动蛋白一 抗、羊抗鼠二抗、羊抗兔二抗及Western印迹法化学发光工作液均来自美国Santa Cruz公司。
1.2 细胞培养及稳定细胞系构建 复苏冻存的人皮肤鳞癌细胞系Colo-16细胞,接种于含10%胎牛血清和青链霉素的RPMI 1640培养基中,置37℃、5% CO2、饱和湿度的培养箱中恒温培养,按照Lipofectamine2000转染试剂盒说明书进行转染,24 h后以1∶10传代,细胞贴壁后加1200 μg/mL G418筛选,连续筛选6周,获得稳定转染EGFR shRNA质粒和shRNA-NC质粒的Colo-16细胞。取生长状态良好的细胞进行后续研究,分为EGFRshRNA组(EGFR shRNA质粒转染Colo-16细胞)和阴性对照组(shRNA-NC转染Colo-16细胞),用于后续研究。
1.3 CCK-8增殖实验 将常规培养的Colo-16细胞、转染shRNA-NC的Colo-16细胞、转染EGFR shRNA的Colo-16细胞以1×103个/孔接种于96孔板,培养12 h后加入磷酸盐缓冲液(phosphate buffered saline,PBS)或终浓度200 nmol/L的RAPA[14],实验分为5组,即正常细胞组(常规培养的Colo-16+PBS)、阴性对照组(转染shRNA-NC质粒的Colo-16细胞+PBS)、EGFR shRNA组(转染EGFR shRNA质粒的Colo-16细胞+PBS)、RAPA组(常规培养的Colo-16细胞+RAPA)、联合组(转染EGFR shRNA质粒的Colo-16细胞+RAPA)。将各组Colo-16细胞接种至96孔板中,每孔0.4×104个细胞,分别培养24、48、72、96 h。避光条件下每孔加入CCK-8溶液20 μL,置培养箱中继续培养4 h,酶标仪测定各孔波长450 nm处的吸光度(A)值,代表细胞增殖活性,实验重复3次,绘制细胞生长曲线。
1.4 克隆形成实验 各组Colo-16细胞采用胰酶消化,制备单细胞悬液,倍数稀释,接种6孔板,以每孔500个细胞分别培养,培养至形成肉眼可见的集落,终止生长,用PBS洗涤培养基,4%多聚甲醛固定15 min,1%结晶紫染液染色10 min,显微镜观察拍照,计算细胞大于10个的克隆数,计算克隆形成率。克隆形成率=克隆数/细胞数×100%,实验重复3次。
1.5 划痕实验检测细胞迁移能力 将各组Colo-16细胞密度调整为2×105/mL,接种于6孔板,待细胞完全生长融合后,用无菌枪头均匀划过,产生距离相等的划痕,此时划痕距离为0 h划痕宽度。用PBS洗涤细胞,去除未贴壁细胞,然后加入培养基以及药物对细胞处理24 h。此时细胞划痕距离为24 h划痕宽度。划痕愈合率(%)=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。实验重复3次。
1.6 Transwell小室实验检测细胞侵袭能力 正常细胞组、阴性对照组、RAPA组、EGFR shRNA组和联合组细胞培养至指数生长期,采用胰酶消化制备单细胞悬液,密度调整为2×105/mL,分别接种于含基质胶的Transwell上室,下室加入含10%胎牛血清的RPMI 1640培养基,在细胞培养箱继续培养24 h,擦去上层细胞,4%多聚甲醛固定,1%结晶紫染色液染色,于倒置相差显微镜下随机选择3个视野,计数下室染色细胞。实验重复3次。
1.7 免疫蛋白印迹法(Western blot) 收集各组细胞,预冷PBS洗涤2次,用RIPA裂解液提取细胞总蛋白,10%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳、转膜,5%脱脂奶粉封闭2 h。一抗体配比浓度:Ki-67(1∶500)、MMP-2(1∶800)、MMP-9(1∶800)和β-actin(1∶1 000),4℃孵育过夜,TBS洗涤3次,每次20 min,洗膜后分别放入用TBS 稀释的二抗(1∶3000)1 h,PBS洗涤3次后,发光液显影,使用Image J分析软件计算条带灰度值,目的蛋白相对表达水平=目的蛋白条带灰度值/β肌动蛋白蛋白条带灰度值,实验重复3次。
1.8 半定量RT-PCR检测 用Trizol法提取细胞总RNA,紫外分光光度计测定RNA的浓度及纯度,然后反转录为cDNA。利用Premier 5.0设计引物,MMP-2正向引物序列:5′-GAACACCAGAGGAAGCCGTCAC-3′,反向引物序列:5′-AGCTGTGGACTCTAGGAGAAGGAC-3′;MMP-9正向引物序列:5'-TGGTGCAGGCAGAGTAGGAGTG-3',反向引物序列:5'-CTACACGGAGCATGGCAACGG-3';Ki-67正向引物序列:5'--GGGAAAGTAGGTGTGAAAGAAGAG-3',反向引物序列:5'--ATCTGCTTTGGAGACTCCTTA-3';内参β肌动蛋白正向引物序列:5′-GAACGGTGAAGGTGACAG-3′,反向引物序列:5′-TAGAGAGAAGTGGGGTGG-3′。PCR扩增参数:94℃预变性5 min;94℃变性40 s,60℃退火30 s,72℃延伸45 s,扩增40个循环。用Image J图像分析软件分析PCR产物的灰度值,实验重复3次。
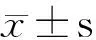
2 结果
2.1 EGFR shRNA联合雷帕霉素对Colo-16细胞增殖活性的影响 CCK-8实验及克隆形成实验显示,EGFR shRNA组、RAPA组及联合组Colo-16细胞吸光度A值及细胞克隆形成率均显著低于正常细胞组及阴性对照组,吸光度A值为(0.34±0.004,0.51±0.013,0.26±0.006比0.67±0.002,0.66±0.028),克隆形成率为[(70.27±3.74)%,(78.75±3.26)%,(52.87±4.89)%比(89.48±3.74)%,(88.46±4.59)%],差异有统计学意义(F=368.91、27.49,均P<0.05)。其中,联合组细胞增殖活性最低,显著低于EGFR shRNA组和RAPA组(CCK-8:q值分别为8.00、 24.40;克隆形成率:q值分别为6.03、 8.98,均P<0.05),而正常细胞组与阴性对照组细胞增殖活性差异无统计学意义(P>0.05)(图1,2)。
图1 EGFR shRNA联合RAPA对Colo-16细胞增殖活性的影响

2a:正常细胞组;2b:阴性对照组;2c:EGFR shRNA组;2d:RAPA组;2e:联合组图2 EGFR shRNA联合RAPA对Colo-16细胞克隆形成的影响
2.2 EGFR shRNA联合雷帕霉素对细胞迁移和侵袭能力的影响 与正常细胞组、阴性对照组比较,EGFRshRNA组、RAPA组和联合组划痕愈合率及侵袭细胞个数表达均显著降低(均P<0.05)。其中,联合组细胞划痕愈合率及侵袭细胞个数显著低于EGFRshRNA组、RAPA组(划痕愈合率:q值分别为11.73、21.66,均P<0.05);侵袭细胞数目:q值分别为8.40、9.79,均P<0.05),正常细胞组与阴性对照组相比上述各蛋白表达差异无统计学意义(P>0.05)(图3、4,表1)。
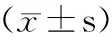
表1 EGFR shRNA、雷帕霉素单独及联合处理对Colo-16细胞划痕愈合率、侵袭细胞数的影响

3a、3f:正常细胞组;3b、3g:阴性对照组;3c、3h:EGFR shRNA组;3d、3i:RAPA组;3e、3j:联合组图3 EGFR shRNA联合RAPA对Colo-16细胞迁移能力的影响
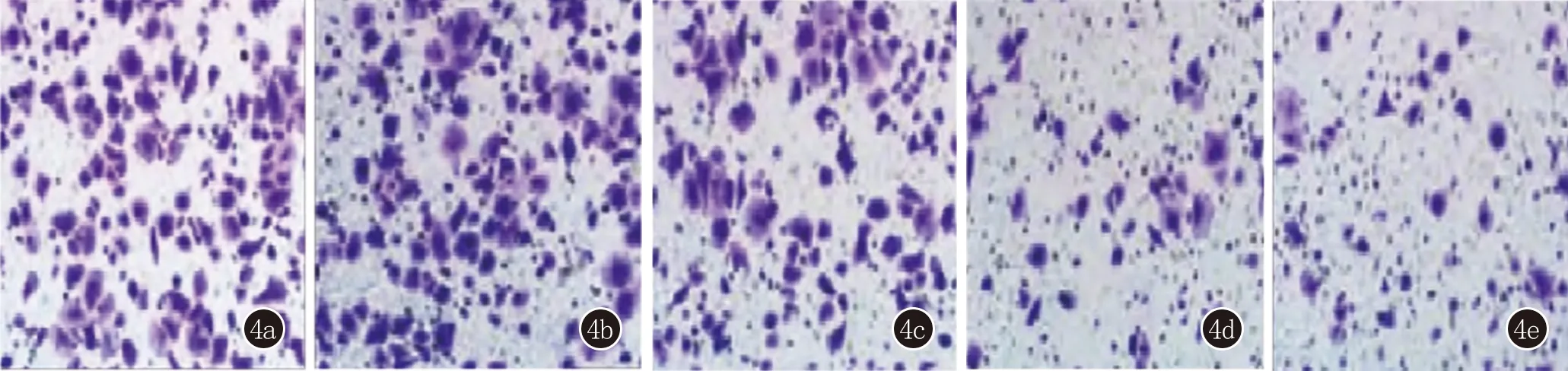
4a:正常细胞组;4b:阴性对照组;4c:EGFR shRNA组;4d:RAPA组;4e:联合组图4 EGFR shRNA联合RAPA对Colo-16细胞侵袭能力的影响
2.3 EGFR shRNA联合雷帕霉素对增殖、侵袭相关蛋白的影响 与正常细胞组、阴性对照组比较,雷帕霉素组、EGFR shRNA组和联合组增殖及侵袭相关蛋白Ki-67、MMP-2、MMP-9 mRNA及其蛋白表达均明显下降,且联合组上述蛋白表达的下降最显著,均P<0.05,正常细胞组与阴性对照组相比上述各蛋白表达差异无统计学意义(均P>0.05)(图5)。
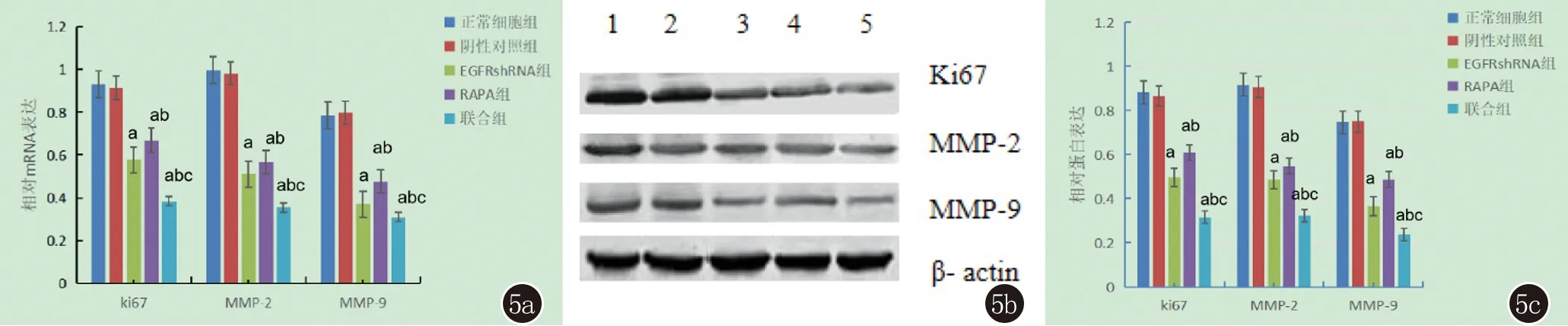
5a、5c:a:与正常细胞组相比;b:与EGFRshRNA组相比;c:与RAPA组相比,均P<0.05。5b:1:正常细胞组;2:阴性对照组;3:EGFR shRNA组;4:RAPA组;5:联合组;图5 EGFR shRNA联合RAPA对Colo-16细胞增殖及侵袭相关蛋白Ki-67、MMP-2、MMP-9 mRNA及蛋白表达的影响
3 讨论
CSCC是常见的皮肤非黑素细胞恶性肿瘤,呈侵袭性生长,病情进展快,具有较强的浸润侵袭能力,转移和复发一直是CSCC患者死亡的主要原因[15]。EGFR在皮肤鳞癌细胞分化、增殖、凋亡以及细胞应激反应中起着关键作用,其过表达与不良预后密切相关[16]。EGFR/PI3K/AKT/mTOR信号通路是多种肿瘤细胞信号转导的常见通路, 参与调控恶性肿瘤的发生、发展、侵袭和转移等过程,也是药物干预恶性肿瘤的潜在靶点[17-19]。由于肿瘤是多基因、多环节致病,单一基因疗法往往疗效欠佳, 多基因联合治疗抑癌作用较单基因治疗显著[20]。特异性靶向治疗联合化疗药物是当前肿瘤综合治疗的热点,由于抑制mTOR会引起负反馈机制,激活上游分子,进一步活化EGFR/PI3K/AKT/mTOR通路,对EGFR/PI3K/AKT/mTOR通路的双重抑制或许能够有效避免负反馈机制,更有效增强抗肿瘤作用,可能为晚期CSCC提供新的治疗思路。
失控性增殖是恶性肿瘤的基本特征。细胞增殖核抗原(Ki-67)是一种增殖细胞相关抗原,是反映细胞增殖活性的敏感指标,在多种恶性肿瘤中过表达,能够较好地反映肿瘤的生长增殖特性[21,22],前期研究发现EGFR shRNA联合RAPA增强EGFR/PI3K/AKT/mTOR通路下游凋亡相关蛋白cleaved caspase3、cleaved caspase9的表达均显著增加,抑制增殖相关蛋白cyclin D1、p-AKT、p-mTOR、p-P70S6K蛋白表达,针对这一通路的双重抑制有协同增效的作用[23]。本研究中,我们针对EGFR基因设计干扰质粒EGFR shRNA,针对mTOR基因应用其特异性抑制剂RAPA,探讨EGFRshRNA联合RAPA对皮肤鳞癌Colo-16细胞增殖、迁移和侵袭的影响,并对其可能机制进行初步探究。 CCK-8实验、克隆形成实验及Western blot 显示,EGFR shRNA组、RAPA组及联合组Colo-16细胞吸光度A值、细胞克隆形成率及Ki-67蛋白表达水平均显著低于正常细胞组及阴性对照组,其中,联合作用优于EGFR shRNA或雷帕霉素单独处理。
MMP-2和MMP-9是目前发现的与肿瘤转移关系最密切的基质金属蛋白酶家族成员,表达升高后可以诱导肿瘤转移,其表达水平与细胞迁移、侵袭呈正相关[24,25]。划痕实验及Transwell小室实验结果显示:与正常细胞组比较,EGFRshRNA组、RAPA组和联合组划痕愈合率、侵袭细胞数目及MMP-2、MMP-9蛋白表达均显著降低(均P<0.05),其中,联合组显著低于EGFRshRNA组、RAPA组 。
综上所述,本研究结果初步表明,靶向EGFRshRNA联合化疗药物雷帕霉素在抑制CSCC细胞Colo-16的增殖、迁移和侵袭方面具有协同增效作用,推测其机制可能与双重抑制EGFR/PI3K/AKT/mTOR通路有关。这一结果证明靶向基因治疗和化疗药物联合治疗方法的可行性,为CSCC的治疗提供新思路,但由于本研究联合用药的结果仅基于体外细胞实验,联合用药的疗效还有待动物和临床试验的进一步研究和验证。
——雷帕霉素

