miR-103及其靶基因Cav1.2在低氧预适应提升小鼠学习记忆中的表达*
翁清明,王 蒙, 谢 伟,3, 谢雅彬,3
(1.包头医学院内蒙古自治区低氧转化医学重点实验室,内蒙古包头 014040;2.包头医学院基础医学与法医学院;3.包头医学院医学技术与麻醉学院神经科学研究所)
低氧预适应(hypoxic preconditioning, HPC)为机体组织细胞的一种“获得性耐受”,是指生物体、器官、组织或细胞暴露于非损伤性、重复性轻度或中度缺氧条件下,使机体对后续更为严重的缺氧产生耐受性[1]。HPC是机体的一种内源性神经保护机制,其具体分子机制还不明确,但是其很可能通过表观遗传学发挥作用,而MicroRNA是表观遗传学重要组成部分。MicroRNA(miRNA)是一种小的、高度保守的内源性非编码单链RNA,通过与靶mRNA的3’-非翻译区结合,负调节mRNA表达,并在转录后基因表达调控中发挥作用[2]。miR-103可以通过靶向阿尔茨海默病(Alzheimer’s disease, AD)细胞模型中的前列腺素内过氧化物合酶2,促进神经突生长和抑制细胞凋亡,而且miR-103的表达与阿尔茨海默病患者的痴呆严重程度呈负相关,这些研究揭示了miR-103作为AD 疾病风险和疾病进展的生物标志物的潜能[3-4],并可能通过调节下游靶基因影响认知功能。此外,Cav1.2是L型电压门控钙通道主要的组成部分,在哺乳动物大脑中广泛表达,CACNA1C基因是Cav1.2的主要编码基因[5]。研究发现,在海马和新皮质中CACNA1C基因失活的小鼠表现出海马依赖的空间记忆严重受损[6]。而且Cav1.2还参与海马长时程增强(Long-term potentiation, LTP)的形成。即miR-103可能通过调节Cav1.2影响学习记忆。在本研究中,首先通过对HPC处理后表达产生变化并可能与学习记忆有关的miRNA进行筛选,确定miR-103下游靶基因Cav1.2。而鉴于Cav1.2又与学习记忆有关,因此进一步探究miR-103和Cav1.2在低氧预适应改善学习记忆能力中的表达变化,以阐明miR-103调控Cav1.2在低氧预适应内源性神经保护中的作用机制。
1 材料与方法
1.1实验动物 ICR雄性小鼠,6~8周、体重18~22 g,购自斯贝福(北京)生物技术有限公司[SCXK(京)2019-0010]。本研究经包头医学院批准,小鼠在动物房进行饲养以及后续的解剖,并按照中国实验动物相关规定及原则给予人道处理。
1.2仪器与试剂 超声波破碎仪(Thermo Fisher Scientific,FB50),离心机(Eppendorf,Centrifuge 5424 R),恒温摇床(国华企业集团有限公司,SHZ-82),酶标仪(Thermo Fisher Scientific,Multiskan FC),电泳仪(BIO-RAD,PowerPacTM Basic),化学发光成像仪(上海天能科技有限公司,Tanon-5800),超净工作台(Thermo Fisher Scientific,1300IIA2),实时荧光定量PCR仪(Applied Biosystems,ABI7500),BCA浓度定量试剂盒(Thermo Fisher Scientific,VJ312126),抗氧化剂(Invitrogen,2481173),组织裂解液(Beyotime,P0013C),PVDF膜(Roche,03010040001),TBST(VETEC,WXBD7901V),microRNA抽提试剂盒[生工生物工程(上海)股份有限公司,B518811],miRNA第一链cDNA合成(加尾法)试剂盒[生工生物工程(上海)股份有限公司,B532451],SYBR Green mix(康为世纪生物科技有限公司,CW0955)等。
1.3低氧预适应模型的建立 小鼠称重,选取质量范围在18~22 g的小鼠进行分组:对照组(Control)、低氧组(Hypoxia)、低氧预适应组(HPC)。构建低氧模型,首先将小鼠放入150 mL的透明玻璃的广口瓶中,塞紧橡胶塞,用计时器立刻计时并观察小鼠的呼吸及生理状态。当小鼠达到低氧非致死状态时,即小鼠出现大口喘气并且仰式卧位,同时身体出现痉挛以及大小便失禁的情况,迅速拔下橡胶塞,快速取出小鼠并实施抢救,记下其耐受时间,记实验小鼠为1次低氧小鼠。重复上述步骤,共4次,即为低氧预适应模型小鼠。只进行1次低氧的小鼠为低氧组。未进行低氧的小鼠为对照组。
1.4Morris水迷宫实验 使用Morris水迷宫测试小鼠的空间学习和记忆能力。对照组(Control)、低氧组(Hypoxia)、低氧预适应组(HPC)每组各10只小鼠。首先将小鼠分别放入水池中60 s,进行自由游泳以适应环境。第2 d将平台放入SW象限,将小鼠面朝池壁放入水中进行训练,每个象限各1次,每 d 1次,共6 d。当小鼠在1 min内找到平台并在平台上停留5 s即为训练成功,如1 min内找不到平台的小鼠,将由实验员用木棍引导小鼠到平台上停留10 s,时间记为1 min,即为小鼠的潜伏期。反复上述实验,共6 d。第7 d将水池中的跳台撤去,任选一个象限放入小鼠(所有小鼠入水点相同),记录穿梭平台区域次数以及目标象限停留时间百分比。
1.5实时荧光定量PCR 使用SanPrep柱式microRNA抽提试剂盒提取小鼠海马的总microRNA,并使用miRNA第一链cDNA合成(加尾法)试剂盒反转录为cDNA。RT-qPCR使用SYBR Green PCR Master Mix 和 Real-Time PCR系统进行。用2-ΔΔCt方法计算相对RNA水平,归一化为U6。
1.6Western Blot 电泳 剥离各组小鼠海马于冰上融化后,加入300 μL的RIPA裂解液和3 μL蛋白酶抑制剂后超声破碎,将样品放入4 ℃低温离心机中12 000 rpm离心15 min,将上清液转移到新的EP管中,使用BCA试剂盒确定蛋白浓度。电泳上样质量为20 μg,5 %的浓缩胶使用19 mA,6 %分离胶使用29 mA;使用快速转膜液400 mA转膜25 min。使用5 %的脱脂牛奶封闭90 min,TBST清洗3次,每次10 min。4 ℃过夜孵育一抗(1∶1 000);TBST清洗3次,每次15 min;使用山羊抗小鼠和山羊抗兔二抗(1∶3 000)35 r/min孵育90 min;TBST清洗3次,每次15 min。使用ECL超敏发光液检测蛋白条带。
1.7荧光素酶报告实验 将m-CACNA1C-3’UTR的野生型(Wild Type)和突变型(Mutant)结合位点分别亚克隆到pSI-Check2载体中,构建m-CACNA1C-Wt/Mut。然后,将m-CACNA1C-3’UTR-Wt或m-CACNA1C-3’UTR-Mut与NC模拟物或miR-103-3p模拟物共转染293T细胞,用双荧光素酶测定系统评估荧光素酶活性。

2 结果
2.1低氧耐受时间变化 小鼠随着低氧次数的增加,后一次低氧耐受时间比前一次的低氧耐受时间增加明显并且有统计学意义(P<0.05)。此结果符合低氧预适应可增加小鼠对低氧的耐受性,表明低氧预适应模型构建成功。见图1。

图1 低氧次数对小鼠耐受时间的影响注:与前一次比,****P<0.000 1,**P<0.01;n=18
2.2HPC对小鼠空间学习记忆的影响 通过水迷宫来检测HPC对小鼠空间学习记忆的影响。经过6 d的定位巡航实验,与Control组相比,HPC组小鼠的潜伏期时间趋势在1到6 d明显降低(P<0.05);Hypoxia组与Control组相比潜伏期时间没有明显变化(P>0.05)。经训练后的空间探索实验,小鼠穿梭目标象限平台(SW象限)次数及目标象限停留时间百分比(SW象限)判断小鼠的记忆能力。与Control组相比,HPC组小鼠在目标象限时间的百分比增加(P<0.05) ,小鼠平台穿越次数明显增加(P<0.05)。结果表明,HPC可以改善小鼠的空间学习记忆能力。见图2。
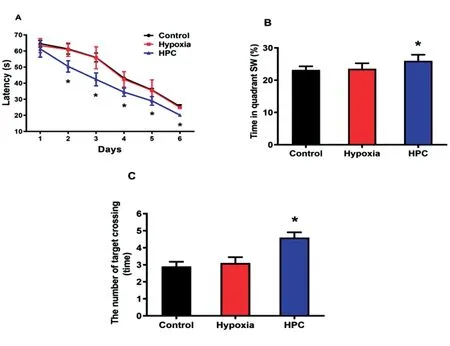
图2 HPC对小鼠空间学习记忆的影响注:A.潜伏期时间变化,B.各组目标象限百分比,C.各组穿越平台次数;与Control组比较,*P<0.05
2.3HPC条件下miRNA的变化 对HPC处理后的小鼠海马进行QPCR检测。与Control组相比,HPC组小鼠海马组织中miR-103、 miR-137和miR-153在HPC处理后1 d表达明显下调(P<0.05)。见图3。
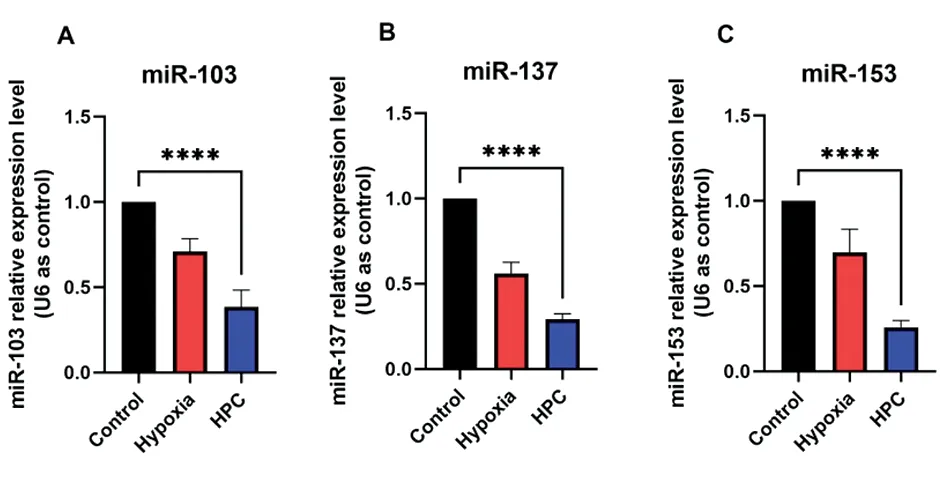
图3 miR-103、miR-137、miR-153表达变化(n=4)注:A.miR-103表达变化,B.miR-137表达变化,C.miR-153表达变化;****P<0.000 1
2.4miR-103-3p通过与3’UTR结合靶向Cav1.2 通过对miR-103-3p下游靶基因进行筛选,发现Cav1.2与学习记忆有关,而CACNA1C基因是Cav1.2的主要编码基因。因此,进一步通过荧光素酶报告实验验证了miR-103-3p对Cav1.2的靶向调控,测定了miR-103-3p与Cav1.2之间的结合序列。miR-103-3p模拟物明显降低了CACNA1C-WT载体的荧光素酶活性,但CACNA1C-Mut载体中未观察到显著变化。见图4。

图4 miR-103-3p通过与3’UTR结合来靶向Cav1.2注:A.miR-103-3p与Cav1.2 3’UTR之间的结合序列,B.双荧光素酶报告基因检测mmu-miR-103-3p与m-CACNA1C-3’UTR之间的结合关系;****P<0.000 1
2.5小鼠海马中Cav1.2表达变化 与Control组相比,HPC组小鼠海马组织中Cav1.2蛋白在第2 d表达升高(P<0.01),其与HPC组小鼠海马组织中miR-103在第1 d表达降低相互验证。见图5。
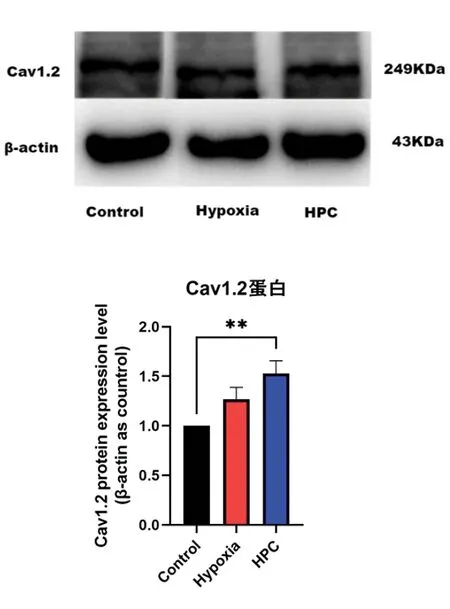
图5 不同处理组小鼠海马中Cav1.2的蛋白表达变化(n=4)
3 讨论
HPC是指通过预先暴露于亚致死性的条件下,增加对随后更加严重的缺氧的耐受能力,它是一种内源性保护机制,而提高学习记忆是这种保护机制重要表现形式之一。Zhang等人[7]研究发现间歇性低氧可增强幼龄小鼠的空间认知能力。此外,Shao等人[8]也发现低氧预处理可以提高小鼠空间认知能力。通过水迷宫检测各组小鼠的学习记忆能力,本研究发现HPC组的小鼠学习记忆能力有明显的提升,与Shao等人的研究结果一致,不过其机制有待进一步发掘。
HPC的保护作用非常明确,其很可能通过表观遗传学发挥作用。Liu等人[9]研究发现来自HPC处理的间充质干细胞释放的富含miR-216a-5p的外泌体可以通过抑制TLR4的活性,将小胶质细胞从M1表型转变为M2表型,从而调节TLR4/NF-κB/PI3K/AKT信号级联,从而促进小鼠脊髓损伤后的功能恢复。由此可知,HPC可以通过miRNA发挥保护作用。在HPC条件下表达变化的众多miRNA中筛选确定了miR-103、miR-137、miR-153。因为,Yan等人[10]发现在miR-137基因缺失的小鼠中,空间学习和记忆受损,这可能与Ezh2基因表达增加有关。miR-137还与铅诱导的海马体依赖性空间记忆障碍有关[11]。You等人[12]研究发现,miR-153的靶点是瘦素受体及其调控的JAK-STAT信号通路,过表达miR-153抑制LEPR和JAK-STAT信号通路,导致BDNF表达增加,海马神经元增殖能力增加,促进长期记忆的形成,减轻孤独症症状。此外,miR-103除了可能对AD患者的认知能力有影响外还与术后认知功能障碍有关,Wu等人[13]研究发现右美托咪定通过调节miR-103a-3p/VAMP1轴,减轻了小胶质细胞的激活和相关的炎症反应,在术后认知功能障碍中具有保护作用。 我们使用TargetScan在线预测工具对与Cav1.2的主要编码基因CACNA1C的3’UTR区域结合的miRNA进行预测,发现miR-103的5’端第2-7个碱基与CACNA1C基因3’UTR互补配对,且第一个碱基位置是腺嘌呤,为标准结合,有预测出的结合位点。miR-137和miR-153与CACNA1C基因的3’UTR为非标准结合,没有预测出来的结合位点。因此,本研究优先选择miR-103进行双荧光素酶报告基因检测,确定miR-103对Cav1.2之间是否存在直接调控关系。尽管miR-137和miR-153的表达也下调,也可能存在对Cav1.2的调控,但毕竟没有预测出明确的结合位点。因此,我们优先选择miR-103进行后续的实验。此外,Chen等人[14]发现生物钟基因BMAL1可诱导miR-103的表达,进而在转录后水平调控大鼠脑动脉Cav1.2通道的昼夜节律调节。Favereaux等人[15]也发现在疼痛反应过程中miR-103可以双向整合调控Cav1.2钙通道。同时,miR-103在模拟微重力条件下可以通过抑制Cav1.2的表达来抑制成骨细胞增殖[16]。
Cav1.2是小鼠海马中最主要的L型钙通道,由CACNA1C基因编码,是一种高压激活(HVA),持久(L型)和二氢吡啶(DHP)敏感钙通道,其主要分布于心血管系统、神经系统和内分泌腺并在其中发挥重要的生理病理功能。例如,CACNA1C基因的功能获得性突变导致运动行为、社交互动以及焦虑增加和保存行为的潜在改变[17]。当细胞内钙通过钙通道充分升高时,大量的信号通路被激活。例如,组成性存在的蛋白激酶的磷酸化导致突触可塑性的增加和LTP的形成,其最初通过磷酸化膜受体(如AMPA受体),随后在数小时内通过激活基因转录和蛋白合成。Moosmang等人[18]发现,海马中缺少Cav1.2的小鼠显示出NMDAR非依赖性LTP的选择性丢失,海马依赖性空间记忆严重受损。由此可知,Cav1.2在海马依赖的学习记忆中扮演重要角色。
综上所述,HPC可以提高小鼠的低氧耐受能力,并发挥神经保护作用。因为miRNA是表观遗传学基因转录后调控的重要组成部分,故猜测其可能是通过表观遗传学发挥作用。因此,本研究通过对HPC处理后小鼠海马表达变化的miRNA进行筛选确定了miR-103,并分析出下游靶基因可能是Cav1.2,又通过双荧光素酶报告基因检测验证了miR-103调控Cav1.2,而Cav1.2参与认知功能。总之,HPC可能下调miR-103表达,而下调的miR-103又能上调其下游靶基因Cav1.2,并最终提升小鼠低氧耐受并改善学习记忆能力。

