糖尿病肾病与其他类型肾病患者肾组织中Smad1蛋白表达的比较
陈纤纤,冯 烈,周 颖,董向楠
暨南大学附属第一医院 1.内分泌与代谢科;2.肾内科,广东 广州 510632
糖尿病所致的肾脏损害是糖尿病的微血管慢性并发症之一,也是导致终末期肾病的主要原因之一。近期研究观察到糖尿病动物模型及糖尿病肾病患者尿中有Smad1蛋白的排泄,且糖尿病患者尿Smad1的含量与目前诊断糖尿病肾脏疾病的指标,如:尿白蛋白/肌酐比值(urinary albumin/creatinine ratio, UACR)及肾小球滤过率(glomerular filtration rate, GFR),均有良好的相关性,因此提出尿Smad1蛋白有望成为有前景的早期诊断糖尿病肾病的生物学指标[1-4]。其他不同类型肾病患者是否有尿Smad1蛋白的排泄尚未有定论。此外,目前研究集中观察肾小球区域Smad1蛋白的表达情况[1-2,5-6],肾组织的其他区域Smad1蛋白的表达情况如何,尚未清楚。本研究针对以上的疑问进行探讨。
1 材料与方法
1.1 材料
兔抗人胶原蛋白4(type Ⅳ collagen protein,Col4)抗体、兔抗人α-平滑肌肌球蛋白(smooth muscle α-actin,α-SMA)抗体及兔抗人Smad-1抗体(Abcam公司);Smad1 定量分析试剂盒(HCB公司);鼠抗兔二抗、DAPI及免疫组化试剂盒(广州贝奥吉恩生物技术公司)。其他化学试剂购自广州化学试剂厂。
1.2 方法
1.2.1 病例的收集与分组:收集2013年9月至2015年9月于暨南大学附属第一医院肾穿刺活检的组织标本,同时记录肾组织标本来源患者的基本情况,并检测相关的生化指标,留取新鲜晨尿标本。肾穿刺活检组织石蜡包埋并行切片,一部分送病理科由病理专科医生进行病理学检查分型,另一部分待批量行免疫组化及免疫荧光检测。
病例根据病理科诊断的结果分为4组:1)糖尿病肾病组(DN组9例);2)局灶性肾小球硬化性肾病组(FSGS组5例);3)IgA肾病组(IgA组12例);4)微小病变型肾病组(MNP组10例)。实验已获暨南大学附属第一医院伦理委员会的批准(编号:KY-2022-249),患者对实验知情同意。排除了合并感染、应激等急性病患者,以及合并心、肝、脑等重要脏器有严重器质性病变患者。通过基线资料比较(表1)保证各组数据具有可比性。
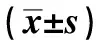
表1 4种类型肾病的相关数据的比较
同期收集47位健康人群体检的血液、尿液标本进行检测,并取得所有涉及项研究提供者的知情同意。
所有病例新鲜晨尿标本,一部分行尿肌酐检测,另一部分经离心后标记编号,放-20℃冰箱保存,待批量行尿Smad1的检测。
1.2.2 ELISA检测尿液中Smad1含量:所有病例冻存的尿标本批量采用酶联免疫吸附法(ELISA,双抗体夹心法)测定尿Smad1含量。
1.2.3 免疫组化检测肾活检组织中Smad1表达:将切片进行常规的二甲苯脱腊,梯度乙醇水化;内源性过氧化物酶被过氧化氢灭活后微波热修复抗原,冷却至室温;正常山羊血清室温下封闭30 min,每个患者的3张切片分别滴加一抗兔抗Smad1、Col4和α-SMA抗体,4 ℃孵育过夜;次日早晨以PBS冲洗3次,每次5 min,滴加相应的二抗,置于37 ℃的湿盒中,温箱孵育20 min,再以PBS冲洗3次,每次5 min,滴加过氧化物酶标记的链酶卵白素后置于37 ℃的湿盒中,温箱孵育20 min,再予以PBS冲洗 3次;二氨基联苯胺(DAB)染色作对比,苏木精复染,梯度乙醇脱水,二甲苯透明,中性树胶封片。玻片在倒置相差显微镜下观察并拍照,每张切片随机选取3个不重叠的肾小球视野,以及除肾小球外的区域随机选取 8个不重叠的视野,分别存档。所有切片图像于Image Pro Plus系统进行定量分析,测定非肾小球区域的8个不重叠的视野的Smad1蛋白阳性染色的累积吸光度值(integrated absorbance value,IA)。但在随机选取的3个肾小球视野中,选用平均吸光度值(average absorbance value,averageA)来反映肾小球范围内Smad1蛋白阳性染色的情况,避免了视野中非肾小球区域的阳性染色对结果的影响。吸光度值越大提示免疫反应越强,取其均值代表此例患者Smad1蛋白在肾小管及肾小球的相对含量。
1.2.4 免疫荧光染色下观察肾活检组织中Smad1、Col4、α-SMA蛋白的共同表达:每张玻片进行脱蜡,抗原修复后,以含5%的脱脂奶粉的PBST液对玻片进行封闭,室温下摇床1 h。重复2次用PBS洗涤玻片,每次5 min。根据稀释比例,一抗兔抗Smad1、Col4和α-SMA抗体稀释在1% 牛血清白蛋白(BSA)的PBS中,每张玻片上滴入200 μL含一抗抗体的1% BSA-PBS,使其完全覆盖玻片,37 ℃的湿盒中避光孵育20 min,重复PBS洗涤玻片3次,每次5 min。加荧光标记的二抗抗体,37 ℃的湿盒中避光孵育,后加用DAPI复染细胞核,然后置于激光共聚焦扫描电子显微镜观察肾活检组织中Smad1、Col4、α-SMA蛋白共同表达的情况,并拍照存档。
1.3 统计学分析

2 结果
2.1 肾病患者与健康人群相关指标的比较
无论是肾病患者总数组(total组)还是单独的4种类型肾病(包括DN组、FSGS组、IgA组、MNP组)其尿Smad1蛋白及SCR值(尿Smad1蛋白含量/尿肌酐)均高于健康人群组(P<0.05),见表1。
2.2 4种类型肾病患者肾活检组织中Smad1蛋白的表达情况及比较
图1分别显示4种类型肾病患者的肾活检组织中肾小球、肾小管(包括了近曲小管及远曲小管)均有棕黄色颗粒,棕黄色颗粒就是Smad1蛋白的表达区域。肾小管中棕黄色颗粒的分布更为明显,特别是肾皮质中近曲小管部分。糖尿病肾病组(DN组)的除肾小球区域外的累积吸光度均高于其他3组的水平(P<0.05),见图2。
A.Smad1 immunoreacitivity in the glomeruli of the four groups are shown; B.for the clearer presentation of the positive smad1 staining area, the immunoreacitivity of Smad1 expressing in the glomeruli was marked with red via the image processing software program; C.Smad1-positive expression was seen in the renal proximal convoluted tubules; D.Smad1-positive expression was seen in the renal distal convoluted tubules; immunohistochemical expression of Smad1 in the glomerular and tubulointerstitial area for the patients with diabetes nephropathy(DN,-1), focal segmental glomerulosclerosis(FSGS,-2), IgA nephropathy(IgA,-3)and minimal change nephrosis(MNP,-4).

IA.integrated absorbance; DN.the patients with diabetes nephropathy; FSGS.the patients with focal segmental glomerulosclerosis; IgA.the patients with IgA nephropathy; MNP.the patients with minimal change nephrosis group; *P<0.05 compared with DN group.
2.3 经免疫荧光显示的肾活检组织中Smad1、Col4、α-SMA蛋白共同表达的情况
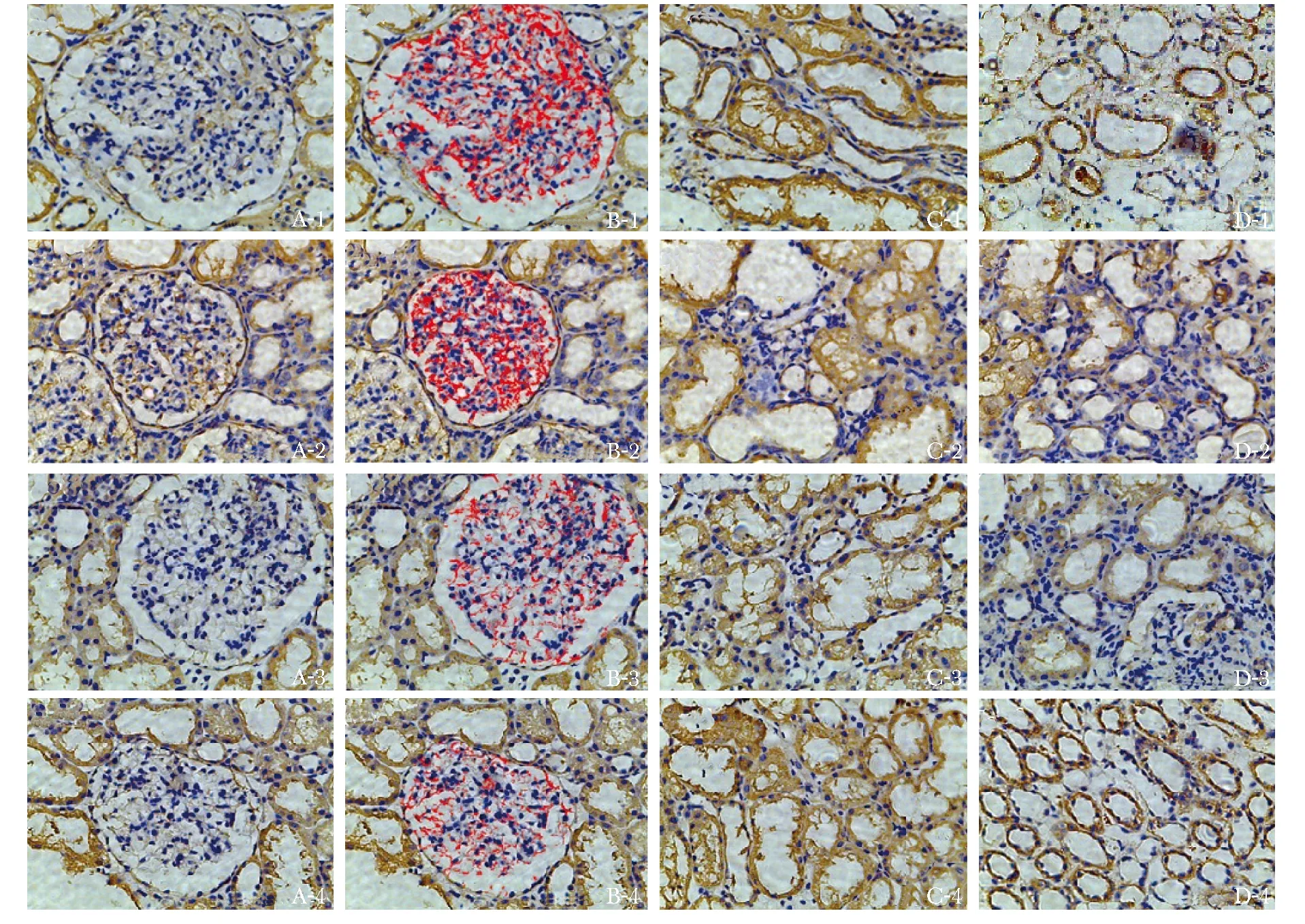
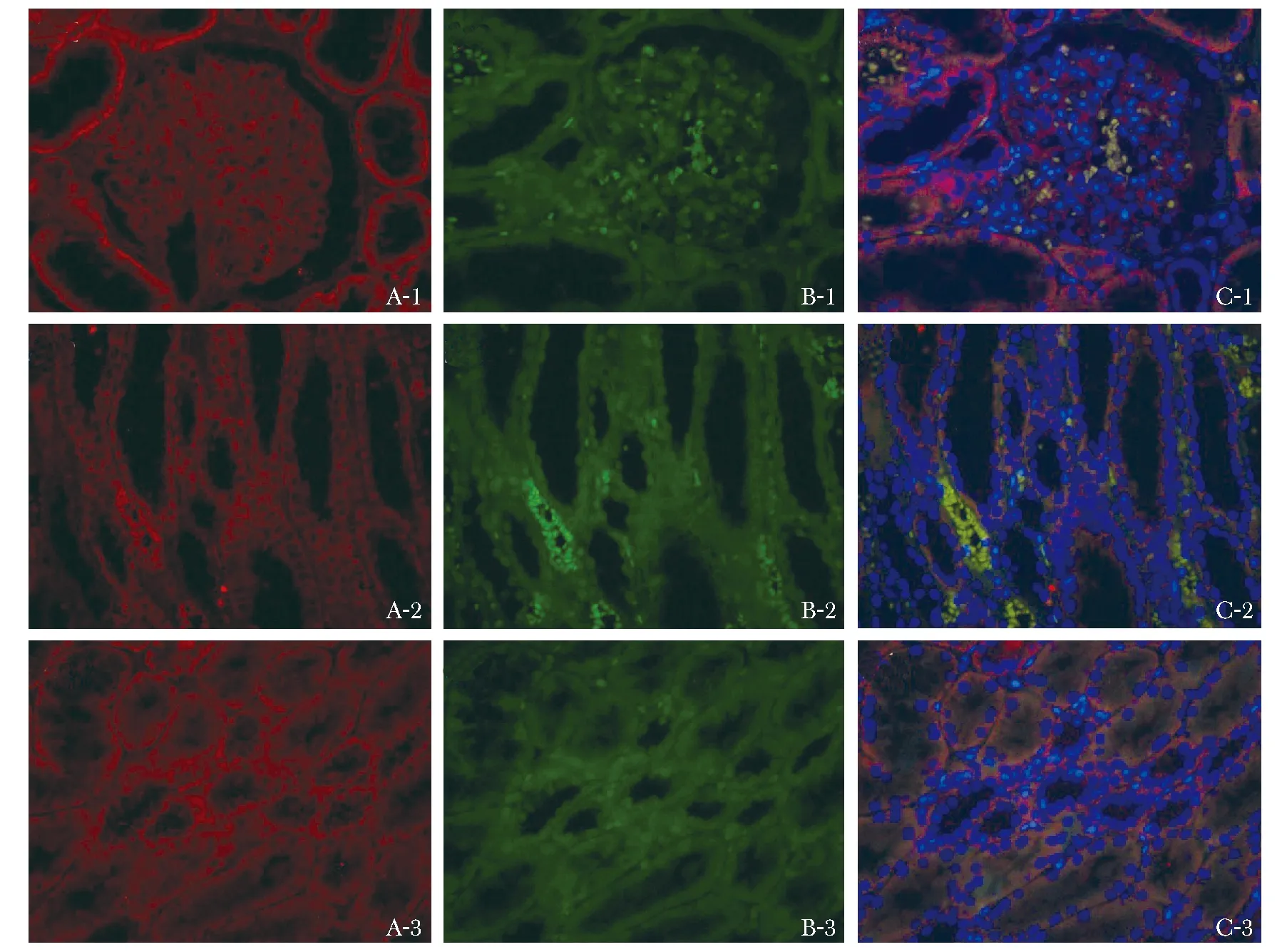
图3显示糖尿病患者肾组织中肾小球、近曲小管、远曲小管Smad1蛋白表达(红色荧光)的区域同时有Col4蛋白(绿色荧光)的表达,但肾小球区域Col4蛋白的表达较近曲小管、远曲小管部位Col4蛋白的表达强。图4显示了糖尿病患者肾组织中Smad1蛋白与α-SMA蛋白(绿色荧光)共同表达的情况,与Col4蛋白相比,α-SMA蛋白的表达更明显,与Smad1蛋白表达的区域重叠程度高。与肾小球区域α-SMA蛋白表达相比,肾小管部位(近曲小管及远曲小管)α-SMA蛋白的表达更强。其他3组患者的肾组织荧光染色切片中,同样可以观察到Smad1蛋白与Col4蛋白、Smad1蛋白与α-SMA蛋白类似的共同表达情况(具体结果因篇幅原因在文中并未展示)。
The expressions of Smad1 and Col4 were respectively noted by immunofluorescence staining not only in the diabetic glomeruli(A1, B1 and C1), but also in the diabetic renal proximal convoluted tubules(A2, B2 and C2)and distal tubules(A3, B3 and C3); the positive expression of Smad1 was marked in red, and Col4 was marked in green; nuclei of the cells were stained by DAPI(blue); the figures of A showed the expression of Smad1 alone, the figures of B showed the expression of Col4 alone, and the figures of C showed the co-expression of Smad1 and Col4.
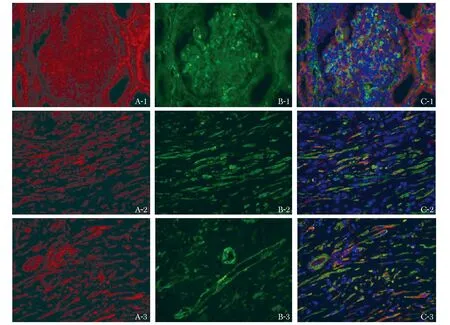
The expression of Smad1 and α-SMA were respectively noted by Immunofluorescence staining not only in the diabetic glomeruli(A1, B1 and C1), but also in the diabetic renal proximal convoluted tubules(A2, B2 and C2)and distal tubules(A3, B3 and C3); the positive expression of Smad1 was marked in red, and α-SMA was marked in green; nuclei of the cells were stained blue by DAPI; the figures of A showed the expression of Smad1 alone, the figures of B showed the expression of Col4 alone, and the figures of C showed the co-expression of Smad1 and Col4.
3 讨论
本研究发现4种类型肾病患者的尿Smad1蛋白含量均较健康人群高(表1)。TGF-β1 通路的上调是目前公认糖尿病肾脏损害的中心环节之一[7-8],而在其他肾小球硬化性肾病、IgA肾病、膜性肾病等肾脏疾病同样存在TGF-β1 通路的激活[9-11],Smad1蛋白正是TGF-β1通路下游蛋白的一员。由此推测,尿Smad1蛋白不是糖尿病肾病特异性的生物学标志物,而作为非特异性的标志物,可能广泛存在于有TGF-β1通路激活的肾脏疾病中。
既往的观点无论是诊断、分期还是治疗的靶点都集中在糖尿病所致的肾小球损伤方面,而对占据整个肾脏绝大部分体积的肾小管间质病变的重视不够[12]。本研究发现4组肾病患者肾活检组织中肾小管,特别是肾皮质近曲小管部分Smad1蛋白表达更为明显(图1),是较早关注到肾小管中Smad1蛋白表达的研究。此外,Smad1蛋白是细胞内的蛋白,如何出现于尿中也无定论。既往已排除尿Smad1 来自血清的可能性,因为血液中未检测出Smad1蛋白[4]。有研究推测,尿Smad1可能来源于足突细胞[13]或者内皮细胞[14]。本研究发现肾小管中有Smad1蛋白高表达,进而推测Smad1蛋白是否与其他的肾小管损伤的标志物(KIM-1、L-FABP、NGAL)类似,在肾小管损伤后,高滤过的状态下分泌进尿液中。这可能是更合理的解释,但亟待进一步的研究证实。
糖尿病肾病组患者的肾小管内Smad1蛋白的表达明显升高(图2),考虑有以下几点的影响因素:1)是否为糖尿病肾病本身的致病过程所致。2)是否因为DN组患者年龄大,收缩压和血肌酐高于其他3组患者,累积肾小管的病变更严重。3)是否因为病例收集量不足。
本研究因客观因素存在以下问题:进行肾活检穿刺的患者有限,研究结果可能存在一定的偏倚。因为医学伦理的原因无法设立肾组织穿刺的正常对照组,有待后续研究扩大病例数,并在在动物实验中得到更全面的结论。
综上所述,尿Smad1蛋白并非糖尿病肾病的特异性指标。本研究较早关注到在不同类型肾病患者肾小管区域有Smad1蛋白的高表达,对Smad1蛋白在肾脏损害的作用提出了新的研究方向。

