2种全自动免疫检测系统鳞状细胞癌抗原结果的一致性评价
颜 晰,张金艳,郭秀娟
(河北医科大学第四医院检验科,河北 石家庄 050011)
鳞状细胞癌抗原(squamous cell carcinoma antigen, SCCA)最初显示于宫颈鳞状细胞癌,是TA-4的一个亚片段,有SCCA1和SCCA22个亚型,是丝氨酸蛋白酶抑制剂超家族成员,二者具有高度同源性,与鳞状细胞癌的发生和发展有关,并在正常鳞状上皮细胞中表达[1]。研究显示,血清SCCA浓度在宫颈癌、肺癌、喉癌、口腔癌、食管鳞癌等多种鳞状细胞癌中均有升高,且已被证实与肺癌和宫颈癌的预后密切相关[2-5]。目前,用于血清SCCA检测的全自动免疫分析仪已广泛使用,在参加2022年国家卫健委临检中心EQA的1620家实验室中,使用最多的为罗氏cobas e602及雅培Architect i2000 SR全自动分析仪,二者检测的靶抗原均包含血清SCCA1和SCCA22个亚型,即总SCCA,但不同检测系统间不具有可比性,为进一步了解2个系统检测结果的差异,更好地进行临床解释,避免不同检测结果误导临床疾病诊断,因此需要对其进行一致性评价。本研究通过对罗氏cobas e602与雅培i2000 SR检测系统进行方法学比对,分析这2种方法检测血清SCCA浓度的一致性,以期为其临床应用提供参考依据。
1 材料与方法
1.1材料 收集河北医科大学第四医院检验科2019年6—9月4 231例无溶血、脂血、黄疸的临床血清样本在两检测系统进行平行检测,采用随机抽样的方法抽取138例SCCA结果数据,浓度水平覆盖线性范围,用于进行2种检测系统的相关性分析、偏差分析和一致性评价。4 231例数据用于二者临床样本SCCA检测结果的Kappa分析。
本研究经医院伦理委员会批准。
1.2仪器与试剂 美国雅培i2000 SR全自动化学发光分析仪、德国罗氏cobas e602全自动电化学发光分析仪;雅培公司原装SCCA试剂盒(批号:94111LP54)、校准品(批号:83115LP26)、质控品(批号:89117LP-L/M/H);罗氏诊断公司原装SCCA试剂试剂盒(批号:32267301)、校准品(批号:333155)、质控品(批号:299845/299846)。
1.3SCCA检测方法 每个检测系统均按照实验室要求进行校准及保养,实验检测严格按照标准操作规程执行,检测仪器状态稳定,室内质控在控,所有检测于24 h内完成。SCCA参考区间:雅培:0~1.5 mg/L,罗氏:0~2.7 mg/L,检验结果高于临界值判断为阳性。以参加卫计委临检中心室间质评的雅培i2000 SR全自动化学发光分析仪作为参考系统,罗氏cobas e602全自动电化学发光分析仪作为验证系统。
1.4精密度评价 参考美国临床和实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)EP15-A2文件,雅培检测L、M、H3个水平质控,罗氏检测L、H2个水平质控品,每天检测1个分析批,每个样本每日重复检测4次,连续检测5 d,计算各质控水平重复性及中间精密度。分别以国家卫健委临检中心室间质评允许总误差(±25.0%)的1/4 和1/3 即±6.25%和±8.33%为可接受标准。
1.5方法学性能评价 剔除因皮肤或唾液污染、肾功能衰竭等因素导致验证系统与参比系统结果差异的数据以及检测结果超出试剂线性范围的数据。以雅培检测系统测得结果为X,罗氏检测系统测得结果为Y,对138例SCCA检测结果作散点图,观察数据分布并拟合回归方程Y=a+bX,计算相关系数rs、截距a、斜率b及其95%可信区间,评估二者相关性。以两系统测定值差值与相应均值的相对百分比值为Y,两系统测定值均值为X作散点图,观察并分析散点的相对偏倚分布情况,以国家卫健委临检中心室间质评允许总误差(±25.0%)的1/2即±12.25%为可接受标准。以SCCA参考区间为判断标准:雅培检测系统≤1.5 mg/L为阴性,>1.5 mg/L为阳性;罗氏检测系统≤2.7 mg/L为阴性,>2.7 mg/L为阳性,对4 231例SCCA结果进行分析,并通过线性回归方程对罗氏系统进行校正,计算校正前后两系统的总符合率、阳性符合率、阴性符合率,评价二者检测结果的一致性。
1.6统计学方法 应用SPSS 25.0及Medcalc 20.0软件分析数据。计量资料比较采用两独立样本Mann-WhitneyU检验;采用Spearman相关分析进行相关性分析,0.36<相关系数rs<0.67表示中等程度相关,rs>0.68表示强相关;以Passing Bablok 回归进行回归分析;Bland-Altman图、山形图、组内相关系数(intra-class correlation coefficient, ICC) 以及Kappa分析进行一致性检验,Kappa<0.4,一致性较差,0.4 2.12种检测系统性能参数比对 雅培i2000 SR和罗氏cobas e602检测系统性能参数比对(表1)。 表1 2种检测系统基本性能参数Table 1 Basic performance parameters of two assay systems 2.2精密度分析 雅培i2000 SR检测系统L、M、H3个水平重复性分别为3.54%、2.98%、2.35%,中间精密度为3.56%、3.01%、3.10%;罗氏cobas e602检测系统L、H2个水平重复性分别为1.42%和0.99%,中间精密度为1.70%和1.19%,均小于厂商声明的不精密度,同时也<1/3室间质评允许总误差,可满足临床应用,罗氏不精密度较雅培检测系统更低,见表2。 表2 2种检测系统精密度分析Table 2 Precision analysis of two assay systems 2.3两检测系统相关性分析和回归分析 138例血清样本在雅培i2000 SR和罗氏cobas e602检测系统测定SCCA的结果经正态性检验均呈非正态分布,M(P25,P75)分别为7.50(1.60,14.25)mg/L和7.61(2.07,14.97)mg/L,差异无统计学意义(Z=-0.582,P=0.560);Spearman相关性检验结果显示,两检测系统检测结果相关性强,相关系数rs=0.939(95%CI:0.916~0.956),P<0.001;Passing Bablok回归分析显示2种方法检测SCCA浓度的回归方程为:Y=0.156+1.034X,截距为0.156(95%CI:0.037~0.330),斜率为1.034(0.994~1.095),该回归方程截距不包含0,斜率包含1,表明两检测系统间存在系统差异,不存在比例误差,见图1;线性累积和检验P=0.40(P>0.05),说明使用Passing Bablok回归比较2种检测系统是合适的。 图1 2种检测方法的Passing Bablok图 2.4两检测系统检测SCCA的一致性评价 2.4.1Bland Altman偏差分析 结果显示,两检测系统SCCA结果相对偏差的平均值为-9.30%(95%CI:-14.81~-3.77),在可接受标准范围内,但95%一致性界限范围较宽(-73.6%~55.0%),有>5%(5.8%)的数据点落在95%一致性界限外,见图2,表3。 表3 两检测系统SCCA结果的一致性评价Table 3 Consistency evaluation of SCCA results of two assay systems 图2 2种检测方法的Bland-Alt-man图Figure 2 Bland-Altman plot of two assay methods图3 2种检测方法的山形图 2.4.2山形图和组内相关分析 山形图折叠处靠近0(-0.28 mg/L),有大于5%(5.07%)的数据点落在可接受的变异范围外,组内相关系数ICC=0.912(95%CI:0.880~0.937),ICC>0.75,说明2种检测系统SCCA结果一致性较好,但存在一定偏差。见图3和表3。 2.4.3Kappa分析 4 231例平行检测患者SCCA结果的总符合率为92.86%,阳性符合率、阴性符合率分别为54.91%和99.52%,Kappa值为0.660,一致性中等;通过二者回归方程将罗氏SCCA结果校正后,总符合率、阳性符合率、和Kappa值均有提高,分别为93.83%、90.98%和0.778,特别是阳性符合率提高明显,见表4。 表4 2种检测系统SCCA结果的Kappa分析Table 4 Kappa analysis of SCCA results of two assay systems SCCA是与鳞状细胞癌发生、发展密切相关的血清标记物,已被广泛用于肺癌、宫颈癌等恶性肿瘤的辅助诊断、动态监测和预后评估[6-8]。Takeuchi等[9]证实SCCA与小儿特异性皮炎临床严重程度相关。随着临床检测需求的增加,越来越多的自动化SCCA检测系统应用于实验室[10-11],但不同检测系统间会由于检测方法、校准和试剂特异性的不同,导致检测结果不具有可比性[12-15]。雅培公司是最早研发SCCA检测的厂商,采用化学发光微粒子免疫检测法,罗氏cobas e602采用电化学发光法检测,罗氏校准品溯源至雅培参考实验室,二者均检测血清SCCA1和SCCA2总量,是各大医院应用最广的全自动免疫分析仪,但目前国内外对这2种方法的一致性评价较少,Chauvel等[16]比较了罗氏cobas e411和Brahms Kryptor的SCCA检测结果,认为二者SCCA检测结果在临界值范围内是一致的。 本研究结果显示,雅培i2000 SR和罗氏cobas e602检测系统的精密度在0.99%~3.56%之间,均低于厂商声明不精密度,同时也低于1/3EQA最大允许总误差,可满足临床应用,罗氏不精密度较雅培检测系统更低,这与Chen等[17]研究结果一致。两检测系统Spearman相关系数rs=0.939,相关性较强,Passing Bablok回归方程为:Y=0.156+1.034X,但回归方程斜率包含1,存在系统差异,二者SCCA结果相对偏差平均值为-9.30%,95%一致性界限范围较宽,有>5%(5.8%)的数据点落在95%一致性界限外,山形图山顶处靠近0(-0.28 mg/L),组内相关系数ICC=0.912,说明2种检测系统总体一致性较好,但检测结果存在一定偏差,这可能是由于其检测原理、抗体效价、亲和力及特异性等不同[18-19]。此外有研究显示,二者在检测SCCA1和SCCA22种异构体的能力上也存在差异[20],因此,实验室在更换SCCA检测系统时,应对检测结果一致化给予足够重视,进行方法学比对和诊断一致性评价。 此外,为避免方法学变更给患者带来不便,本研究首次对变更期间就诊患者进行了大批量平行检测(共4 231例完整数据),通过对SCCA结果进行分析,并以线性回归方程对罗氏系统进行校正后再分析,显示经校正后,罗氏与雅培SCCA结果的总符合率、阳性符合率、和Kappa值均有提高,分别为93.83%、90.98%和0.778,特别是阳性符合率提高明显,这表明二者的检测偏差可通过回归方程得到一定程度的纠正,从而减少临床误判,这也为解决不同检测系统间可比性提供了一种新思路。 综上所述,同一项目在不同检测系统检测结果的可比性一直是检验领域的难点,为了保证检测结果的可比性,往往需要用同一检测系统的检验报告进行临床解读,本研究通过对雅培i2000 SR和罗氏cobas e602检测系统进行方法学比对,以及对临床样本进行大规模验证,显示罗氏和雅培系统在SCCA检测方面具有良好的相关性和总体一致性,但存在系统性偏差,不能直接将其检测结果进行比较,可通过回归方程将结果进行转换后再进行临床判断。2 结 果


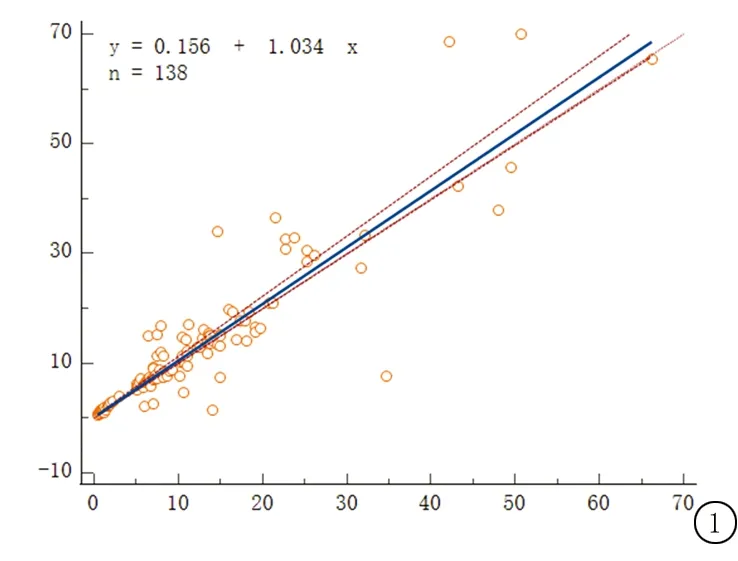


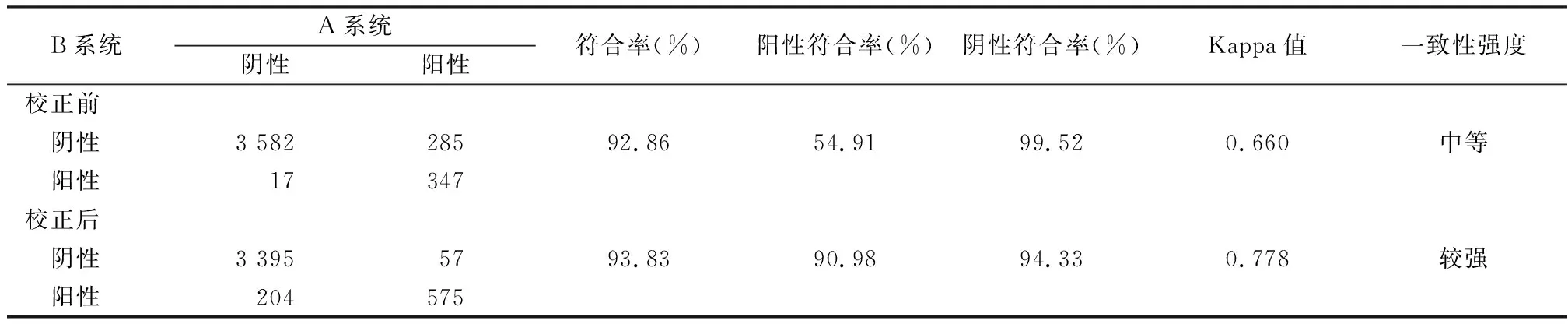
3 讨 论

