CEUS与CE-MRI对不同大小肝癌患者射频消融术后疗效评估
吕亚会,谢 丹,樊微微,张 浩(通信作者)
(1黑龙江省医院<哈尔滨工业大学附属黑龙江省医院>医学影像部 黑龙江 哈尔滨 150006)
(2黑龙江省医院<哈尔滨工业大学附属黑龙江省医院>超声介入科 黑龙江 哈尔滨 150006)
(3黑龙江省医院<哈尔滨工业大学附属黑龙江省医院>感染内科 黑龙江 哈尔滨 150006)
肝癌是我国常见的恶性肿瘤之一,据相关统计资料显示,2020年全球新发肝癌905 677例,约占总体癌症发病的4.69%,新增死亡830 180万,约占总体癌症死亡的8.30%[1]。目前,射频消融术(radio frequency ablation,RFA)是临床治疗肝癌的主要手段,但由于肝癌肿瘤血管丰富,且存在异位血供,故彻底灭活癌细胞难度大[2-3]。因此,早期对RFA治疗疗效进行精准评估,对制定后续治疗策略,改善患者预后尤为重要。随着影像学技术的不断发展,超声造影(CEUS)与增强磁共振(CE-MRI)在肝癌患者RFA疗效评估中显示出良好的应用价值,其中CEUS可实时监测肿瘤内部及周边血流灌注情况,大大提高肝癌的检出率[4]。而CE-MRI可通过注射造影剂,提高对微小血管及低速血流检出的敏感性,且具有检查范围广、解剖分辨率高等优势[5]。鉴于此,本研究对比分析CEUS与CE-MRI对不同大小肝癌患者RFA术后病灶的检出情况,现报道如下。
1 资料与方法
1.1 一般资料
选取2020年3月—2022年3月在黑龙江省医院接受RFA治疗的肝癌患者80例(102个病灶),其中男性51例,女性29例;年龄39~75岁,平均(58.25±4.17)岁;肝功能Child-Pugh分级:A级22 例,B级58例。102 个病灶中,病灶直径0.7~6.5 cm,平均(2.42±0.60) cm,其中病灶>2 cm共57个,≤2 cm共45个。
纳入标准:①均符合《原发性肝癌诊疗规范(2019年版)》[6]诊断标准,且经病理学检查确诊;②均具有RFA治疗适应证,且完成治疗者;③均于术后6个月接受CEUS、CE-MRI检查,影像学资料完整者;④患者均知情同意。排除标准:①肿瘤弥漫或远处大面积转移者,预计生存周期<6个月;②合并其他原发性恶性肿瘤者;③Child-Pugh分级为C级者;④造影剂过敏者;⑤合并严重精神系统疾病,依从性差者。
1.2 方法
1.2.1 CEUS检查 采用中国迈瑞公司生产的迈瑞Resona 7S彩色超声诊断仪,凸阵探头,频率为(2.0~5.0)MHz,先行常规超声检查,记录病灶大小、形态及回声情况等,切换为造影模式,采用声诺维(生产厂家:Bracco Imaging BV公司,国药准字:J20080052)+5 mL生理盐水经肘静脉团注,之后采用生理盐水冲管,同时打开超声仪内的自带计时器,实时观察感兴趣区的血流灌注变化,并进行记录和储存。
1.2.2 CE-MRI检查 采用中国上海联影公司生产的uMR 790探索3.0T磁共振扫描系统及体部12通道线圈进行扫描。均行常规平扫及3D-quick多期动态对比增强检查。要求患者均匀呼吸及呼气末屏气,检查时采取仰卧位,足先进,扫描范围包括全肝。造影剂采用钆喷酸葡胺注射液(生产厂家:广州康臣药业有限公司,国药准字:H10950270),双通道型高压注射器,造影剂用量0.2 mL/kg,注射速率为2.0~2.5 mL/s,经肘前静脉注入体内,随后以相同速率注入20 mL生理盐水。
1.2.3 影像学图像分析 由2名影像科副主任医师独立阅片,对检查结果进行分析,若诊断结果存在争议,则共同商讨后达成统一。①CEUS评价病灶活性标准:动脉期增强呈高回声,门脉期及延迟期强化降低,定义为肿瘤存活;若CEUS三期均无造影剂填充,则定义为肿瘤灭活。②CE-MRI评价病灶活性标准:动脉期病灶存在强化效应,门脉期、延迟期出现病灶强化效应降低,则定义为肿瘤存活;CE-MRI三期均未见强化效应,则定义为肿瘤灭活。
1.3 统计学方法
采用SPSS 26.0统计软件分析数据,符合正态分布的计量资料以均数±标准差()表示,采用t检验;计数资料以频数(n)、百分率(%)表示,采用χ2检验;一致性采用Kappa检验,Kappa值≥0.75表示一致性良好,0.4~<0.75表示一致性尚可,<0.4则表示一致性较差;以P<0.05为差异有统计学意义。
2 结果
2.1 CEUS、CE-MRI对不同大小肝癌患者RFA术后病灶活性检测的一致性
以穿刺活检或手术病理结果为金标准,共发现69个活性病灶,其中病灶直径>2 cm共39个,直径≤2 cm共30个;33个完全灭活病灶,其中病灶直径>2 cm共18个,直径≤2 cm共15个;在病灶直径>2 cm的诊断中,CEUS、CE-MRI与金标准的一致性均良好,Kappa值分别为0.922、0.946(P<0.05);在病灶直径≤2 cm的诊断中,CEUS与金标准的一致性尚可,Kappa值为0.731,CE-MRI与金标准的一致性良好,Kappa值为0.904(P<0.05);见表1。

表1 CEUS、CE-MRI对不同大小肝癌患者RFA术后病灶活性检测的一致性 单位:个
2.2 CEUS与CE-MRI对不同大小肝癌患者RFA术后病灶活性评估价值分析
CEUS、CE-MRI预测病灶直径>2 cm肝癌患者RFA术后病灶活性的特异度、准确率高于CEUS诊断(P>0.05);CE-MRI预测病灶直径≤2 cm肝癌患者RFA术后病灶活性的灵敏度、特异度、准确率均高于CEUS,但差异均无统计学意义(P>0.05),见表2。

表2 CEUS与CE-MRI对不同大小肝癌患者RFA术后病灶活性评估价值分析[%(n/m)]
2.3 典型病例分析
62岁男性肝癌患者,RFA术后6个月复查,CEUS、CE-MRI见图1。
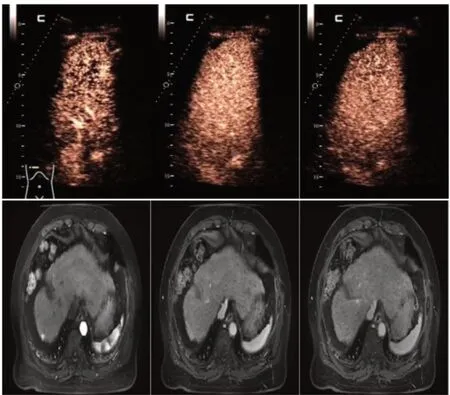
图1 肝癌患者RFA术后复发CEUS、CE-MRI影像学特征
3 讨论
肝癌是一种好发于肝脏上皮或间叶组织的恶性肿瘤,由于其初期症状极为隐匿,被确诊时多数患者已处于疾病中晚期,从而错过最佳手术治疗机会,预后极差。RFA是临床治疗肝癌的非血管性介入治疗手段,可通过微电极发射高频率电流产生热作用,使周围癌细胞凝固性坏死,达到提高肿瘤局部控制率的治疗目的。而RFA治疗的一个难点在于术后原病灶难以确定,判断消融范围困难大,这主要与患者肝癌血供丰富、微小残留病灶漏诊等多种因素相关[7]。
CEUS是一种适用于全身各部位脏器超声诊断的检查方法,具有操作简便、可重复性强、无创性等优势,其操作原理是以常规灰阶超声为基础,通过利用低声压和反向脉冲波来接收造影剂信号,从而多方位、多角度对肿瘤病灶内部结构、血流动力学变化进行清晰显示,相比增强CT等其血流信号信噪比、组织分辨率更高。黄汝哨等[8]研究认为与增强CT相比,对于≤2 cm的转移性肝癌,CEUS的检出率要优于增强CT(100.00% vs 86.96%)。张心荣等[9]研究表明,以DSA结果作为金标准,CEUS诊断原发性肝癌经导管肝动脉化疗栓塞术(TACE)后肿瘤残留的灵敏度、特异度分别为95.18%、95.31%,均高于增强CT的84.34%、88.28%。以上研究为CEUS广泛的临床使用奠定了基础。但也有研究表明,CEUS在RFA术后疗效评估存在气体干扰、微小病灶检出率低等局限性[10]。
CE-MRI是在MRI平扫基础上,根据细胞外对比剂浓度在靶器官各区域动态变化,来明确病灶的大小、性质及局部血流灌注功能状态的成像方法,具有更好的解剖分辨率和软组织分辨率,且不受碘油沉积影响,减少了对部分微小病灶、低速血流的漏诊,提高了对肿瘤病灶的检出准确性[11]。本研究以穿刺活检或手术病理结果为金标准,定量比较了CEUS与CE-MRI对不同大小肝癌患者RFA术后的疗效,结果显示,在病灶直径>2 cm的诊断中,CEUS、CE-MRI与金标准的Kappa值均大于0.9;在病灶直径≤2 cm的诊断中,CE-MRI与金标准的Kappa值高于CEUS检查。进一步分析发现,CEUS、CE-MRI预测病灶直径>2 cm肝癌患者RFA术后病灶活性的特异度、准确率高于CEUS诊断(P>0.05);CE-MRI预测病灶直径≤2 cm肝癌患者RFA术后病灶活性的灵敏度、特异度、准确率均高于CEUS,但差异均无统计学意义(P>0.05),与李丛辉等[12]研究结果一致。说明CEUS与CE-MRI对不同大小肝癌患者RFA术后疗效的评估均具有一定的应用价值,但在直径≤2 cm的病灶中,建议首选CE-MRI来评估病灶活性,CEUS作为补充影像学手段,以提高肿瘤完全消融率。
综上所述,CEUS与CE-MRI对不同大小肝癌患者RFA术后疗效的评估均具有一定的应用价值,但在直径≤2 cm的病灶中,CE-MRI的诊断一致性较CEUS更高,可作为RFA术后疗效评估的可靠影像学手段,CEUS可作为补充影像学手段。

