微RNA-23a 通过缝隙连接蛋白43 对颈椎后纵韧带细胞骨向分化的作用机制
宋希猛,张卫红,袁士龙
济宁市兖州区人民医院脊柱外科,济宁 272100
颈椎后纵韧带骨化症(OPLL)是一种发生于颈椎后纵韧带的异位骨化疾病,多见于亚洲人群[1]。目前手术是治疗OPLL的首选方式,但其风险高、难度大,面临着较高的并发症(如脊髓损伤)风险[2-3]。因此,研究OPLL 发生机制及新型治疗方式备受关注。微RNA(miRNA)是成骨细胞发育至关重要的细胞间信号传导介体,本研究组前期采用高通量基因芯片技术检测OPLL 患者和非OPLL 患者miRNA 的表达差异,对其中下调最明显的50 个miRNA 逐个采用miRanda 软件预测分析,其中miR-23a 在OPLL 中下调较为明显,且有研究[4]表明,抑制其表达可通过促进软骨形成和血管生成来促进骨愈合,提示其具有调控成骨分化的作用。缝隙连接蛋白43(Cx43)是Connexins蛋白家族成员,是哺乳动物机体中分布最广、数量最丰富的连接蛋白,在细胞物质交换、电信号传达过程中具有重要作用[5],体外实验证明,其高表达于OPLL 患者后纵韧带组织,且通过介导多条信号通路影响成骨分化基因表达[6-7]。此外,有学者[8]认为,Cx43可能存在与miR-23a的结合位点,其作为miR-23a 的靶基因发挥作用。大多数细胞中均存在丝裂原活化蛋白激酶(MAPK),其被激活后可促进相关成骨细胞特异性蛋白表达,从而巩固骨分化信号[9-10]。本研究通过构建过表达及低表达miR-23a 的颈椎后纵韧带细胞,分析其对Cx43 的调控作用及颈椎后纵韧带细胞骨向分化的影响,并探讨相关机制。
1 材料与方法
1.1 实验材料
标本来源于本院收治的50 例间断型颈椎OPLL患者(OPLL 组)、50 例颈椎外伤非OPLL 患者(对照A 组)和50 例颈椎病非OPLL 患者(对照B 组)。所有患者经颈椎X 线、CT 及MRI 检查确诊,体质量指数(BMI)为18.5 ~ 24.9 kg/m2,心、肝、肾等主要器官功能正常,无糖尿病、高血压或高脂血症等慢性基础性疾病。OPLL组中男30例、女20例,年龄为32 ~65(47.78±5.25)岁;对照A 组男28 例、女22 例,年龄为36 ~ 67(48.12±6.03)岁;对照B组男32例、女28例,年龄为35 ~ 66(48.52±6.14)岁。均采取颈椎前路减压(经椎间隙或椎体次全切除)植骨融合内固定术治疗,将术中切除的后纵韧带组织留作标本(OPLL组留取间断非完全骨化的后纵韧带组织)。本研究经医院伦理委员会审批备案,受试者均对研究内容知情且签署同意书。
1.2 试剂和仪器
含绿色荧光蛋白的过表达质粒(miR-23a agomir)、低表达质粒(miR-23a antagomir)、阴性对照质粒(agomir NC)购自武汉淼灵生物科技有限公司;实时荧光定量聚合酶链反应(qRT-PCR)检测试剂盒、荧光素酶活性试剂盒、BCA 蛋白定量试剂盒购自美国Sigma 公司;lipofectamineTM2000 脂质体转染试剂盒购自美国英杰生命技术有限公司;Cx43 一抗、p38 丝裂原活化蛋白激酶(p38 MAPK)一抗、磷酸化p38 MAPK(p-p38 MAPK)一抗、细胞外信号调节激酶(ERK1/2)一抗、磷酸化ERK1/2(p-ERK1/2)一抗购自美国Abcam 公司。Synergy-HD显微镜(Toshiba,日本);Synergy H4 全功能酶标仪(Bio Tek 公司,美国)。
1.3 实验方法
1.3.1 细胞培养[11]
酶消化法分离颈椎后纵韧带细胞。分别取OPLL 组、对照A 组、对照B 组约1 cm×1 cm 后纵韧带组织,无菌条件下冲洗干净深层组织血液及软组织碎屑,去除脂肪,将剩余组织剪碎,转移至5 mL灭菌离心管中,加入胰酶1.5 mL及胶原酶3 mL,充分混匀,37℃消化2 h,至管中无明显块状组织,低速离心(离心速度3 000 r/min,离心半径10 cm)去除沉淀,高速离心(离心速度12 000 r/min,离心半径8 cm)弃上清,DMEM 培养液将沉淀重悬,标准条件下培养,细胞融合度约80%时传代培养。倒置光学显微镜观察细胞形态。
1.3.2 培养细胞的miR-23a、Cx43表达[12-13]
取对数期的培养细胞,PBS 溶液冲洗,Trizol 法提取总RNA,鉴定浓度、纯度后反转录获取cDNA,定量后按照试剂盒说明书要求设定反应条件:93℃预变性6 min,95℃变性30 s,62℃退火30 s,72℃延伸25 s,重复40 个循环。miR-23a 上游引物:5’-G ACGTGCTCGGTGCACGCGTCCAC-3’;miR-23a下游引物:5’-TGCACGACGCTGCCACGCGCATGT-3’。Cx43上游引物:5’-GTGCACGCCACGTGCACGCACGCT-3’;Cx43 下游引物:5’-GTGACGTGCGTGCACGCTGCA AGC-3’。GAPDH上游引物:5’-GTGCACGCATGCAG TGCACCACAC-3’;GAPDH 下游引物:5’-CGCTTA CGCACGTGCTTAATGCAC-3’。以2-△△CT为目的基因相对表达强度,重复3 次取均值。
采用Western blotting 检测Cx43 蛋白表达。预冷PBS 洗涤后细胞裂解液冰上裂解,提取、定量蛋白。取40 μg待测样本,与等体积上样缓冲液混合,恒压下凝胶电泳30 min,湿膜法转膜,封闭液封闭室温摇床孵育2 h,加入Cx43 一抗(1∶1 000)4℃孵育过夜,TBTS 漂洗3 次,15 min/次,加入辣根过氧化物酶标记的二抗(1∶8 000)室温孵育1 h,TBTS 漂洗3 次,15 min/次。暗室中曝光显影,去除膜上发光液,Gene Gnome 凝胶成像系统拍照,Image J软件分析,蛋白表达量以Cx43 蛋白灰度值/内参GAPDH灰度值表示。
1.3.3 细胞转染[14]
取OPLL 组培养对数期细胞,经胰蛋白酶消化,接种于24 孔板,待细胞再次贴壁至80%时,更换无双抗的完全培养基。根据lipofectamineTM2000 脂质体法转染说明书分别转染miR-23a agomir质粒(miR-23a 过表达组)、miR-23a antagomir 质粒(miR-23a 低表达组)、agomir NC 质粒(转染对照组),未经处理的后纵韧带细胞为空白组,每组设置5 个复孔。37℃培养6 h,更换为完全培养基继续培养48 h。倒置荧光显微镜观察转染效率(%)=表达绿色荧光蛋白的细胞/总细胞数量×100%。
1.3.4 双荧光素酶实验[15]
采用生物信息学软件TargetScan、miRwalk 初步预测,构建Cx43 野生质粒(Cx43-WT);再使用基因位点图片技术构建Cx43 突变质粒(Cx43-MT)。取OPLL 组培养对数期细胞,接种于96 孔板,融合度至75%时开始转染,按照lipofectamineTM3000 说明书,将Cx43-WT、MT 质粒与内参海肾荧光素酶质粒pRLTK 进行共转染,分为Cx43-WT+miR 内参组、Cx43-WT+hsa-miR-23a 组、Cx43-MT+miR 内参组、Cx43-MT+hsa-miR-23a 组,孵育48 h,经荧光素酶活性试剂盒检测荧光素酶活性,相对荧光素酶活性=萤火虫荧光素酶活性/海肾荧光素酶活性。
1.3.5 碱性磷酸酶(ALP)染色[16]
取miR-23a 过表达组、miR-23a 低表达组、转染对照组和空白组细胞,每组设置5 个复孔,加入矿化诱导液诱导,显微镜下观察到黄褐色的矿化结节后继续培养21 d。PBS 冲洗,每孔加入50 μL 的Triton X-100,4℃孵育过夜。每孔加入100 μL ALP底物,37℃孵育1 h,每孔加入50 μL NaOH(0.2 mol/L)终止反应,采用酶标仪测定各组410 nm处光密度值。
1.3.6 Western blotting 检测
取miR-23a 过表达组、miR-23a 低表达组、转染对照组和空白组细胞,每组设置5个复孔,裂解、定量蛋白、电泳等步骤同1.3.2中Cx43蛋白表达检测。加入p38 MAPK 一抗(1∶500)、p-p38 MAPK 一抗(1∶500)、ERK1/2一抗(1∶1 000)、p-ERK1/2一抗(1∶1 000),辣根过氧化物酶标记的二抗(1∶8 000),分析蛋白表达量。
1.4 统计学处理
采用SPSS 20.0 软件对数据进行统计分析,符合正态分布的计量资料以±s表示,组间比较采用t检验,用LSD-t检验行两两比较;以P< 0.05 为差异有统计学意义。
2 结 果
2.1 细胞形态
培养14 d 后,有细胞从后纵韧带组织块周围爬出,瘦小、细长,多为菱形(图1a);培养至21 d,细胞爬出量逐渐增加,排列较为整齐,多为多角形与梭形;折光状态好(图1b);培养25 d,随着细胞增加,逐渐铺满瓶底,细胞胞体增大,放射状生长(图1c)。OPLL 组、对照A 组、对照B 组细胞形态无明显区别。
图1 颈椎后纵韧带细胞(×100)Fig. 1 Cervical posterior longitudinal ligament cells(×100)
2.2 miR-23a、Cx43 mRNA 及Cx43 蛋白表达情况
与对照A、B 组比较,OPLL 组miR-23a 表达降低,Cx43 mRNA 及蛋白表达升高,差异均有统计学意义(P< 0.05,表1,图2);对照A、B组间miR-23a、Cx43 mRNA及Cx43蛋白表达差异无统计学意义(P>0.05,表1,图2)。
表1 miR-23a、Cx43 mRNA 及Cx43蛋白表达Tab. 1 Expressions of miR-23a,Cx43 mRNA and Cx43 protein n=50,±s
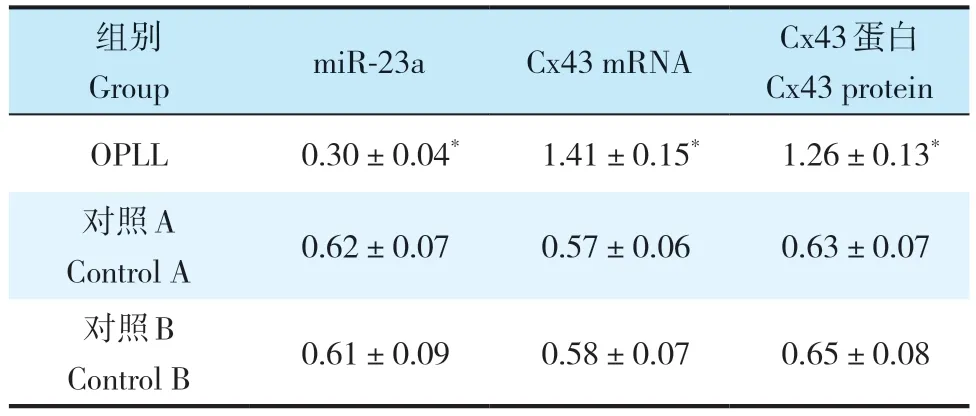
表1 miR-23a、Cx43 mRNA 及Cx43蛋白表达Tab. 1 Expressions of miR-23a,Cx43 mRNA and Cx43 protein n=50,±s
注:*与对照A、B 组比较,P < 0.05。Note:* P < 0.05,compared with control A,B group.
组别GroupmiR-23aCx43 mRNACx43 蛋白Cx43 protein OPLL0.30±0.04*1.41±0.15*1.26±0.13*对照A Control A 0.62±0.070.57±0.060.63±0.07对照B Control B 0.61±0.090.58±0.070.65±0.08
表 2 各组p-p38 MAPK/p38 MAPK、p-ERK1/2/ERK1/2表达Tab. 2 Expressions of p-p38 MAPK/p38 MAPK and p-ERK1/2/ERK1/2 in each group n=50,±s
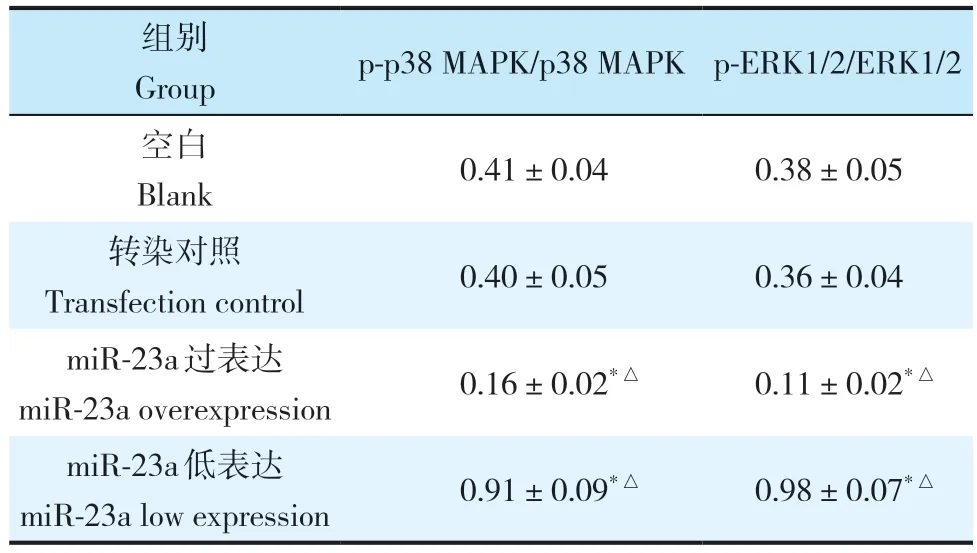
表 2 各组p-p38 MAPK/p38 MAPK、p-ERK1/2/ERK1/2表达Tab. 2 Expressions of p-p38 MAPK/p38 MAPK and p-ERK1/2/ERK1/2 in each group n=50,±s
注:*与空白组比较,P < 0.05;△与转染对照组比较,P < 0.05。Note:* P < 0.05,compared with blank group;△P < 0.05,compared with transfection control group.
组别Groupp-p38 MAPK/p38 MAPK p-ERK1/2/ERK1/2空白Blank 0.41±0.040.38±0.05转染对照Transfection control 0.40±0.050.36±0.04 miR-23a 过表达miR-23a overexpression 0.16±0.02*△0.11±0.02*△miR-23a 低表达miR-23a low expression 0.91±0.09*△0.98±0.07*△
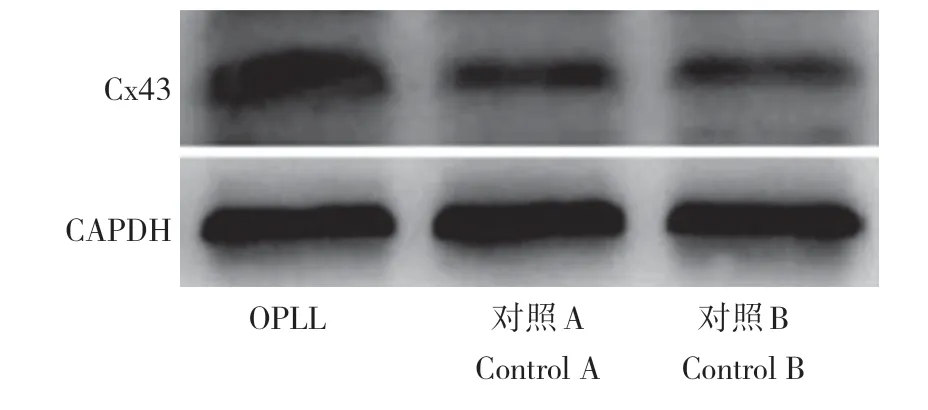
图2 Cx43蛋白表达Fig. 2 Expression of Cx43 protein
2.3 转染效率
荧光显微镜下可明显观察到绿色荧光细胞,转染效率为86%(图3)。
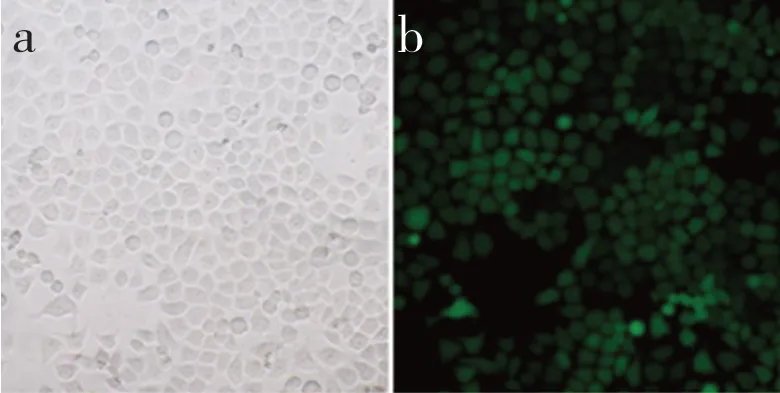
图3 miR-23a转染(×100)Fig. 3 miR-23a transfection(×100)
2.4 双荧光素酶实验
Cx43-WT+miR 内参组、Cx43-WT+hsa-miR-23a组、Cx43-MT+miR 内参组、Cx43-MT+hsa-miR-23a 组相对荧光素酶活性分别为1.06±0.09、0.91±0.08、1.01±0.10、1.03±0.11,Cx43-WT+hsa-miR-23a 组相对荧光素酶活性低于Cx43-WT+miR内参组,差异有统计学意义(P< 0.05,图4),提示miR-23a 可有效抑制野生型质粒荧光素酶活性。Cx43-MT+miR 内参组与Cx43-MT+hsa-miR-23a 组相对荧光素酶活性差异无统计学意义(P> 0.05,图4),提示miRNA 无法抑制突变型质粒荧光素酶活性。
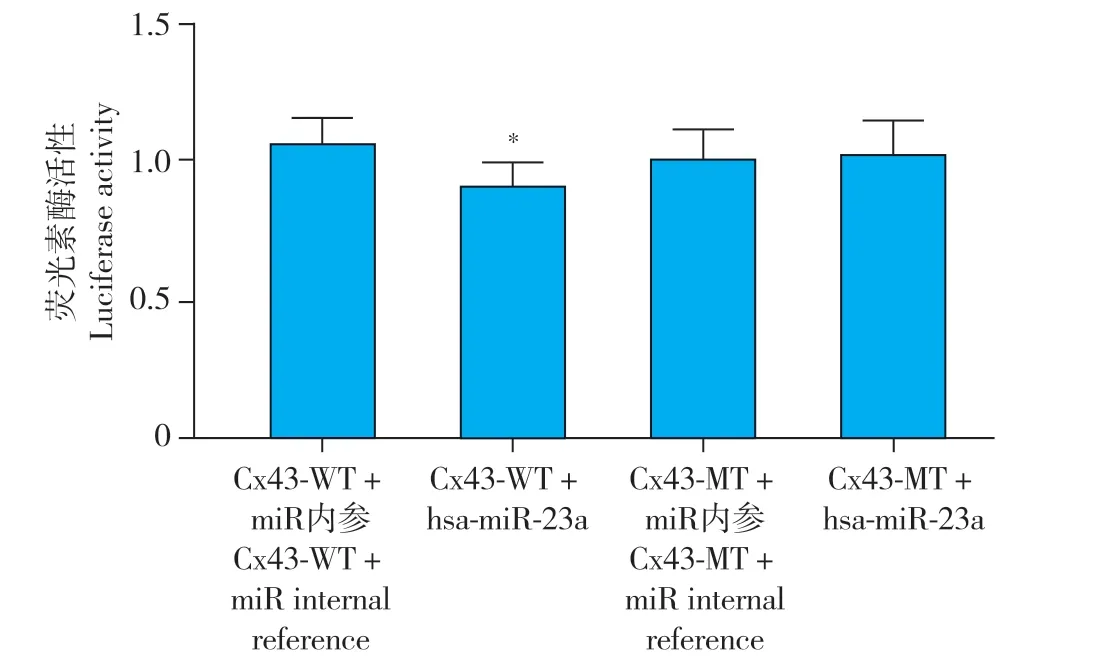
图4 荧光素酶活性Fig. 4 Luciferase activity
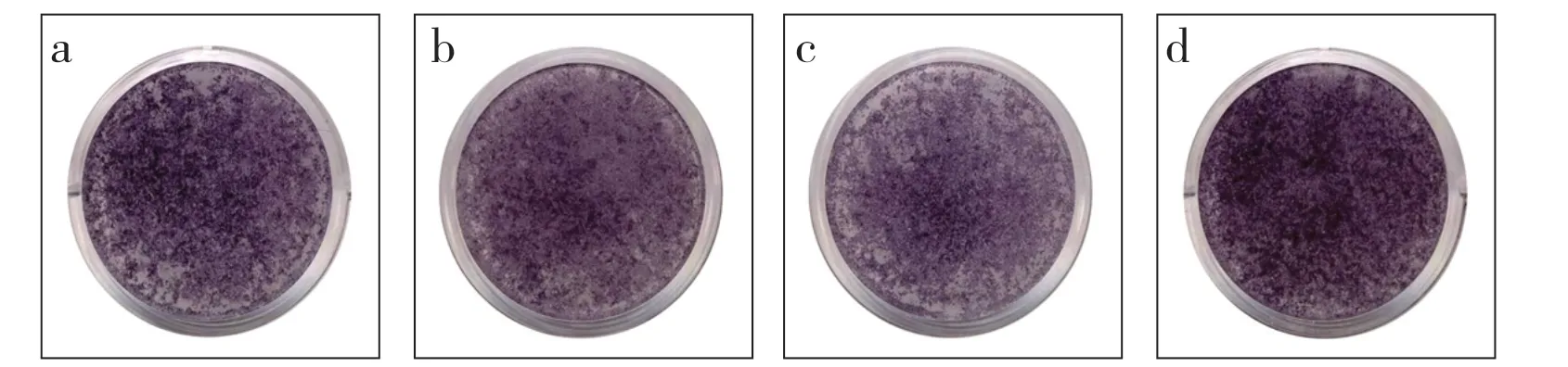
图5 ALP 染色Fig.5 ALP staining
2.5 ALP染色
空白组、转染对照组、miR-23a 过表达组、miR-23a 低表达组矿化面积百分比分别为1.29±0.17、1.31±0.28、0.93±0.08、2.15±0.32,组间差异有统计学意义(P< 0.05);与空白组、转染对照组比较,miR-23a 过表达组矿化面积百分比降低,miR-23a 低表达组A 矿化面积百分比升高;空白组、转染对照组矿化面积百分比差异无统计学意义(P> 0.05,图5)。
2.6 p-p38 MAPK/p38 MAPK、p-ERK1/2/ERK1/2表达
与空白组、转染对照组比较,miR-23a 过表达组p-p38 MAPK/p38 MAPK、p-ERK1/2/ERK1/2 表达降低,miR-23a 低表达组p-p38 MAPK/p38 MAPK、p-ERK1/2/ERK1/2 表达升高,差异均有统计学意义(P< 0.05,表2,图6);空白组、转染对照组比较,p-p38 MAPK/p38 MAPK、p-ERK1/2/ERK1/2 表达差异均无统计学意义(P> 0.05,表2,图6)。
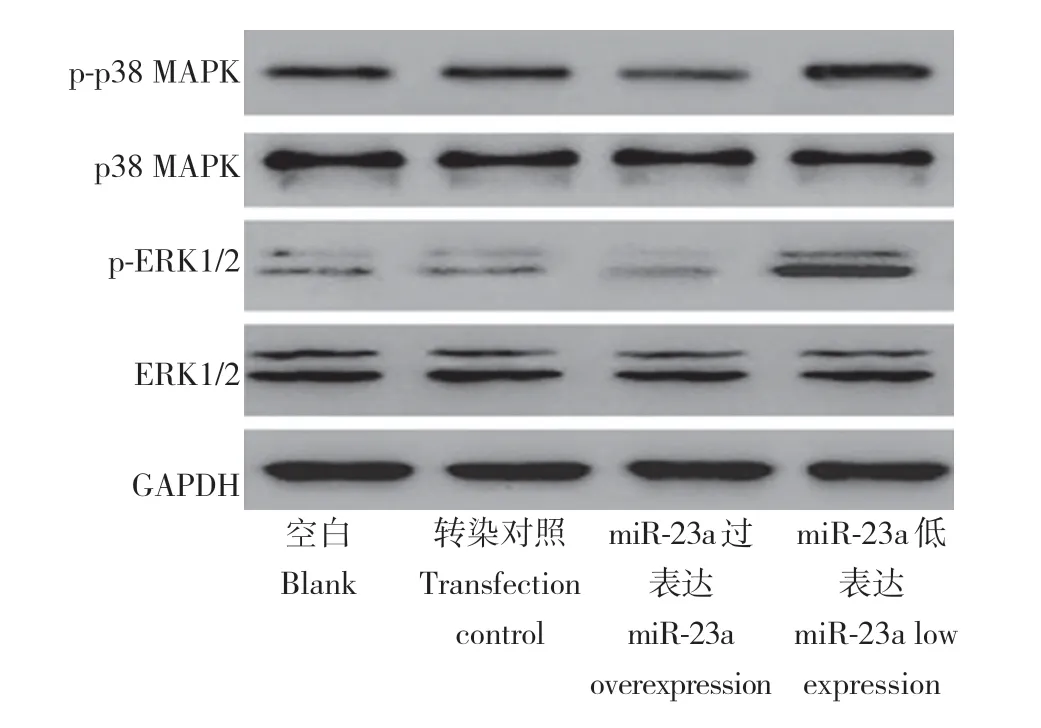
图6 各组p-p38 MAPK/p38 MAPK、p-ERK1/2/ERK1/2表达Fig. 6 Expressions of p-p38 MAPK/p38 MAPK and p-ERK1/2/ERK1/2 in each group
3 讨 论
目前OPLL 病因及发生机制尚停留在推测及学说阶段,主要包括椎间盘变性学说、机械应力损伤学说、骨质肥厚相关学说、糖代谢紊乱学说、遗传学说、钙代谢异常学说[17-18]。尽管研究已经较为深入,但因多种细胞生命活动均参与OPLL发生过程,其发生机理尚无法通过某单方面因素被充分解释[19]。因此,研究一些介导多个信号通路、显著影响疾病进程的关键性因素,对明确其发生机制、寻找新的靶向药物意义重大。
既往动物研究发现[20],敲除小鼠Cx43 基因,其发育阶段膜内化骨与软骨内化骨被明显阻滞。亦有研究[21-22]证实,成骨细胞因缺乏Cx43 而矿化功能减弱,并对合成代谢信号的反应造成影响。本研究结果显示,与对照A、B 组比较,OPLL 组Cx43 表达升高。以上结论提示,在颈椎后纵韧带细胞骨化过程中,Cx43 可能发挥重要的调控作用,但关于其上游调节机制尚不清楚。miRNA 在控制骨骼分化中起着至关重要的作用,其中miR-23a 备受关注,其主要通过靶向(直接和间接)转录因子参与成骨细胞形成[23-24]。已有研究[25]表明,miR-23a 可通过介导Cx43 抑制雌激素缺乏引起的心脏间隙连接损伤,但在OPLL 中是否存在调控关系仍有待研究。本研究比较了对照A 组、对照B 组、OPLL 组后纵韧带组织中miR-23a 表达情况,并通过转染观察Cx43 表达变化及颈椎后纵韧带细胞骨向分化情况,结果显示,与对照A、B 组比较,OPLL 组miR-23a 表达降低,且过表达miR-23a 后Cx43 mRNA 表达降低,低表达miR-23a 后Cx43 mRNA 表达升高,且经双荧光素酶实验验证miR-23a 与Cx43 存在靶向关系;与空白组、转染对照组比较,miR-23a过表达组矿化面积百分比降低,miR-23a 低表达组矿化面积百分比升高,提示过表达miR-23a 可抑制颈椎后纵韧带细胞骨向分化,反之则具有促进作用,且可能通过靶向调控Cx43 参与OPLL发生。
MAPK 通路包括p38 MAPK、ERK 介导的级联反应,是调控细胞生长因子、促有丝分裂物质分泌的重要蛋白激酶,可在多种刺激因子作用下被激活[26-28]。Liu 等[29]采用细胞松弛素D 干预小鼠MC3T3-E1 成骨细胞时发现,其改善细胞成骨性的机制之一是促进p38 MAPK 信号通路。Yang 等[30]认为,葛根素可通过介导ERK1/2 和p38-MAPK 信号通路刺激成骨分化和骨形成。以上结果均提示MAPK 信号通路在骨向分化中的重要作用。此外,Chen 等[31]发现,在体内外骨化后纵韧带组织中ERK1/2,p38 MAPK 途径均被激活,且这些信号的激活取决于Cx43,降低Cx43 表达将导致机械作用减弱和信号传导减少。由此可见,受机械应力上调的Cx43 似乎部分通过激活ERK1/2 和p38 MAPK 信号来促进韧带成纤维细胞的成骨分化。本研究结果显示,与空白组、转染对照组比较,miR-23a 过表达组p-p38 MAPK/p38 MAPK、p-ERK1/2/ERK1/2 表达均降低,miR-23a 低表达组p-p38 MAPK/p38 MAPK、p-ERK1/2/ERK1/2 表达均升高,提示miR-23a可能通过调控Cx43 进而调控MAPK 通路影响颈椎后纵韧带细胞骨向分化。
综上所述,OPLL 病理条件下,颈椎后纵韧带细胞中miR-23a 异常低表达,通过靶向上调Cx43 激活MAPK 信号通路,促进成骨分化,参与OPLL 发生及发展。

