Hoxc13 基因在滩羊羔羊不同生长时期皮肤组织的表达分析
田进阳,马丽娜,马 青*
( 1. 宁夏回族自治区滩羊选育场,宁夏 吴忠 7511002 ;2. 宁夏农林科学院动物科学研究所,宁夏 银川 750002 )
滩羊是我国地方裘皮用绵羊品种,“二毛皮”更是久负盛名,享誉海内外。“二毛皮”是指在滩羊羔羊出生后35日龄左右,毛长达8~9 cm时宰杀所剥取的毛皮,具有非常高的经济价值。但二毛期过后,毛股随着日龄的增长而变粗变长,这种优良的二毛裘皮性状逐渐消失,毛股变得松散,花穗亦欠美观[1]。
作为同源异型盒(homeobox,Hox)基因家族Abd-B类成员,Hoxc13基因在毛囊形成和毛发生长方面具有重要作用,可紧密调控角蛋白基因角蛋白(KP)和角蛋白关联蛋白(KAP)的表达。有研究表明,毛发的物理特性会受到Hoxc13 基因在皮肤组织中表达量的影响[2]。基于前期研究发现,Hoxc13 基因基因型CT 个体对毛长具有显著影响,可作为滩羊二毛性状分子标记辅助选育的关键基因[3]。为此,本试验利用qRT-PCR 分析Hoxc13基因在滩羊羔羊不同时期皮肤组织中的表达水平,为解析Hoxc13 基因在滩羊不同生长时期毛皮发育调控的分子机制提供参考。
1 材料与方法
1.1 样品采集
采集35、55 日龄滩羊羔羊的皮肤组织,每个日龄各取10只羊,样品大小约1 cm2,采集部位均为左侧肩胛骨后缘处,液氮保存。试验动物均来自宁夏盐池滩羊选育场。
1.2 引物设计及合成
根据GenBank 公布的绵羊Hoxc13 基因序列和18S rRNA基因序列,采用Primer5.0设计引物,由生工生物工程(上海)股份有限公司合成,合成引物序列见表1。
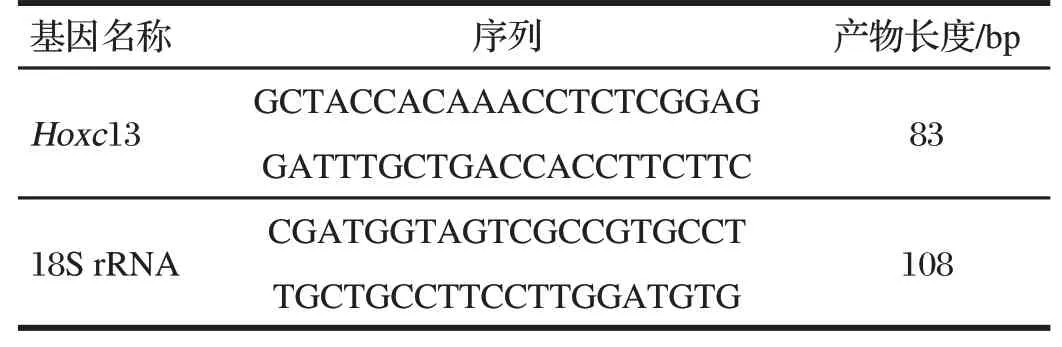
表1 引物序列Tab.1 Primer sequence
1.3 RNA提取
利用总RNA提取试剂盒(批号:DP419,天根生化科技(北京)有限公司)进行滩羊皮肤组织RNA提取,操作方法参考试剂盒说明书。提取的总RNA 通过1%琼脂糖凝胶电泳和紫外分光光度计进行检测。
1.4 Hoxc13基因Real-Time PCR检测
1.4.1 反转录
用反转录试剂盒TIANScript RT KIT(批号:KR107,天根生化科技(北京)有限公司)进行反转录,参照说明书对所提取的RNA进行反转录,合成cDNA第一链,进行10倍稀释,-20 ℃保存。
1.4.2Hoxc13基因Real-Time PCR检测
取2 μL 稀释的样品cDNA 作模板,分别用Hoxc13 基因基因引物和内参基因引物进行扩增。同时在60~95 ℃温度条件下进行溶解曲线分析,每个样品cDNA重复检测3次。
1.4.3Hoxc13基因Real-Time PCR反应体系与程序
扩增程序:95 ℃ 15 min;95 ℃ 15 s,58 ℃ 30 s,72 ℃30 s,45个循环。
反应体系:2×Super Real PreMixPlus 10 μL、上游引物(10 μmol/L)0.6 μL、下游引物(10 μmol/L)0.6 μL、cDNA 1μL、50×ROX Reference Dy 0.4 μL,加入灭菌纯化水至20 μL。
1.5 数据统计与分析
运用SYBR Green Ⅱ染料实时荧光定量PCR的方法进行验证。试验采用2-△△Ct法对35、55日龄滩羊的皮肤组织中Hoxc13 基因mRNA 的相对定量计算。试验数据采用Excel 2010软件进行整理,SAS 8.2软件进行统计分析。结果以“平均值±标准差”表示,P<0.01 表示差异极显著,P<0.05表示差异显著。
2 结果与分析
2.1 RNA提取结果(见图1)

图1 RNA提取结果Fig.1 RNA extraction result
由图1 可知,提取的总RNA 通过1%琼脂糖凝胶电泳进行检测,28S、18S 和5S 处均有条带,其中5S 带较浅,表明RNA 无明显降解。同时利用紫外分光光度计检测,OD260nm/OD280nm比值为1.8~2.0,表明RNA纯度较高。
2.2 Hoxc13基因Real-Time PCR检测结果(见图2~图4)
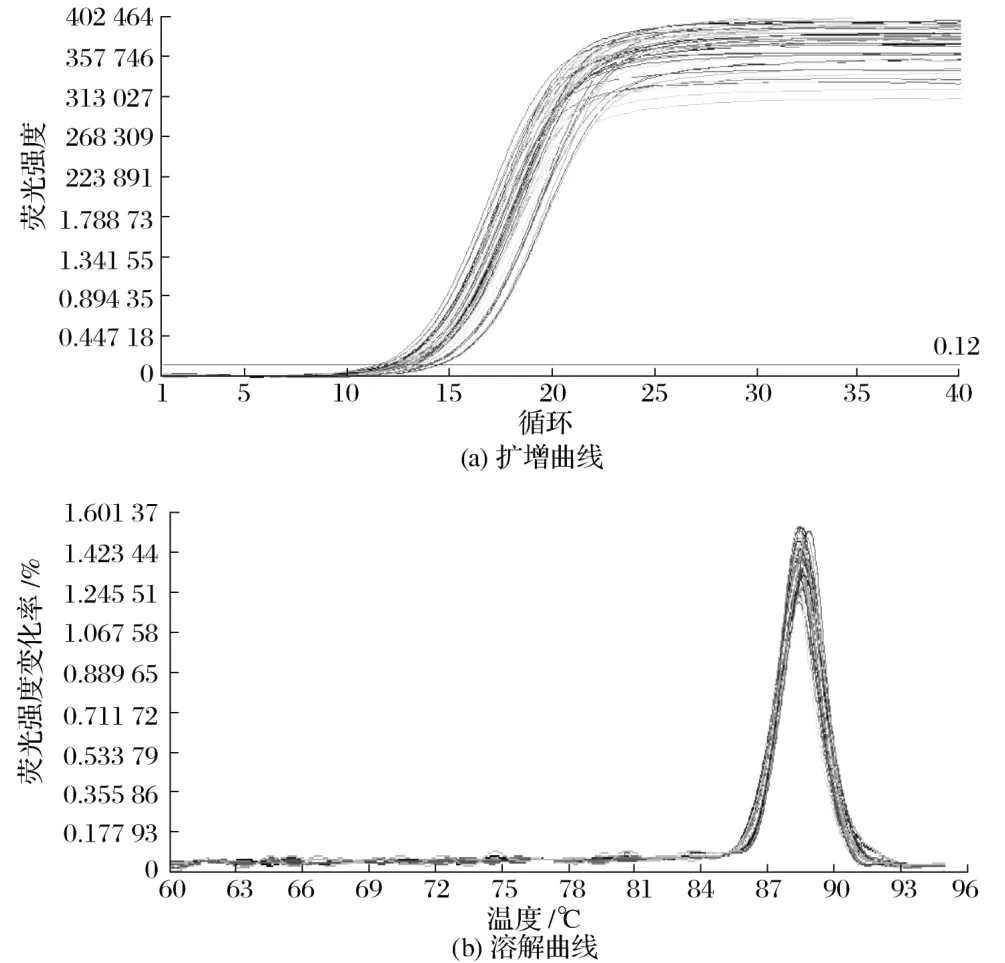
图2 内参基因18S rRNA实时扩增曲线及产物溶解曲线Fig.2 Reference gene 18S rRNA real-time amplification curve and product dissolution curve
由图2可知,在内参基因18S rRNA扩增曲线中总荧光强度在25 个循环左右开始趋于平缓,溶解曲线的峰值在80 ℃以上,有且只有1个峰。
不同生长时期Hoxc13 基因扩增曲线及溶解曲线见图3、图4。
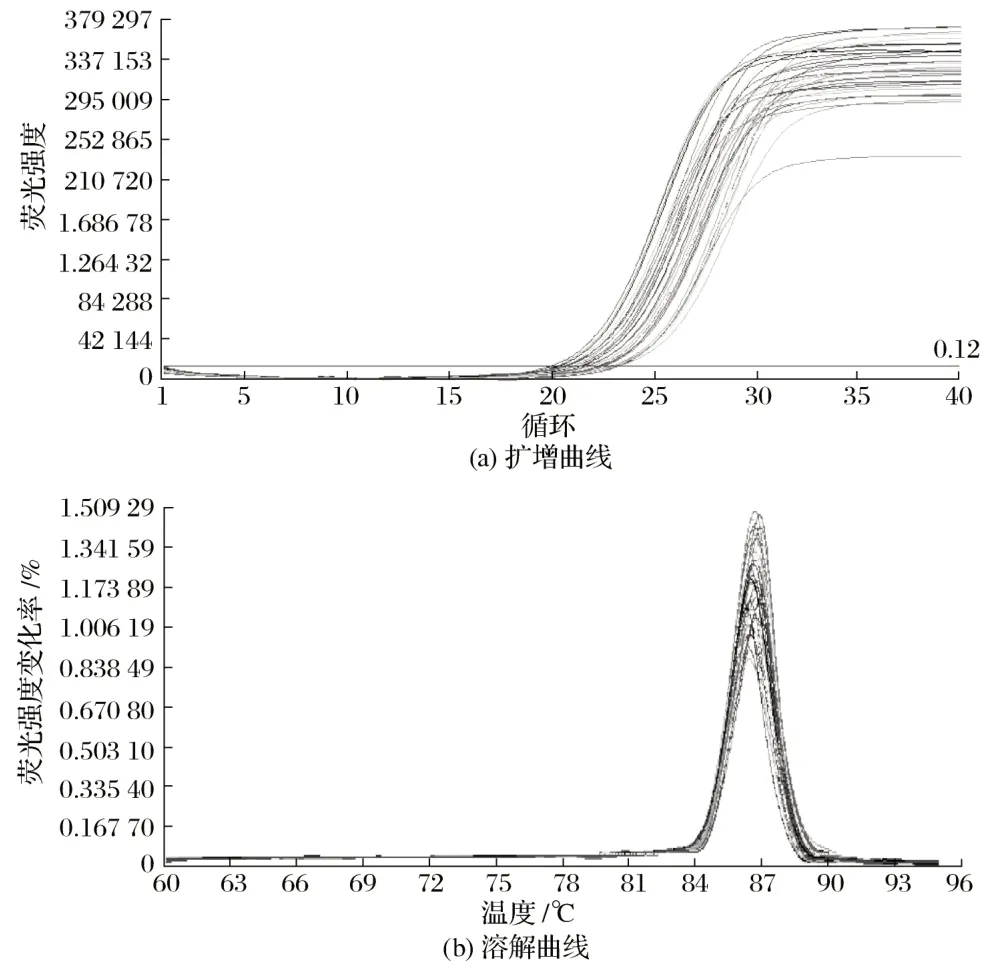
图3 35日龄滩羊皮肤组织中Hoxc13基因扩增曲线及溶解曲线Fig.3 Amplification and dissolution curves of Hoxc13 gene in 35 days of age of Tan sheep skin

图4 55日龄滩羊皮肤组织中Hoxc13基因扩增曲线及溶解曲线Fig.4 Amplification and dissolution curves of Hoxc13 gene in 55 days of age of Tan sheep skin
由图3、图4 可知,35 日龄和55 日龄滩羊皮肤Hoxc13基因溶解曲线的峰值均在80 ℃以上,有且只有1个峰。
2.3 不同时期滩羊皮肤组织中Hoxc13 基因的表达量(见表2)

表2 不同时期滩羊皮肤组织中Hoxc13基因的表达量Tab.2 Expression of Hoxc13 gene in skin tissue of Tan sheep at different periods
由表2可知,55日龄滩羊皮肤组织中Hoxc13基因的表达量极显著高于35日龄滩羊的皮肤组织(P<0.01)。
3 讨论
近年来,许多学者集中于研究特定基因的表达在毛囊发生、发育过程中的调控作用。Hoxc13基因在控制毛发形成方面起到重要作用[2]。Wu等[4]研究发现,在胚胎发育过程中,Hoxc13基因表达量与皮肤中毛囊形态形成具有相同的变化趋势。赵志东等[5]研究发现,在绒毛周期性生长过程中,KAP9.2基因可抑制绒毛生长,Hoxc13基因则会影响KAP9.2 基因的表达。也有研究发现,苏博美利奴羊各组织器官中均有Hoxc13 基因表达,在皮肤中的表达量高于肌肉、肾脏、心脏、脾脏、肺脏和肝脏组织,认为Hoxc13 基因可能与毛囊发育的过程相关[6]。Wu 等[7]研究发现,Hoxc13/β-catenin基因与卵泡活性相关,7 月到11 月间Hoxc13 基因的表达量急剧增加,Hoxc13 基因的过表达降低了对毛囊具有负作用的HFDRGs 的表达量,因此认为Hoxc13基因对毛囊发育具有积极作用。
在毛囊生长发育过程中,角蛋白和角蛋白关联蛋白调控相关细胞的生长发育、分化、迁移、增殖和凋亡,Hoxc13基因通过控制角蛋白和角蛋白关联蛋白进而控制哺乳动物的毛发性状[8]。滩羊胚胎期毛囊与毛纤维发育相关基因的表达与调控造就了滩羊二毛期的毛皮特性[9]。雒志新[10]研究发现,Hoxc13 转录因子Hoxc13 对KRT38、KRT84 基因为正调控,对KRT1基因为负调控。在绒山羊胎儿时期,Hoxc13基因的表达量随着胎儿皮肤厚度的增加而增加;在成年绒山羊皮肤中,Hoxc13基因的表达量与次级毛囊活性变化趋势一致。在哺乳动物被毛发育过程中,Hoxc13基因作用发生了适应性进化,且在绒山羊皮肤毛囊形态及周期性生长过程中具有重要作用[11]。Hoxc13 基因在出生后两周的绒山羊羔羊皮肤中的表达量远高于70 d 胚胎[12]。研究发现,西藏绒山羊Hoxc13基因的CDS序列遗传保守型,仅在第1外显子发现1个错义突变和2个同义突变[13]。
4 结论
本研究结果显示,35、55 日龄滩羊羔羊皮肤组织中均有Hoxc13 基因表达,且在55 日龄滩羊皮肤中的表达量极显著高于35 日龄滩羊的皮肤组织,推测Hoxc13 基因可能与毛囊发育的过程密切相关。

