新疆南疆某规模肉牛场牛轮状病毒G6P[5]型基因型鉴定及分析
赵颖婕,张 伟,冷 婧,王宏图,胡建军*
( 1. 塔里木大学兵团塔里木动物疫病诊断与防控工程实验室,新疆 阿拉尔 843300 ; 2. 塔里木大学动物科学与技术学院,新疆 阿拉尔 843300 ; 3. 阿克苏西域牧业发展有限责任公司,新疆 阿克苏 843000 )
轮状病毒(BRV)属于呼肠孤病毒科,为轮状病毒属的双链RNA病毒[1],是导致多种幼龄动物非细菌性腹泻的主要病原之一。犊牛感染后主要表现特征为腹泻、酸中毒、四肢无力、精神萎靡,腹泻严重时粪便中含有血丝和脱落的肠黏膜,其中1 周龄犊牛最易感,发病率高达90%~100%,对畜牧业造成严重危害。
轮状病毒属成员呈正二十面体对称,直径约75 nm,三层壳体,无囊膜,基因组由11个节段双股RNA组成。根据轮状病毒抗原关系和基因组RNA节段的PAGE电泳图谱,分为7 个种或血清型,即A~G。根据保护性抗原VP4 和VP7 的免疫原性和基因结构又可分为轮状病毒血清群分为P基因型和G基因型。A群感染力最强,危害最大;目前已知的G型有34个,P型有50个,国内为G6和G10流行株较多[2],而且不同基因型之间交叉免疫保护性不强[3]。近年来,新疆南疆地区时有从其他地区大量引入奶牛或肉牛,犊牛腹泻成为规模化牛场、散养户常见的犊牛腹泻疾病。本试验旨在针对南疆某规模化牛场进行BRV分子流行病学调查,了解该地区BRV流行毒株的基因型,为规模牛场疫病防控剂疫苗研发提供参考。
1 材料与方法
1.1 主要试剂
BRV检测试纸条(广州悦洋生物技术有限公司)、One Step RT-PCR Kit Ver.2.0试剂盒和RNA提取试剂盒(北京天根生化科技有限公司)、反转录试剂盒(Thermo Scientific公司)、DMEM 培养基(西安米鼠生物科技有限公司)、MA104细胞(上海富衡生物科技有限公司)、胎牛血清(以色列生物工业有限公司)。
1.2 病料采集及处理
病料为采集自新疆南疆某规模化肉牛场的犊牛腹泻样本共5 份,经BRV 抗原检测卡检测,其中2 份确定为BRV阳性,-80 ℃冷冻保存。
1.3 引物设计
据参考文献[4]BRV 特异性引物基因序列,由上海派森诺公司合成,RT-PCR扩增引物见表1。
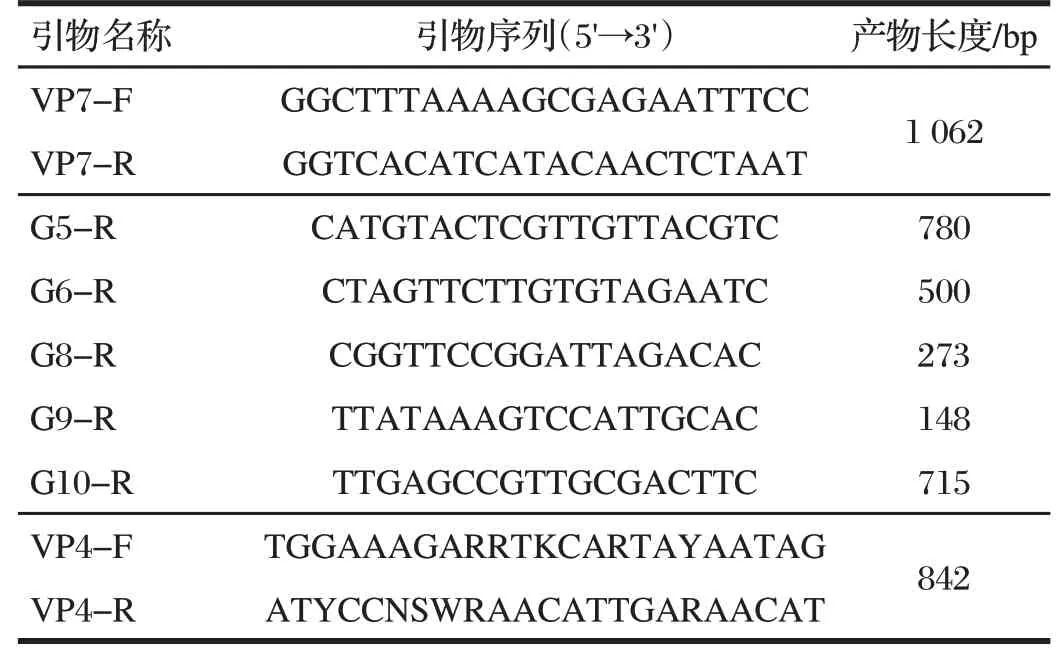
表1 RT-PCR扩增引物Tab.1 RT-PCR amplification primers
1.4 细胞培养
取细菌滤器处理的牛轮状病毒阳性样本上清液于37 ℃用胰蛋白酶处理30 min,并接种于致密单层的MA104 传代细胞,CO2细胞培养箱37 ℃培养2 h,每隔20 min,取出轻晃一次,最后加入10 mL 维持液,放入CO2培养箱中培养,接毒5 d后收毒,继续盲传4~5代,直到产生细胞病变(CPE)。
1.5 RNA提取
出现CPE的细胞培养液按照RNA提取试剂盒说明书操作,提取RNA于-80 ℃冰箱保存。
1.6 BRV的VP7、VP4基因鉴定
采用VP7-F 和VP7-R 的引物扩增蛋白全长基因,以第一次的RT-PCR产物作为第二次RT-PCR的模板,采用VP7-F 与G5-R、G6-R、G8-R、G9-R、G10-R 等引物进行多重半套式PCR 鉴定BRV 的G 型[3];以VP4-F 和VP4-R特异性引物,扩增其蛋白基因,鉴定其P型。
扩增反应体系(25 μL):Primescript 1 step Enzyme Mix 0.5 μL,VP7-F 0.5 μL,VP7-R 0.5 μL,模板RNA 2.5 μL,2×1 step Buffer 12.5 μL,RNase Free dH2O 8.5 μL;混匀后瞬时离心5 s。
反应程序:95 ℃预变性5 min;94 ℃变性1 min,55 ℃退火45 s,72 ℃延伸30 s,35个循环;72 ℃总延伸10 min。
取扩增产物于1%琼脂糖凝胶电泳鉴定[4]。目的条带纯化后送上海派森诺公司测序。
1.7 序列分析
测序序列在GenBank 中进行BLAST 比对分析,下载BRV 参考株的VP7、VP4 部分编码序列,通过DNASTAR、MEGA 生物软件对所测序基因序列与参考株进行核苷酸同源性比较,构建VP7、VP4部分基因系统进化树。
2 结果与分析
2.1 病毒分离结果
将检测为阳性的样品接种到MA104 细胞,其中在第五代出现CPE,主要表现为细胞圆缩、集聚、脱落等。
2.2 RT-PCR鉴定结果(见图1~图3)
图1 BRV VP7基因RT-PCR扩增结果Fig.1 RT-PCR amplification results of BRV VP7 gene
由图1可知,对细胞培养液样本提取的RNA产物作为模板,用VP7-F 和VP7-R 作为引物,进行RT-PCR 检测,结果显示,扩增出1 062 bp的目的基因片段。
由图2 可知,以PCR 产物为模板,上游引物为VP7-F,下游引物分别为G5-R、G6-R、G8-R、G9-R、G10-R 进行半套式PCR,其中仅有引物VP7-F/G6-R 扩增出500 bp 大小的目的基因片段。

图2 BRV VP7基因G型鉴定Fig.2 G-type identification results of BRV VP7 gene positive samples
由图3可知,以VP4-F和VP4-R为引物扩增出842 bp大小的条带。

图3 BRV VP4基因P型鉴定Fig.3 P-type identification results of BRV VP4 gene positive samples
2.3 VP7、VP4基因核苷酸同源性分析(见图4~图7)

图4 BRV VP7基因核苷酸同源性比较Fig.4 Nucleotide homology comparison of BRV VP7 gene
由图4可知,通过DNAStar软件对所测序序列与NCBI中13个参考株VP7基因序列进行核苷酸同源性比较,所测序基因核苷酸序列与12个参考毒株的同源性高达90%以上[5],与参考株MN928482(中国/2020,牛,MN928482.1)和MZ420184(韩国/2020,牛,MZ420184.1)参考株的核苷酸同源性为98.8%。
由图5可知,BRV VP7与MN928485(G6型)牛轮状病毒处于同一进化分支。确定该样本为G6 型牛轮状病毒,并命名为BRV-MGT-1。

图5 BRV VP7基因进化树分析Fig.5 Evolutionary tree analysis of BRV VP7 gene
由图6 可知,所测序序列与NCBI 中13 个参考株VP4基因序列的核苷酸同源性比较,样本核苷酸序列与13个参考毒株的同源性高达91%以上,与参考株MN937516(中国/2018,牛,MN937516.1)和MN937515(中国/2018,牛,MN937515.1)参考株的核苷酸同源性分别为97.7%和97.1%。
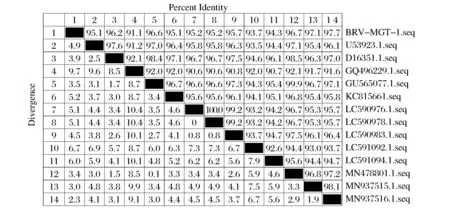
图6 BRV VP4基因核苷酸同源性比较Fig.6 Nucleotide homology comparison of BRV VP4 gene
由图7 可知,BRV-MGT-1 与P[5]型轮状病毒处于同一进化分支,并与MN937515(P5型)、MN937516(P5型)的核苷酸同源性为97.1%以上[6]。最终确定BRV-MGT-1为G6P[5]型轮状病毒。
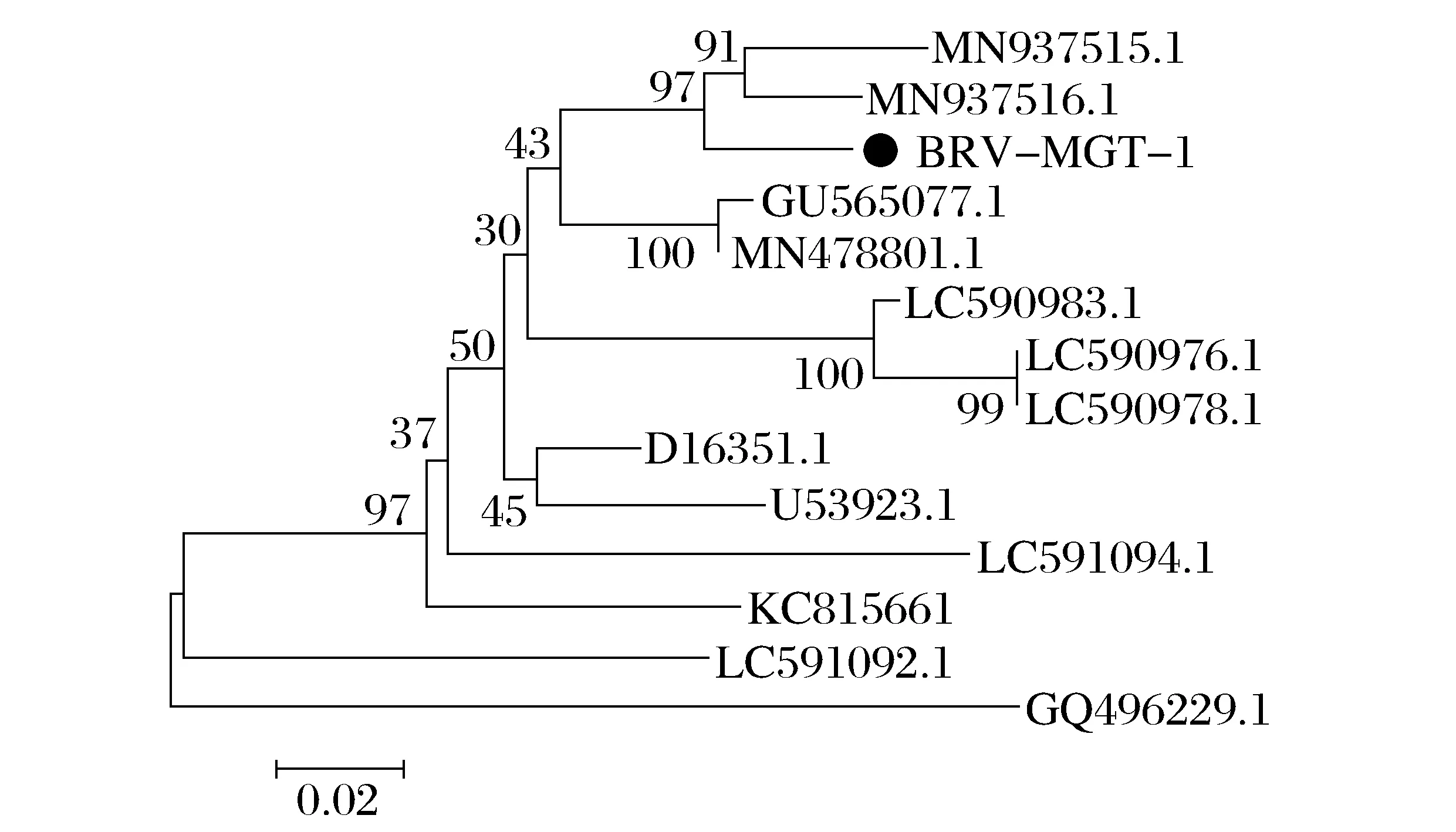
图7 BRV VP4基因进化树分析Fig.7 Evolutionary tree analysis of BRV VP4 gene
3 讨论
近几年,新疆南疆地区从其他地区引入大批肉牛、奶牛。BRV是引起新生犊牛腹泻的重要病原之一,每年因犊牛腹泻造成严重的经济损失,成为困扰养牛业发展的重要因素。目前,国外流行的BRV 主要的基因型为G6 型、G8 型和G10 型,而我国主要流行G6 型和G10 型BRV[7]。国内多位学者报道了新疆地区牛感染BRV的情况,段新华等[8]对新疆4地区的7个牛场犊牛腹泻开展流行病学调查,结果表明为A 群BRV 感染。2018 年,陆亚冬等[9]以BRVVP6基因特异性引物,通过RT-PCR检测到新疆不同地区牛场犊牛存在BRV 感染,且BRV 阳性率较高,达72%。2008 年,常继涛等[3]报道,新疆部分奶牛场感染的BRV 为G10 型和G6 型。2016 年,张坤等[10]应用双抗体夹心ELISA、RT-PCR 的方法进行检测,结果发现,新疆部分地区犊牛感染BRV 的情况极为普遍。2019—2020 年,张迎春等[11]、崔鑫等[12]报道了新疆南疆部分规模牛场犊牛感染的BRV为G10型。
新生犊牛感染BRV所致腹泻很难通过临床诊断确诊,而根据BRVVP7和VP4的基因差异即可进行基因分型鉴定[13]。本研究通过对新疆南疆某规模肉牛场采集的犊牛腹泻粪便样品,经胶体金检测卡、RT-PCR 扩增VP7、VP4基因的方法进行分型鉴定[14],确定BRV-MGT-1分离株为G6P[5]型BRV。此外,通过流行病学调查,该规模化肉牛场是新建场,部分牛曾从国内其他省份调入,该场BRV是国内其他地区引入还是当地传入还需进一步的流行病学调查。通过上述分析可知,新疆地区BRV以G10型、G6型基因型为主,与国内报道一致[11],本研究结果也丰富了国内犊牛BRV分子流行病学数据库。
4 结论
目前,BRV呈现多样化流行趋势,BRV基因组在自然感染或试验条件下,可发生多宿主来源的基因重组现象。BRV既可以引起动物病毒性腹泻,也可感染人。病毒只要在人或动物群体中持续存在就可能导致BRV在易感动物群体中传播。此外,牲畜交易、调运移动可能导致BRV基因型分布发生变化。因此,对新疆当地犊牛腹泻开展BRV分子流行病学监测,有利于掌握BRV基因型变迁特征,为BRV疫苗研发提供参考。

