基于转录组分析的紫花苜蓿组成型抗蓟马性研究
爽爽 代蕊 陈崎 刘慧洁 姜晓红 特木尔布和 谭瑶 张志强


摘要:为了探究紫花苜蓿组成型抗蓟马转录调控机制,以自主培育的抗蓟马苜蓿品种草原4号为研究对象,以感蓟马苜蓿品种草原2号为对照,采用RNA-seq技术进行转录组测序分析。试验共获得82.34 Gb clean data,组装得到77 837个unigenes,139 949个转录本,平均序列长度为830.17 bp;共有47 573个unigenes被注释到六大数据库中。与草原2号相比,草原4号共检测到差异基因2 388个,其中上调基因1 361个,下调基因1 027个。KEGG对相关差异基因的功能注释表明,上调基因主要注释到能量代谢、碳水化合物代谢等代谢过程以及遗传信息处理相关途径,下调基因主要注释到遗传信息处理、细胞过程和环境适应相关途径。qRT-PCR驗证结果发现所选的8个基因在2个品种中的相对表达量同RNA-Seq测的结果一致,说明本试验中转录组的结果可靠。结果可为揭示苜蓿组成型抗蓟马机理奠定基础,进而为抗蓟马新品种培育及蓟马防治提供理论支撑。
关键词:苜蓿;抗蓟马;转录组;RNA-seq
中图分类号:S476;S433.89文献标志码:A
文章编号:1002-1302(2023)05-0044-07
紫花苜蓿(Medicago sativa L.)被称为“牧草之王”,是一种高产、优质且固氮能力强的优良牧草,是中国及世界栽培最广泛的牧草。但在紫花苜蓿的栽培生产过程中,虫害是影响紫花苜蓿产量和品质的重要因素。我国已报道的苜蓿害虫有8目48科297种,而蓟马(Thripidae)已成为苜蓿生产的主要害虫之一[1-2]。蓟马是缨翅目昆虫的统称,是一种危险性入侵害虫,寄主范围较广,其特有的锉吸式口器既可以通过挫破植物表皮,消耗韧皮部组织的汁液造成直接的摄食损害,也可以通过传播番茄斑萎病毒在内的多种病毒造成间接的损害,从而导致作物、蔬菜及牧草的产量和质量下降[3-4]。据报道,我国在苜蓿生产中,蓟马每年造成10%~30%的草产量损失[5]。目前,蓟马的防治管理主要依靠化学农药,但过量使用化学农药会导致蓟马抗药性、生态系统破坏和食品安全等问题[6-7]。因此,从长远和经济环保的角度出发,通过培育抗蓟马苜蓿新品种减少蓟马危害具有重要的经济价值和生态效益[8-9]。从不同角度对植物抗蓟马机理的揭示是抗蓟马新品种培育及蓟马防治的理论支撑。
在与昆虫的长期进化过程中,植物已经进化出包括组成型防御和诱导型防御在内的复杂的防御机制来抵御草食性害虫的侵害。组成型防御是植物所固有的,不需要昆虫取食诱导就能产生的防御策略,一般包括物理防御和化学防御。通常,植物表面毛状体、蜡质角质层、硅和细胞壁等物理结构是阻止昆虫取食的第一道防线[10-12],而包括毒素或代谢物在内的生化防御则是第二道防线[13-14]。近年来,从表型特征、生化防御、代谢调控、多组学及分子机制等不同层面有关不同植物抗蓟马机制的研究也成为热点[4,8-9,15-16]。
在广泛收集抗源的基础上,笔者所在课题组采用轮回选择法,成功选育出草原4号紫花苜蓿——抗蓟马苜蓿新品种[10]。以感蓟马苜蓿品种草原2号为对照,笔者所在课题组已经从表型特征、生化防御、激素等角度开展苜蓿抗蓟马机理的探索[16-20],但缺乏从分子层面对草原4号组成型抗蓟马机制的分析。因此,本研究以草原4号和草原2号苜蓿为材料,利用转录组测序技术,探索草原4号组成型抗蓟马的相关分子调控途径,为苜蓿组成型抗虫机制的深入挖掘及通过生物技术手段进行苜蓿新品种培育提供理论支撑。
1 材料与方法
1.1 供试材料及生长条件
以草原4号苜蓿(Medicago sativa L.‘Caoyuan No.4)和草原2号苜蓿(Medicago varia Martin.‘Caoyuan No.2)为试验材料,2个品种皆为课题组培育的国家审定品种。依据虫情指数低于0.5表示品种为抗虫品种的评价标准[21],前期的抗蓟马评价证明,草原4号苜蓿的虫情指数为0.334,为抗蓟马品种;草原2号苜蓿的虫情指数为0.901,为感蓟马品种[19]。于2019年在内蒙古农业大学草原与资源环境学院人工气候室内种植草原2号和草原4号苜蓿各30盆,每盆3株,其生长条件为昼夜平均温度为(30±5) ℃和(20±5) ℃,相对湿度为(65±5)%和(70±5)%,保证所有材料生长环境一致,培育3周后,取顶部3~4张叶子于液氮中速冻,-80 ℃ 保存备用,每个品种3个重复。
1.2 试验方法
1.2.1 RNA 测序
将低温保存的叶片材料送上海美吉生物医药科技有限公司进行RNA-Seq测序分析,所用测序平台为Illumina Hiseq 4000(版本2×150 bp)。测序原始序列数据保存在NCBI存档(http://www.ncbi.nlm.nih.gov/Traces/sra,登录号 PRJNA622603)。
1.2.2 RNA-Seq数据分析
使用Trinity (https://github.com/trinityrnaseq/trinityrnaseq)在线工具对所有样本的clean data进行De novo组装,获得unigenes,并对其进行优化评估;将所有基因和转录本分别与 NR、Swiss-Prot、Pfam、COG、GO 和 KEGG 等六大数据库进行比对从而获取注释信息,并统计各数据库注释情况;通过与NR(NCBI非冗余蛋白库)综合数据库比对,查看本物种转录本序列与相近物种的相似情况;通过主成分分析(PCA)深入挖掘样品之间的关系和变异大小。使用DESeq2软件对测序数据进行差异基因的筛选,筛选参数为adjust P-value<0.05 & |log2FC| ≥1;并对差异基因进行KEGG功能注释与富集分析[16,22]。
1.2.3 qRT-PCR 验证
从不同处理的叶子中提取总RNA,使用带有gDNA Eraser的 PrimeScript RT试剂进行cDNA反转录。使用ABI7500FAST 实时荧光定量PCR仪进行qRT-PCR相关基因的表达量分析。反应使用3个生物学重复和3个技术重复进行,并使用2-ΔΔCT 法进行相对表达量计算[23]。qRT-PCR结果同RNA-seq测定的相应基因的TPM值进行比较分析,验证测序结果。试验中使用的基因和引物序列如表1所示。
2 结果与分析
2.1 转录组测序、组装和注释概述
通过使用Illumina HiSeq 2500平台,对抗蓟马苜蓿品种草原4号(R_CK)和感蓟马苜蓿品种草原2号(S_CK)的转录组进行分析。每个处理3个独立的生物学重复,共完成6個样品的转录组分析,获得82.34 Gb clean data。使用Trinity对所有样本clean data进行De novo组装,组装得到的unigene个数为77 837条,转录本个数为139 949条,平均序列长度为830.17 bp,N50平均长度为1 386 bp,E90N50 平均长度为2 187 bp(表2)。
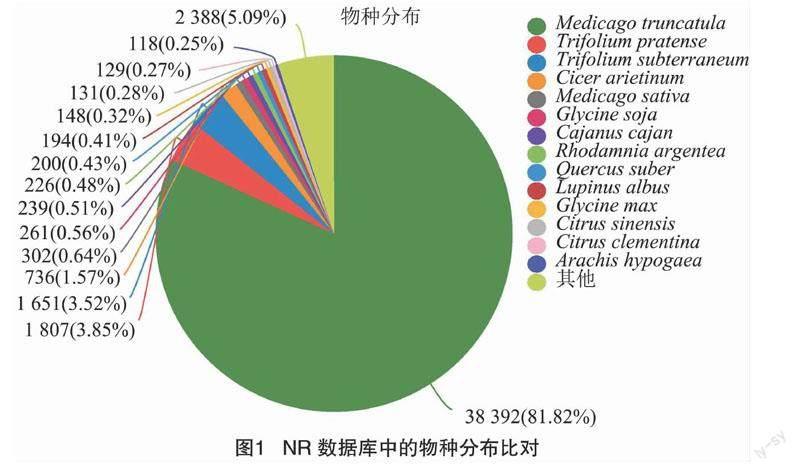
通过所有unigenes和转录本分别与NR、Swiss-Prot、Pfam、COG、GO 和 KEGG 等数据库进行比对,结果发现在75 756个组装的unigenes中,发现共有46 789个unigenes被注释到六大数据库中,分别为NR (46 152)、Swiss-Prot(28 837)、Pfam (28 506)、eeNOG(33 999)、GO(39 565) 和 KEGG(17 270),且其中11 511个unigenes在6个数据库共同注释(图1-a)。通过与NR库的比对,发现 38 392 个(81.82%)注释的unigenes与蒺藜苜蓿的序列匹配(图1-b)。
2.2 差异基因分析
样品的主成分分析(PCA)表明,S_CK和R_CK之间存在明显差异,且2个品种的3个样品分别聚在一起,说明样本间差异主要来源于品种差异,且测试样品重复性较好,可以依据品种进行差异基因分析(图2-a)。如图2-b所示,与草原2号相比,草原4号共检测到差异基因2 388个,其中上调基因1 361个,下调基因1 027个。
KEGG注释分析发现,与草原2号相比,草原4号中有174个上调基因和212个下调基因分别注释到代谢、遗传信息处理、环境信息处理、细胞过程、生物体系统等五大类KEGG代谢通路的18个不同的代谢途径中(图3-a、图3-b)。其中,上调基因主要注释到能量代谢、碳水化合物代谢等代谢过程以及折叠、分类和降解、复制和修复、转录和翻译等遗传信息处理相关途径(图3-a);下调基因主要注释到折叠、分类和降解、复制和修复等遗传信息处理相关途径以及属于细胞过程的转运和催化途径和环境适应相关途径(图3-b)。
Go富集分析表明,草原4号和草原2号差异基因主要富集在端粒组织、端粒维持、解剖结构稳态等生物过程中, 说明2个品种本身的遗传特点可能同抗蓟马性直接相关(图4)。
2.3 差异基因的qRT-PCR基因验证
为了确认通过RNA-Seq鉴定的不同基因表达的重现性和准确性,随机选取了8个基因进行qRT-PCR验证。如图5所示,qRT-PCR结果表明草原4号中TRINITY_DN10608_c0_g2、TRINITY_DN12291_c0_g1和TRINITY_DN17228_c0_g1等3个基因的表达量都极显著高于草原2号,而TRINITY_DN11714_c0_g1、TRINITY_DN11779_c0_g2、TRINITY_DN10336_c0_g1、TRINITY_DN10194_c1_g1和TRINITY_DN1145_c1_g1等5个基因的表达量都显著低于草原2号,8个基因的qRT-PCR表达量和转录组测序TPM值(RNA-Seq)的表达趋势一致,说明RNA-Seq测得的基因相对表达量结果可靠。
3 讨论
随着国家“振兴奶业苜蓿发展行动”计划的实施及我国农业产业结构的调整,我国苜蓿种植面积逐年增加,仅内蒙古目前苜蓿人工草地保有面积超过1 000万亩(1 hm2=15亩)。然而,虫害已经成为影响苜蓿产量和品质的重要因素。无论是草产业发展还是生态建设均需要大量抗病虫的优良苜蓿品种。植物抗病虫新品种选育及病虫害防治受多方面因素影响,通过深入了解植物的抗虫机制,特别是多角度阐释苜蓿抗蓟马的机理,对苜蓿抗虫品种选育及蓟马防治具有重要的理论意义[24]。随着生物技术的发展,对于植物抗蓟马的分子机制也多有报道。研究者通过QTL图谱在胡椒的第6染色体上定位到了抗蓟马位点并开展了抗蓟马基因功能的研究[25-26],相似的研究在辣椒[27]和番茄[28]中都有开展。此外,Tu等利用转录组测序技术,以甘农 1 号和 WL323 苜蓿品种为研究对象,发现苜蓿诱导性抗蓟马与类黄酮生物合成、β-丙氨酸代谢及水杨酸代谢途径的基因密切相关[4]。
生物体的表型由 DNA、RNA、蛋白质及代谢物等多个层面调控决定,mRNA研究可以获得样本之间的差异基因、复杂调控网络。转录组是连接基因组遗传信息与生物功能的必然纽带,是解析生物分子调控机理的重要手段[29]。在前期研究的基础上,本研究以自主培育的抗蓟马苜蓿品种草原4号为研究对象,采用转录测序技术从转录水平探索苜蓿组成型抗蓟马的调控机制。通过对测序结果的整体评估,表明测序结果质量较好。PCA结果表明草原4号和草原2号品种间差异较大,且各处理间重复性较好,为差异基因的筛选鉴定提供保证。该结果与Tu等报道的结果[14]一致,说明抗蓟马品种和感蓟马品种在基因型上存在明显的差异。对差异基因的功能注释发现,抗蓟马品种草原4号上调基因主要注释到遗传信息处理相关途径、细胞过程和环境适应相关途径, 表明草原4号抗蓟马特性和其本身的遗传信息直接相关。研究发现,植物初级代谢如碳水化合物、氮代谢相关产物在植物对昆虫的组成和诱导型防御中都具有重要作用[30]。本研究发现与感虫品种草原2号相比,草原4号下调基因主要注释到能量代谢、碳水化合物代谢等初生代谢过程以及遗传信息处理相关途径。因此,笔者所在课题组推测,在苜蓿组成型抗蓟马防御反应中,初生代谢途径可能扮演着更重要的角色。与此不同的是大量的报道发现,在植物的组成或诱导型抗蓟马过程中,生物碱、黄酮类、萜类等次生代谢产物更为重要[4,6,16,31]。本研究结果为深入阐述苜蓿组成型抗蓟马机理、蓟马防治及利用生物技术手段进行抗蓟马植物品种选育提供理论支撑。
4 結论
转录组测序结果表明,草原4号紫花苜蓿组成型抗虫与其本身遗传信息处理相关途径、细胞过程和环境适应相关途径密切相关,同时能量代谢、碳水化合物代谢等初生代谢途径在苜蓿组成型抗蓟马防御反应中具有重要作用。研究结果为揭示苜蓿组成型抗蓟马机理奠定了基础,进而为抗蓟马新品种培育及蓟马防治提供理论支撑。
参考文献:
[1]张 奔,周敏强,王 娟,等. 我国苜蓿害虫种类及研究现状[J]. 草业科学,2016,33(4):785-812.
[2]Wu S Y,Tang L D,Zhang X R,et al. A decade of a thrips invasion in China:lessons learned[J]. Ecotoxicology,2018,27(7):1032-1038.
[3]Steenbergen M,Broekgaarden C,Pieterse C M J,et al. Bioassays to evaluate the resistance of whole plants to the herbivorous insect Thrips[J]. Methods in Molecular Biology (Clifton,N.J.),2020,2085:93-108.
[4]Tu X B,Liu Z K,Zhang Z H.Comparative transcriptomic analysis of resistant and susceptible alfalfa cultivars (Medicago sativa L.) after thrips infestation[J]. BMC Genomics,2018,19(1):116.
[5]杨青川. 苜蓿生产与管理指南[M]. 北京:中国林业出版社,2003:167-171.
[6]Steenbergen M,Abd-el-Haliem A,Bleeker P,et al. Thrips advisor:exploiting thrips-induced defences to combat pests on crops[J]. Journal of Experimental Botany,2018,69(8):1837-1848.
[7]Gao Y L,Lei Z R,Reitz S R.Western flower thrips resistance to insecticides:detection,mechanisms and management strategies[J]. Pest Management Science,2012,68(8):1111-1121.
[8]van Haperen P,Voorrips R E,Lucatti A F,et al. The effect of a thrips resistance QTL in different Capsicum backgrounds[J]. Euphytica,2020,216(12):187.
[9]Wu F,Shi S L,Li Y Z,et al. Physiological and biochemical response of different resistant alfalfa cultivars against thrips damage[J]. Physiology and Molecular Biology of Plants,2021,27(3):649-663.
[10]Wahyuni Dinar S C,Hae C Y,Leiss K A,et al. Morphological and chemical factors related to western flower thrips resistance in the ornamental Gladiolus[J]. Plants,2021,10(7):1384.
[11]Gibson R W. Glandular hairs providing resistance to aphids in certain wild potato species[J]. Annals of Applied Biology,1971,68(2):113-119.
[12]Macel M,Visschers I G S,Peters J L,et al. High concentrations of very long chain leaf wax alkanes of thrips susceptible pepper accessions (Capsicum spp.)[J]. Journal of Chemical Ecology,2020,46(11):1082-1089.
[13]Tayal M,Somavat P,Rodriguez I,et al. Polyphenol-rich purple corn pericarp extract adversely impacts herbivore growth and development[J]. Insects,2020,11(2):98.
[14]Singh S,Kariyat R R. Exposure to polyphenol-rich purple corn pericarp extract restricts fall armyworm (Spodoptera frugiperda) growth[J]. Plant Signaling & Behavior,2020,15(9):1784545.
[15]Mouden S,Leiss K A. Host plant resistance to thrips (Thysanoptera:Thripidae)-current state of art and future research avenues[J]. Current Opinion in Insect Science,2021,45:28-34.
[16]Zhang Z Q,Chen Q,Tan Y,et al. Combined transcriptome and metabolome analysis of alfalfa response to thrips infection[J]. Genes,2021,12(12):1967.
[17]特木尔布和,肖燕子. 苜蓿新品种草原4号的选育[J]. 草业科学,2017,34(4):855-860.
[18]刘玉良. 抗蓟马苜蓿新品系抗性机理研究[D]. 呼和浩特:内蒙古农业大学,2009.
[19]武杰瑞,刘秉毅,特木尔布和,等. 蓟马取食对苜蓿氨基酸组成及含量的影响[J]. 草地学报,2022,30(1):62-68.
[20]萨如拉,张志强,伟勒斯,等. 两个苜蓿品种营养器官解剖结构特征比较[J]. 西北植物学报,2020,40(11):1881-1887.
[21]吴永敷,薇 玲,赵秀华,等. 苜蓿对蓟马的抗源筛选试验[J]. 中国草地,1990,12(5):61-63,65.
[22]Young M D,Wakefield M J,Smyth G K,et al. Gene ontology analysis for RNA-seq:accounting for selection bias[J]. Genome Biology,2010,11(2):R14.
[23]Zhang Z Q,Wang Y F,Chang L Q,et al. MsZEP,a novel zeaxanthin epoxidase gene from alfalfa (Medicago sativa),confers drought and salt tolerance in transgenic tobacco[J]. Plant Cell Reports,2016,35(2):439-453.[HJ2.05mm]
[24]刘启航,曹进军,付晓伟,等. 波谱光照效应对西花蓟马趋光响应变化的影响[J]. 江苏农业科学,2021,49(20):124-132.
[25]Maharijaya A,Vosman B,Steenhuis-Broers G,et al. QTL mapping of thrips resistance in pepper[J]. Theoretical and Applied Genetics,2015,128(10):1945-1956.
[26]Maharijaya A,Vosman B,Pelgrom K,et al. Genetic variation in phytochemicals in leaves of pepper (Capsicum) in relation to thrips resistance[J]. Arthropod-Plant Interactions,2019,13(1):1-9.
[27]van Haperen P,Voorrips R E,van Loon J J A,et al. The effect of plant development on thrips resistance in Capsicum[J]. Arthropod-Plant Interactions,2019,13(1):11-18.
[28]Bac-molenaar J A,Mol S,Verlaan M G,et al. Trichome independent resistance against western flower thrips in tomato[J]. Plant and Cell Physiology,2019,60(5):1011-1024.
[29]Zhou S,Lou Y,Tzin V,et al. Alteration of plant primary metabolism in response to insect herbivory[J]. Plant Physiology,2015,169(3):1488-1498.
[30]Wainberg M,Sinnott-Armstrong N,Mancuso N,et al. Opportunities and challenges for transcriptome-wide association studies[J]. Nature Genetics,2019,51(4):592-599.
[31]Macel M,Visschers I G S,Peters J L,et al. Metabolomics of rhrips resistance in pepper (Capsicum spp.) reveals monomer and dimer acyclic diterpene glycosides as potential chemical defenses.[J]. Journal of Chemical Ecology,2019,45(5/6):490-501.
收稿日期:2022-04-20
基金項目:国家自然科学基金(编号:32160333、32060388);内蒙古自然科学基金(编号:2021MS03011)。
作者简介:爽 爽(1999—),女,内蒙古通辽人,硕士研究生,主要从事草学方面的研究。E-mail:bss@emails.imau.edu.cn。
通信作者:张志强,博士,副教授,主要从事牧草抗逆及品种选育方面的研究。E-mail:zhangzq19890102@126.com。

