甘蓝型油菜响应干旱胁迫的转录组分析
张蕾 阮羽萱 潘娇 陈敏 刘博宇 阮颖 黄勇

摘要:甘蓝型油菜(Brassica napus L.)是我国主要油料作物之一,为国家粮油安全提供了重要保障。干旱严重限制了油菜种植规模扩大、产量与品质提升。为挖掘甘蓝型油菜抗旱的关键基因,阐明油菜耐旱机制,本研究以甘蓝型油菜湘油15为对象,通过实验室模拟干旱处理后的叶片为材料进行转录组测序(RNA-Seq)、生物信息分析并 qRT-PCR 验证。发现转录组样本平均Clean baseas约为9.6 G,且各样品碱基百分比(Q30)大于93.21%,比对到参考基因组上的Reads在89%以上。干旱处理4 h后,湘油15出现了440个差异表达基因(DEGs),其中148个基因上调,292个基因下调。随机选取10个基因(上调与下调各5个)进行qRT-PCR验证,其中9个基因的qRT-PCR结果与 RNA-Seq结果相符,仅1个基因表达趋势相反,相似度可达90%,证实转录组测序结果的可靠性。结果表明甘蓝型油菜湘油15主要通过光合作用、碳代谢和渗透调节等途径调节抗旱能力,为进一步阐明油菜耐旱机制奠定了基础。
关键词:甘蓝型油菜;干旱胁迫;转录组分析;差异表达基因
中图分类号:S634.301文献标志码:A
文章编号:1002-1302(2023)05-0051-05
干旱是全球发生频率最高、影响范围最广、对国民经济造成巨大损失的自然灾害[1-2]。油菜是我国种植面积最广、产量最高的油料作物之一[3],其中甘蓝型油菜是广泛种植于长江中下游区域的油菜品种,但其整个生长期对水的依赖性较强,耐旱性较差。干旱极大地影响了油菜的发育、产量和品质,严重威胁人类的粮油安全[4]。
当遭受干旱胁迫时,植物在一定程度上能够通过自身调节适应环境的变化。气孔是植物散失水分的主要途径,当植物处于干旱胁迫下,将调控叶片气孔闭合以降低蒸腾作用,从而减少植物体内水分流失,进而影响光合作用与碳代谢[5]。此外,植物细胞中的一些离子和渗透调节物质将累积以維持细胞内离子稳态和渗透调节平衡,从而使自身保存水分的能力保持在较高的水平[6]。当植物处于逆境胁迫下,细胞代谢发生紊乱,大量积累的活性氧破坏了生物膜的结构,影响其功能的正常发挥,严重时危害细胞生长,导致植株死亡[7]。为减轻活性氧积累带来的影响,作物进化出复杂的酶和抗氧化剂系统,如低分子抗氧化剂和活性氧清除酶[8]。
转录水平上的调控是生物基因表达的主要调控方式之一,是对生物进行研究的关键组成部分[9]。高通量测序技术的出现,使研究者能够更有效地研究不同处理条件或不同发育过程中基因的差异表达谱,筛选新的功能基因[10-12]。在本研究中,用20%聚乙二醇(PEG-6000)模拟干旱胁迫处理甘蓝型油菜湘油15,借助高通量测序技术进行分析,筛选干旱处理诱导表达基因信息,初步挖掘耐旱基因和代谢通路,构建抗旱性相关的调控网络。为甘蓝型油菜耐旱机制提供理论依据,为培育耐旱品种提供参考。
1 材料与方法
1.1 植物材料和干旱处理
植物材料为甘蓝型油菜湘油15,先将其种子进行表面消毒,后播种于含有霍格兰营养液的蛭石中,温室条件下正常生长45 d(25 ℃,16 h/8 h 光照/黑暗,光照强度为10 000 lx,湿度为40%~60%),长出3~4片真叶后小心洗去蛭石,置于霍格兰营养液中并充气,光照培养箱中预培养3 d,根据营养液体积,加入20%聚乙二醇(PEG-6000)模拟干旱胁迫,处理时间为4 h。选取生长状态基本一致的5株植株进行混合取样,处理前的样品编号为C1、C2、C3,处理后的样品编号为T1、T2、T3。样本于液氮中速冻,保存于-80 ℃中,用于后续试验。
1.2 试验时间与地点
2021年7月21日于湖南省作物表观遗传与发育重点实验室进行。
1.3 转录组测序
样品由百迈克生物科技(长沙)有限公司进行RNA提取、质量分析、cDNA文库构建和转录组测序分析[13]。
1.4 差异表达基因的筛选和分析
首先对样品中Mapped Reads数目与转录本长度归一化,以FPKM方法作为检测转录本或基因表达水平的指标[14]。时间和空间特异性是基因表达的2个特性,当处于不同的条件下,表达水平具有显著差异的基因或转录本称为差异表达基因(DEGs)。根据不同样品间的相对表达水平,可将DEGs划分为下调基因和上调基因。利用R语言 DESeq2 程序包对过滤后的数据进行筛选来获得DEGs,筛选标准为:差异倍数(fold change,简称FC)大于2,即|log2FC|≥1;错误发现率(false discovery rate,简称FDR)小于0.01[15],FDR是通过对差异显著性P值(p-value)进行校正得到的,即p-value<0.01。使用 Blast2GO软件对差异基因进行基因功能注释。
1.5 通过qRT-PCR验证差异表达
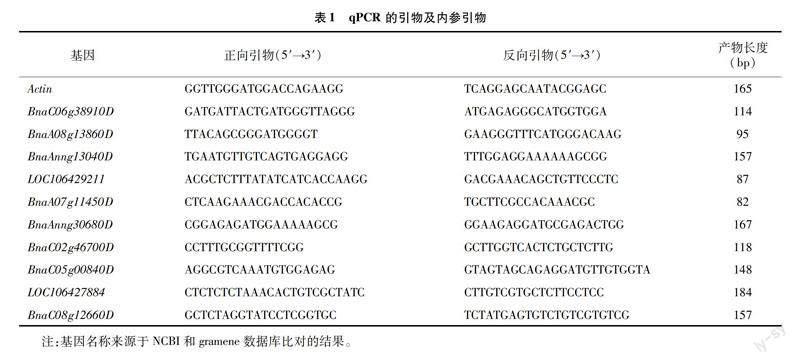
随机选取10个DEGs(上、下调基因各5个)进行实时荧光定量分析(qRT-PCR)验证转录组测序中差异基因表达的准确性。通过Trizol法提取转录组测序备份样品的总RNA,每样品取1 ng RNA通过擎科生物cDNA合成试剂盒反转录,最终cDNA体积为20 μL。qPCR引物设计见表1。qRT-PCR使用Applied Biosystems 7300实时PCR系统,设置3次技术重复,使用2-ΔΔCT法计算相对定量数据。
2 结果与分析
2.1 转录组测序质量分析
转录组测序分析对照组和干旱处理试验组各3个样本。高通量测序后,为保证数据分析的质量,对原始数据进行过滤得到clean reads。整体上分析,干旱处理组和对照组的3个重复平均reads数分别约为34 094 369、30 190 757,样本平均碱基数约为9.6 G,且各样品Q30碱基百分比在93.21%及以上,GC含量为47.57%~48.8%。使用 HISAT2比对系统分析得到,各样品reads与参考基因组的比对效率在89.18%~91.65%(表2)。整体测序数据质量良好,可用于后续分析。
2.2 差异表达基因分析
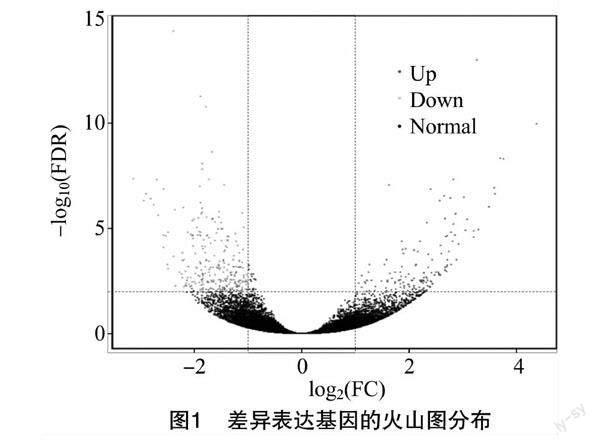
利用DESeq2对甘蓝型油菜各样本的转录组数据进行分析,以P值<0.01且差异倍数|log2FC|≥1作为显著差异表达基因的筛选条件。从图1可知,对照组和试验组(C vs T)中鉴定到DEGs共有440个,其中148个DEGs表达上调,292个DEGs表达下调。
2.3 差异表达基因GO分析
以P≤0.01为标准将差异表达基因进行GO注释。根据差异基因对应的生物过程、分子功能和细胞组分的不同,分别进行 GO 富集分析。数据结果统计发现,生物过程主要集中在韧皮部蔗糖的装载、
应对镉离子、磷酸戊糖分流、糖酵解、叶绿体移动等(图2-A);分子功能主要集中在果糖二磷酸醛缩酶活性、磷酸核酮糖激酶活性、吡哆醛磷酸的结合等(图2-B);细胞组分主要集中在胞质核糖体、质膜、质外体、叶绿体被膜等(图2-C)。结果表明,甘蓝型油菜在干旱胁迫下的差异表达基因主要与植物生长发育如光合作用和糖代谢过程有关。甘蓝型油菜可以通过体内细胞全方位的协调作用来减少外部恶劣环境对植物体所造成的伤害,同时调节内部代谢活动以保证植物的基本生长。
2.4 差异表达基因KEGG分析
为分析在干旱胁迫下甘蓝型油菜发育过程中体内代谢途径的变化,对差异基因进行 KEGG 分类统计(P<0.01)。这些差异基因主要富集通路包括碳代谢、乙醛酸和二羧酸代谢、氨基酸生物合成和代谢、磷酸戊糖途径(图3)。代谢途径分析表明,干旱胁迫对甘蓝型油菜的碳代谢、氨基酸代谢有影响。
2.5 差异表达基因的qRT-PCR验证
随机选取上调与下调各5个差异表达基因验证转录组测序结果的可靠性,通过qRT-PCR验证干旱处理前后的表达水平,将所选基因的相对表达与RNA-seq分析的相对表达进行比较,结果表明,qRT-PCR结果的相对趨势与RNA-seq数据基本一致,证明本研究RNA-seq结果的可靠性(图4)。
3 讨论与结论
光合作用直接影响作物生长发育及产量,干旱环境中光合作用强度是衡量作物抗旱能力的重要依据[16-17]。笔者发现,差异表达基因GO和KEGG注释到的结果与光合作用、碳代谢、渗透调节有关,研究结果与前人在不同物种的发现较为一致。研究发现,棉花[18-19]和苏丹草[20]干旱转录组的KEGG代谢通路显著富集于光合作用中。对梭梭[21]和甘蓝型油菜[22]的干旱转录组分析表明,其KEGG富集于碳代谢等过程。碳水化合物可以为逆境下的植物提供基本能量以维持正常生命活动,同时还可以作为体内信号分子调节一系列代谢反应以适应不利环境[23]。植物受到水分胁迫时,渗透调节系统会改变植物的物质代谢过程,一些大分子物质如蛋白质、淀粉等会分解成小分子有机物如可溶性糖和氨基酸等[24],它们能作为渗透调节因子保持植物体内渗透压的平衡,保护逆境环境中的植物细胞。对干旱胁迫棉花的转录组分析显示,差异表达基因显著富集在渗透调节系统上[13]。
在干旱胁迫期间,为通过调节细胞过程在干旱条件下生存,植物中的基因表达发生了显著变化[25]。通过差异基因表达方法阐明植物的耐旱性,为确定可能的耐旱机制提供了有价值的信息。对低温胁迫下云雾贡茶进行转录组分析,筛选并鉴定了差异基因CsPPO具有提高植物耐寒性的功能[26]。对盐碱胁迫下的紫花苜蓿转录组分析筛选到差异基因MsNAC47,对其功能研究发现MsNAC47通过调控钙离子的转运使植物抵御盐碱胁迫[27]。在本研究中,PEG-6000模拟干旱处理前后湘油15共有440个DEGs,其中148个表达上调,292个表达下调, 并随机对其中10个DEGs进行qRT-PCR进行验证。
虽然结果与RNA-seq检测的基因表达量上调或下调的倍数存在差异,但这两者的趋势基本一致,表明转录组测序富集到DEGs数据是准确的,推测此DEGs对于甘蓝型油菜抗旱有调控作用,可以进行基因克隆与功能验证等深入研究。
项目有效地筛选了甘蓝型油菜湘油15干旱胁迫响应基因,这些基因主要调控光合作用、碳代谢和渗透调节等过程,研究结果为阐明甘蓝型油菜的耐旱机制提供了参考。
参考文献:
[1]韩兰英. 气候变暖背景下中国农业干旱灾害致灾因子、风险性特征及其影响机制研究[D]. 兰州:兰州大学,2016.
[2]李茂松,李 森,李育慧. 中国近50年旱灾灾情分析[J]. 中国农业气象,2003,24(1):7-10.
[3]张治礼,郑学勤,吕应堂. 内源细胞分裂素调控油菜叶片衰老进程的研究[J]. 作物学报,2005,31(1):1-6,137.
[4]黄 倩,赵永国,黄祥伟,等. 甘蓝型油菜蕾薹期抗旱相关性状的QTL分析[J]. 干旱地区农业研究,2017,35(6):88-94.
[5]Wilkinson S,Davies W J. Drought,ozone,ABA and ethylene:new insights from cell to plant to community[J]. Plant,Cell & Environment,2010,33(4):510-525.
[6]Anjum S,Xie X Y,Wang L C,et al. Morphological,physiological and biochemical responses of plants to drought stress[J]. African Journal of Agricultural Research,2011,6(9):2026-2032.
[7]张 妍. 外源EBR和NO增强华北驼绒藜耐盐及耐旱性的生理机制研究[D]. 呼和浩特:内蒙古大学,2021.
[8]谭筱玉. 利用转录组解析油菜苗期响应干旱和盐胁迫的分子机制[D]. 武汉:华中农业大学,2020.
[9]胡玉锋,金峰学,程云清,等. 干旱胁迫下玉米苗期的转录组分析[J]. 东北农业科学,2021,47(6):48-52.
[10]Malinich E A,Wang K,Mukherjee P K,et al. Differential expression analysis of Trichoderma virens RNA reveals a dynamic transcriptome during colonization of Zea mays roots[J]. BMC Genomics,2019,20(1):1-19.
[11]Kumar M,Kim I,Kim Y K,et al. Strigolactone signaling genes showing differential expression patterns in Arabidopsis max mutants[J]. Plants,2019,8(9):352.
[12]Zhu J Y,et al. Comprehensive co-expression analysis provides novel insights into temporal variation of flavonoids in fresh leaves of the tea plant (Camellia sinensis)[J]. Plant Science,2020,290:110306.
[13]包秋娟. 干旱胁迫下棉花转录组分析[D]. 乌鲁木齐:新疆大学,2018. [HJ1.8mm]
[14]Mortazavi A,Williams B A,McCue K,et al. Mapping and quantifying mammalian transcriptomes by RNA-Seq[J]. Nature Methods,2008,5(7):621-628.
[15]陈智勇. 甘蓝型油菜叶片生长对干旱胁迫的响应分析[D]. 福州:福建农林大学,2020.
[16]Galmés J,Medrano H,Flexas J. Photosynthetic limitations in response to water stress and recovery in Mediterranean plants with different growth forms[J]. New Phytologist,2007,175(1):81-93.
[17]吴金芝,黄 明,王志敏,等. 干旱对冬小麦旗叶光合参数、产量和水分利用效率的影响[J]. 江苏农业学报,2021,37(5):1108-1118.
[18]Singh R,Pandey N,Naskar J,et al. Physiological performance and differential expression profiling of genes associated with drought tolerance in contrasting varieties of two Gossypium species[J]. Protoplasma,2015,252(2):423-438.
[19]Chen Y,Liu Z H,Feng L,et al. Genome-wide functional analysis of cotton (Gossypium hirsutum) in response to drought[J]. PLoS One,2013,8(11):e80879.
[20]Zhu Y Q,Wang X,Huang L K,et al. Transcriptomic identification of drought-related genes and SSR markers in Sudan grass based on RNA-seq[J]. Frontiers in Plant Science,2017,8:687.
[21]Long Y,Zhang J W,Tian X J,et al. De novo assembly of the desert tree Haloxylon ammodendron (C.A.Mey.) based on RNA-Seq data provides insight into drought response,gene discovery and marker identification[J]. BMC Genomics,2014,15(1):1111.
[22]王力敏. 甘藍型油菜应答干旱胁迫的组学研究[D]. 武汉:华中农业大学,2017.
[23]李 亮. 玉米雄穗响应干旱胁迫的主要代谢途径解析及耐旱SNAC基因筛选鉴别[D]. 乌鲁木齐:新疆农业大学,2015.
[24]张 华. AM真菌对小叶锦鸡儿和蒙古扁桃生长、抗旱性及总黄酮含量的影响[D]. 呼和浩特:内蒙古大学,2013.
[25]Shanker A K,Maheswari M,Yadav S K,et al. Drought stress responses in crops[J]. Functional & Integrative Genomics,2014,14(1):11-22.
[26]王 莹. 云雾贡茶低温胁迫下的转录组分析及CsPPO基因的功能鉴定[D]. 贵阳:贵州大学,2021.
[27]安逸民. 紫花苜蓿响应盐碱胁迫的转录组分析及MsNAC47基因的功能研究[D]. 哈尔滨:哈尔滨师范大学,2021.
收稿日期:2022-06-21
基金项目:国家自然科学基金面上项目(编号:31971834);湖南省教育厅优秀青年项目(编号:19B266)。
作者简介:张 蕾(1998—),女,湖南衡阳人,硕士研究生,从事植物分子生物学研究。E-mail:zl8398@163.com。
通信作者:黄 勇,博士,教授,从事分子生物学研究。E-mail:yonghuang@hunau.edu.cn。

