广西南宁火龙果溃疡病病原菌鉴定与室内药剂毒力测定
叶维雁 潘如军 黄秋伟 黄运鹏 郑文武 单彬
(广西壮族自治区亚热带作物研究所 广西南宁 530001)
火龙果(Hylocereus undulatesBritt.)又名红龙果、青龙果和仙蜜果等,是仙人掌科(Cactaceae)量天尺属(Hylocereus)多年生植物[1-2],原产于南美、北美及中美洲热带地区,目前在我国的广西、海南、广东、云南和福建等省(自治区)均有大规模种植,是一种新兴的热带亚热带果树[3-5],果实外形亮丽、口感清甜[6]。随着火龙果种植面积的扩大,溃疡病的危害日益突出,该病严重影响果实品质和产量。2012 年在台湾首次发现了火龙果溃疡病由新暗色柱节孢引起[7],之后在广东、海南和贵州陆续的鉴定结果表明,火龙果溃疡病的病原菌为新暗色柱节孢[8-10]。目前,广西南宁市火龙果年产量达32 万t,占全国火龙果总产量的20%[11],但当地火龙果溃疡病的病原菌尚未明确。本研究拟采用形态学观察和分子序列分析法对南宁火龙果溃疡病病原菌进行鉴定,并测定不同药剂对该病原菌室内毒力大小,以期为该病害的防控提供理论基础。
1 材料与方法
1.1 材料
1.1.1 供试样品2021 年6 月在广西南宁市桂热1 号火龙果种植区采集具有典型溃疡病症状的火龙果枝条装入自封袋,拍照记录症状特点,编号,带回实验室用于分离溃疡病病原菌。采集健康无病虫害的桂热1 号火龙果枝条用于测定病原菌的致病性。
1.1.2 培养基和试剂马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基,杭州百思生物技术有限公司;Biospin 真菌基因组DNA 提取试剂盒,杭州博日科技有限公司;无水乙醇,成都市科隆化学品有限公司;2×Es Taq Master Mix,康为世纪;琼脂糖,Invitrogen;杀菌剂见表1。
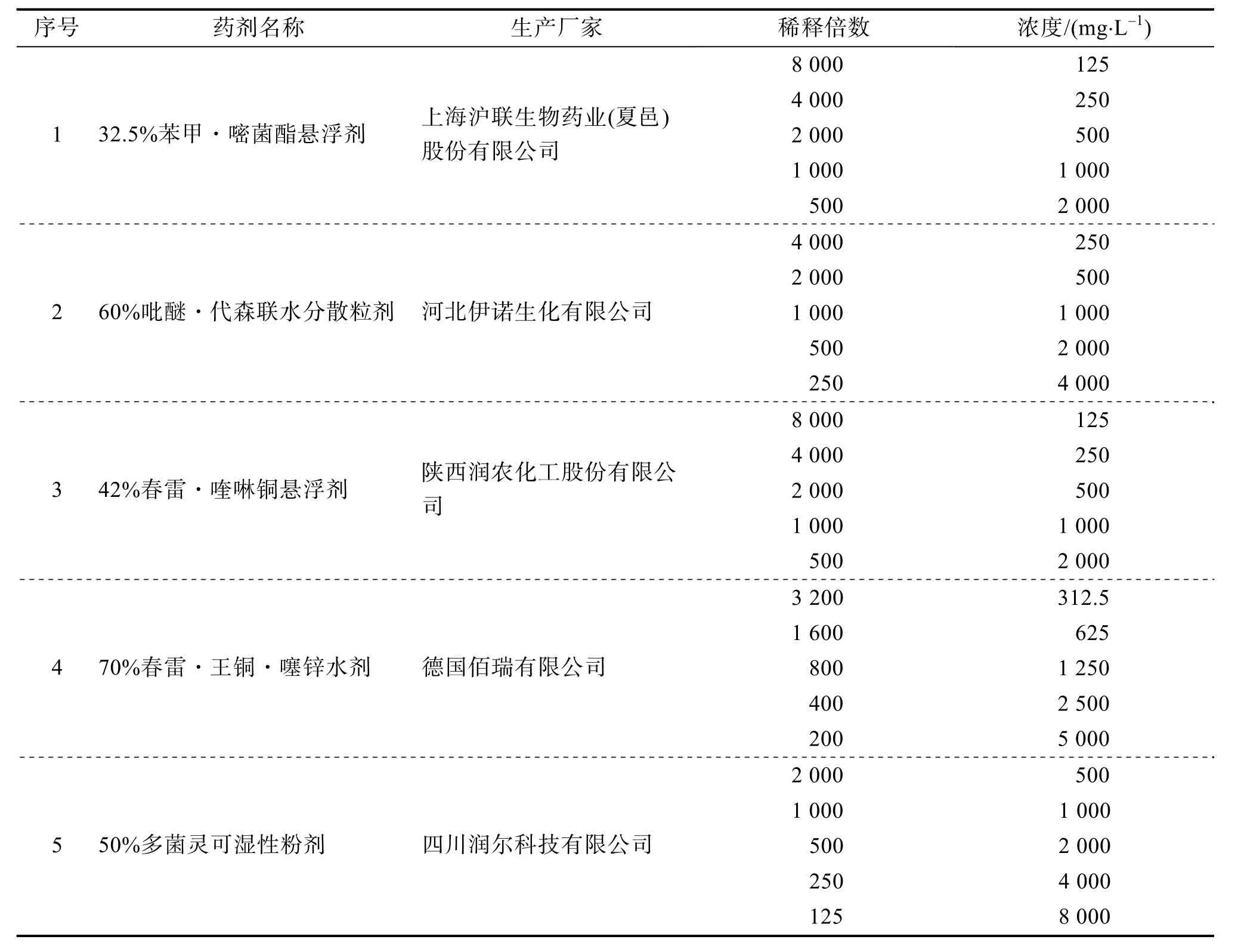
表1 供试药剂
1.1.3 仪器Easy Cycler 梯度PCR 仪,德国AnalytikJena;5200Multi 全自动化学发光/荧光图像分析系统,上海天能;DYY-8C 电泳仪电源和DYCP-31DN 电泳仪,北京六一生物科技有限公司;徕卡DM2500 显微镜,Leica Microsystems。
1.2 方法
1.2.1 病原菌的分离纯化采用组织分离法[12]分离火龙果溃疡病病原菌,培养基为PDA。用自来水将带病枝条表面冲洗干净,晾干。在超净工作台上,用75%酒精浸泡枝条10 s,用无菌蒸馏水冲洗5 次,从病健交界处切取大小约5 mm×5 mm 的组织块,将组织块置于消毒滤纸上吸干水分,转移到PDA 平板上,于28℃恒温培养箱中培养,待组织块周围长出菌落后挑取边缘菌丝进行纯化,将纯化后的菌株进行编号,并转移到PDA斜面,于4℃保存待用。
1.2.2 病原菌的致病性测定利用柯赫氏法则测定病原菌的致病性。采用离体枝条接种法,将4℃保存的病原菌菌株接种到PDA 平板上活化,至菌落长满培养皿,待用;用自来水洗净火龙果枝条,经75%酒精表面消毒、无菌蒸馏水冲洗5次后,晾干备用;用牙签轻轻地刺破枝条表皮,用直径为5 mm 的打孔器在菌落边缘取菌饼紧贴于被刺伤的枝条表面,将略大于菌饼的无菌滤纸片覆盖于菌饼,滴加无菌蒸馏水保湿,以接种无菌PDA 培养基的枝条为对照(牙签和打孔器均经过无菌处理),处理5 根枝条,重复3 次;将接种后的枝条置于无菌保鲜盒中,盒底铺浸透无菌蒸馏水的滤纸,置于室温下,自然光照;每日观察记录枝条发病情况,若发病症状与田间自然发病症状相同且对照不发病,则对发病枝条病变部位进行病原菌再分离,并鉴定分离到的病原菌是否与原始病菌相同。
1.2.3 病原菌的形态学鉴定将病原菌接种在PDA 培养基上,在28℃恒温培养,观察菌落形态及颜色,在光学显微镜下观察孢子形态特征,参照相关资料[13],进行分类学鉴定。
1.2.4 病原菌的分子鉴定将分离到的病原菌于PDA 平板上活化5 d 后,用接种针刮下培养基表面的菌丝并收集至2 mL 平底离心管中,采用Biospin 真菌基因组 DNA 提取试剂盒提取病原菌DNA,于-20℃保存备用。以病原菌DNA 为模版,用通用引物ITS1(5′—TCCGTAGGTGAACCTGCGG—3′)和ITS4(5′—TCCTCCGCTTATTGATATGC—3′)[14]进行PCR 扩增,引物由生工生物工程(上海)股份有限公司合成。40 μL PCR反应体系:10 μmol/L 上下游引物各1 μL、2×Es Taq Master Mix 20 μL、DNA 模版1 μL,加ddH2O至40 μL。PCR 反应程序:94℃预变性5 min;94℃变性30 s,56℃退火30 s,72℃延伸30 s,共35 个循环;最后72℃延伸5 min。扩增产物经1.2%琼脂糖凝胶电泳检测,电泳验证正确后,将扩增产物送至广州擎科生物技术有限公司进行测序。将测序所得序列于NCBI 网站上与已知序列进行BLAST 序列比对,用MEGA 6.06 软件以邻接法(Neighbor-joining, NJ)构建系统发育树。
1.2.5 药剂室内毒力测定选用市面上常见的5种杀菌剂(表1)进行试验,以菌丝生长速率法测定杀菌剂对火龙果溃疡病病原菌的室内抑菌活性。在无菌操作条件下,用无菌蒸馏水将供试杀菌剂配成5 个浓度梯度的药液,用10 mL 量杯量取9 mL PDA 培养基(约55℃)倒于培养皿中;再用移液枪吸取1 mL 药液滴加到PDA 培养基中,轻轻晃动培养皿,使药液和培养基混合均匀,每种杀菌剂均制备成5 个浓度的梯度平板(表1),另以1 mL 无菌蒸馏水和9 mL PDA 培养基混合形成的平板作为对照;用直径为5 mm 的无菌打孔器在活化适龄的病原菌菌落边缘打取菌饼,接于含药平板和空白对照平板中央,每个平板接种1个菌饼,共25 个处理,每个处理3 次重复;将接种后的平板置于28℃恒温培养箱中培养,3 d 后用十字交叉法测量菌落直径并计算抑菌率,用DPS 软件进行数据分析,求出各杀菌剂对病原菌的毒力回归方程、EC50值和相关系数。根据EC50值大小评价不同药剂的抑菌效果。
抑菌率=(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)×100%
2 结果与分析
2.1 火龙果溃疡病田间症状
该病危害火龙果茎秆和果实,从嫩芽抽生到开花结果期间均可发生。茎秆发病症状(图1-a)为:初期表面出现近圆形凹陷的褪绿病斑,病斑逐渐转为橘黄色,严重时病斑成片发生,甚至布满病枝;后期形成较大的灰白色溃疡斑,病斑中央略微凹陷,四周稍微隆起,病斑上常产生小黑点,部分病斑边缘形成水渍状,严重时整根枝条腐烂。

图1 火龙果溃疡病发病症状
2.2 病原菌分离与形态特征
通过分离和纯化,共获得15 个病原菌菌株,这些菌株在PDA 平板上的性状表现一致。选取其中代表性菌株PKY01 进行形态特征观察,该菌株在PDA 培养基上生长较快,28℃培养2 d 即可形成白色圆形菌落,呈绒毛状,菌丝白色稀疏,边缘整齐,呈辐射状向外扩展(图2-a、2-b);3 d后菌落长满培养皿(90 mm);5 d 后,菌落逐渐转为灰绿色,气生菌丝长而稀疏(图2-c、2-d);7 d 后菌落逐渐转为黑色;10 d 后培养基除中圈外完全变黑(图2-e、2-f)。病原菌菌丝断裂形成节孢子链,节孢子形态多样,为椭圆形、卵圆形、圆形或杆状(图3-a);节孢子细胞壁加厚,形成厚垣孢子,呈椭圆形或卵圆形(图3-b)。根据形态学特征,初步判定病原菌为新暗色柱节孢。

图2 病原菌在PDA 培养基上的菌落形态

图3 病原菌显微形态(400×)
2.3 病原菌的分子生物学鉴定
病原菌菌株 PKY01(OP522024)、PKY02(OP522025)和PKY03(OP522026)的ITS 序列测序长度均为 553 bp。将其序列在 NCBI 上进行BLAST 比对,结果显示,3 个ITS 序列与4 株新暗色柱节孢(JX473739、JX524168、OP271888和OP271889)的ITS 核苷酸序列同源性均达到100%。选取Genebank 登录的同源性高低不同的菌株ITS 序列,利用MEGA 软件的邻接法对病原菌菌株的ITS 序列构建系统发育树(图4)。结果表明,病原菌菌株PKY01、PKY02、PKY03 与4株新暗色柱节孢(JX473739、JX524168、OP271888和OP271889)位于同一分支。根据形态学特征以及rDNA-ITS 序列分析结果,将火龙果溃疡病病原菌鉴定为新暗色柱节孢。
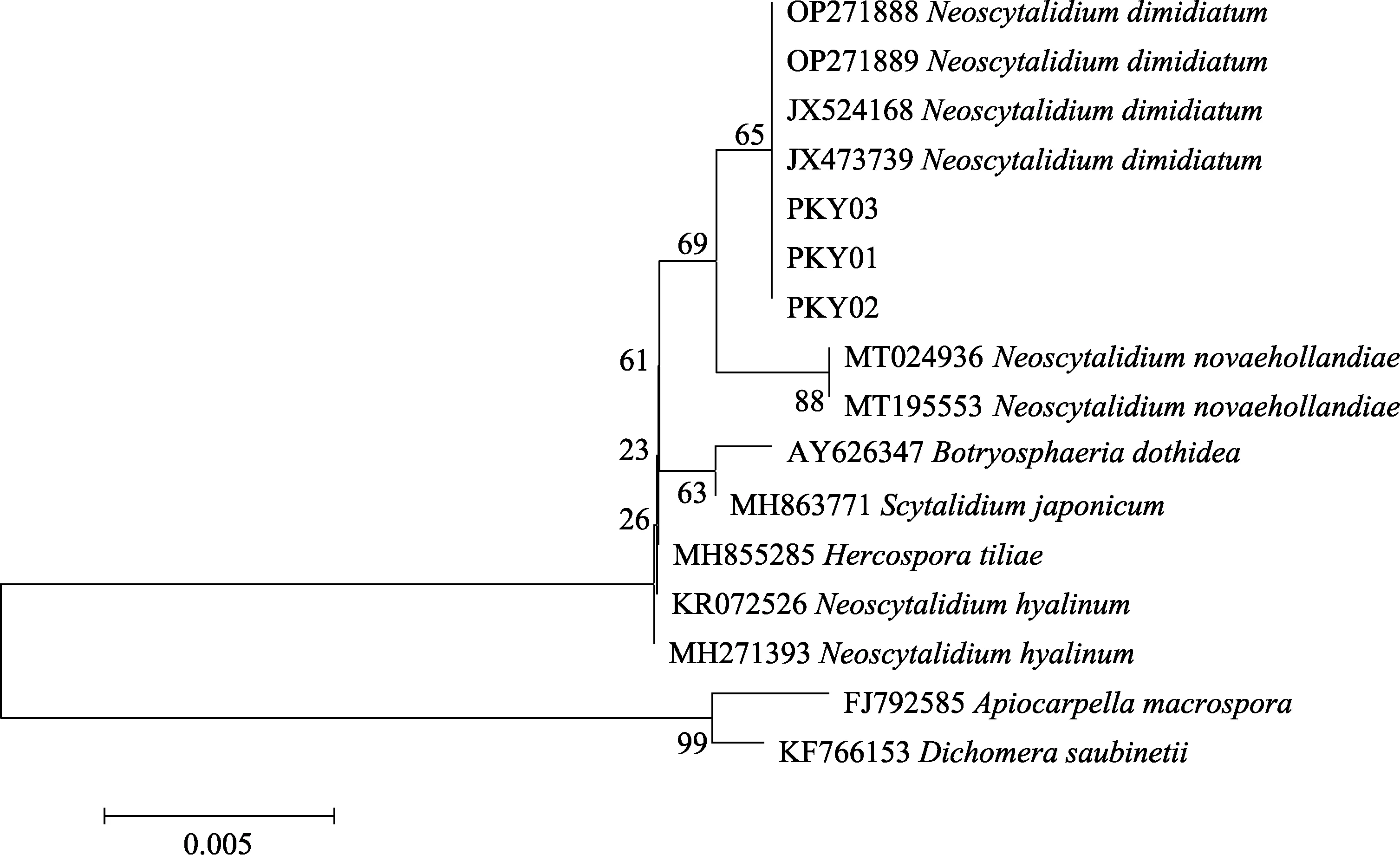
图4 基于ITS 序列的系统发育树
2.4 病原菌的致病性测定
将分离得到的新暗色柱节孢菌株接种到火龙果健康枝条上,接种第10 天出现与田间自然发病形态相似的溃疡病斑(图1-a、1-b),而对照未发病(图1-c)。在接种枝条上取发病组织分离,重新获得了新暗色柱节孢菌,完成柯赫氏法则验证,证明火龙果溃疡病的病原菌为新暗色柱节孢。
2.5 药剂室内毒力测定
室内抑菌试验结果(表2)表明,5 种杀菌剂对火龙果溃疡病病原菌菌丝生长表现出不同程度的抑制作用。其中春雷·王铜·噻锌的抑菌效果最好,EC50为0.195 0 mg/L;吡醚·代森联和春雷·喹啉铜也有较好的抑菌效果,EC50分别为1.157 0 和1.193 2 mg/L;苯甲·嘧菌酯的抑制效果较差,EC50为2.468 8 mg/L,大于2 mg/L;多菌灵对病原菌的毒力最弱,EC50高达4.016 3 mg/L。

表2 五种药剂对火龙果溃疡病病原菌的室内毒力
3 讨论与结论
目前,在传统形态特征和生理生化指标鉴定的基础上,ITS 片段被推荐作为真菌的DNA 条形码[15],已被广泛应用于果树真菌病原菌的种类鉴定[16-19],极大地提高了果树病原种类鉴定的准确度。本研究从广西南宁市火龙果溃疡病病样中分离获得病原真菌,结合形态学观察、致病性验证和基于rDNA-ITS 序列分析的分子生物学鉴定,明确火龙果溃疡病的病原菌为新暗色柱节孢(Neoscytalidium dimidiatum),与国内相关报道的研究结果[8-10,20-21]一致。
火龙果溃疡病近年来对火龙果产业造成巨大的经济损失,是火龙果最严重的病害之一,杀菌剂是有效防控火龙果溃疡病的重要手段。对于该病害的防治研究已有相关报道,贤小勇等[22]认为,吡唑醚菌酯、嘧菌酯和戊唑醇对火龙果溃疡病均具有良好的防效,可作为防治火龙果溃疡病的药剂在生产上推广应用;魏雅丽等[23]通过抑菌实验,从抑菌圈的大小初步鉴定多菌灵为火龙果溃疡病的有效杀菌剂。本研究采用菌丝生长速率法测定5 种常用杀菌剂对火龙果溃疡病病原菌的室内毒力,结果显示,5 种杀菌剂对火龙果溃疡病病原菌菌丝生长均具有一定的抑制作用,其中70%春雷·王铜·噻锌水剂对病原菌的抑制作用最强,EC50为0.195 0 mg/L,其次为60%吡醚·代森联水分散粒剂和 42%春雷·喹啉铜悬浮剂,EC50分别为1.157 0 和1.193 2 mg/L。本研究测得多菌灵的EC50为4.016 3 mg/L,高于王会会等[9]测得的0.183 2 mg/L,可能是因为不同的病原菌菌株对多菌灵的敏感性存在较大差异。
药剂室内毒力是通过杀菌剂与病原菌菌丝直接接触时产生的效果来测定,是衡量杀菌剂对病原菌毒力作用大小的指标之一,但其结果仅代表药剂对病菌的室内抑制效果,具有局限性,田间防治效果不仅与药剂室内毒力有关,还与病原菌的孢子[24]、杀菌剂的特性[25-27]、寄主植物的生长环境[28]和生长状况等因素有关。因此,基于本研究的试验结果,后期拟选用70%春雷·王铜·噻锌水剂、60%吡醚·代森联水分散粒剂和42%春雷·喹啉铜悬浮剂进行更接近生产实际的田间药效试验,明确适合田间防治火龙果溃疡病的杀菌剂,为火龙果溃疡病防治提供理论依据。

